乳腺癌细胞来源的外泌体对乳腺癌BT549细胞增殖、侵袭和迁移的影响
王军 郑文祥 周娜 高帅2 侯琳
(1 青岛大学基础医学院生物化学与分子生物学系,山东 青岛 266021; 2 青岛大学附属妇女儿童医院心脏中心)
乳腺癌是最常见的恶性实体肿瘤之一,在全球范围内其发病率排在了第1位,在女性的恶性肿瘤中占比约为20%,是女性的主要死亡原因之一[1-2]。由于乳腺癌早期筛查工作的普及,可以做到早期发现确诊[3-4],乳腺癌早期经手术、放疗、化疗以后可取得较好的预后,但晚期乳腺癌的预后仍不理想,患者总体生存率仅为26%[5-6]。而且乳腺癌易转移和复发,严重影响了患者的生存时间和质量[7]。外泌体是细胞分泌的由核酸(如ncRNA、DNA)及蛋白质、脂质等组成的具有磷脂双分子层的椭圆形外囊泡分子,直径40~100 nm,广泛存在于血液、尿液、羊水、腹水等体液中[8-10]。外泌体作为一种重要的介体,常被称为癌症调节剂,对肝癌、肺癌等肿瘤的扩散和转移、血管生成以及肿瘤微环境的构建发挥重要作用[11-12]。目前国内外关于肿瘤细胞自身所分泌的外
泌体与肿瘤的相关性研究并不多,本研究就乳腺癌BT549细胞自身分泌的外泌体对乳腺癌细胞的细胞功能学的影响进行研究,探讨自身分泌的外泌体对细胞自身的增殖、侵袭和转移的影响。 现将结果报告如下。
1 材料与方法
1.1 细胞与试剂
人乳腺癌BT549细胞系购自中国科学院上海生物研究所细胞资源中心;DMEM培养基、胰蛋白酶消化液、胎牛血清购自美国HyClone公司;青链霉素混合液购自北京索莱宝生物科技有限公司;CCK-8试剂盒购自上海汉恒生物科技有限公司;牛血清白蛋白 (BCA)蛋白浓度测定试剂盒购自北京索莱宝生物科技有限公司;TSG101抗体、CD63抗体购自英国Abcam公司。
1.2 细胞的培养
乳腺癌BT549细胞在含体积分数0.10胎牛血清(FBS)、10×107U/L青霉素与10 g/L链霉素的DMEM培养基中培养,置于37 ℃、含体积分数0.05 CO2细胞培养箱中培养,细胞密度达 90%以上时, 用胰蛋白酶消化液消化,收集细胞制成单细胞悬液,细胞计数,将细胞传代于6孔板中。
1.3 外泌体的提取
使用超速离心法对BT549细胞培养上清液进行外泌体的提取和纯化。当乳腺癌BT549细胞密度达50%左右时,更换培养基为含体积分数0.10 FBS的不含外泌体DMEM培养基,继续培养 24 h,收集细胞培养上清液;4 ℃下依次以1 000 r/min离心10 min,5 000 r/min离心10 min,10 000 r/min离心30 min,每次离心后分别收集上清液以后再进行下一次的离心操作,最后以100 000 r/min离心90 min后弃掉上清液,收集沉淀物,以PBS缓冲液重悬后,再以100 000 r/min离心90 min,然后收集沉淀物,获得外泌体。用100 μL PBS缓冲液重悬外泌体,如立即使用保存于4 ℃冰箱,长期使用保存于-80 ℃超低温冰箱。
1.4 外泌体的形态观察
取上述提取的外泌体溶液10 μL,滴于铜网支持膜上,室温静置 2 min,用滤纸吸干多余液体;将质量分数为0.02的磷钨酸溶液10 μL滴加在铜网上,室温负染 2 min, 滤纸吸干多余液体;白炽灯下晾干15 min,于80~120 kV工作电压下,以透射电子显微镜观察外泌体的形态及大小,拍照保存。
1.5 蛋白免疫印记(Western-blot)实验检测外泌体标志蛋白
严格参照蛋白质微量提取试剂盒说明书的步骤操作,从提取的外泌体中提取总蛋白,采用 BCA法测定蛋白浓度。将提取的蛋白加入含体积分数0.25的十二烷基硫酸钠的缓冲溶液中,沸水浴5 min,冷却后离心,取定量蛋白进行SDS蛋白电泳,PVDF 转膜,快速封闭液封闭15 min,一抗室温孵育2.5 h后,TBST溶液洗膜,二抗室温孵育1.5 h,TBST溶液洗膜,ECL显影液显影,拍照并保存。
1.6 CCK-8法检测外泌体对BT549细胞增殖影响
乳腺癌BT549细胞生长密度达85%~90%且处于对数生长期时,以胰蛋白酶进行消化,吹打细胞成单细胞悬液,计数细胞后接种于96孔板中,每孔接种2 000个细胞,设置5个复孔。实验分为对照组(仅含有乳腺癌BT549细胞,不含有外泌体的培养基)、实验组(含乳腺癌BT549细胞及其外泌体的培养基),分别在共培养0、12、24、36、48 h后,按照CCK8试剂盒的说明书步骤每孔加入10 μL CCK-8溶液,于CO2细胞培养箱中孵育2.5 h后,以酶标仪测量各孔在450 nm波长处的吸光度值。
1.7 细胞划痕实验检测外泌体对BT549细胞迁移的影响
使用细胞划痕实验检测外泌体对BT549细胞迁移的影响。取细胞生长密度达到85%~90%时的BT549细胞,胰蛋白酶消化细胞,吹打细胞制成单细胞悬液,细胞计数后接种于6孔板之中,每孔约50 000个细胞。当细胞生长密度达到95%时,用无血清培养基饥饿处理12 h,用枪头垂直于6孔板标线画线,用PBS缓冲液冲洗2次,实验组加入无血清且含有外泌体培养基,对照组加入无血清且不含有外泌体的培养基,分别于BT549细胞培养0、24 h时,用倒置显微镜观察并拍照,用Image J软件测量愈合面积并计算细胞迁移率。细胞迁移率=(0 h划痕面积-24 h培养后划痕面积)/0 h划痕面积×100%。
1.8 Transwell实验检测外泌体对BT549细胞侵袭的影响
取细胞生长密度达到85%~90%时BT549细胞,用无血清培养基饥饿处理12 h,胰蛋白酶消化细胞,吹打细胞制成单细胞悬液。细胞计数调整细胞浓度为200×106个/L,将200 μL细胞悬液接种于Transwell小室的上室,下室加入600 μL体积分数0.30血清的培养基,培养箱孵育24 h。甲醇固定10 min后,以质量分数0.01的结晶紫染色液染色20 min,倒置显微镜下观察并拍照,用Image J软件计算穿过基质胶的细胞数。
1.9 统计学方法
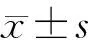
2 结 果
2.1 外泌体形态观察以及外泌体标志蛋白的检测结果
透射电子显微镜下观察可见外泌体形状为经典的椭圆形,直径40~100 nm,外包被一层磷脂双分子膜(图1A)。Western-blot实验检测结果显示,在提取的外泌体中检测到其标志性的蛋白TSG101、CD63蛋白(图1B)。
2.2 外泌体对BT549细胞增殖、迁移及侵袭的影响结果
将BT549细胞自身分泌的外泌体与BT549细胞共培养0、12、24、36、48 h,观察两组细胞增殖情况,重复测量设计的方差分析结果显示,时间、组别、时间与组别对乳腺癌细胞BT549增殖能力均有明显影响(F时间=970.316,F组别=117.178,F时间*组别=28.318,P<0.001)。单独效应分析结果显示,与0 h相比,两组细胞的增殖能力明显增强(F=592.84、1 126.15,P<0.001);与对照组相比,共培养24、36、48 h时实验组的细胞增殖能力明显高于对照组细胞(F=12.99~50.95,P<0.001)。见表1。

A:透射电子显微镜下观察外泌体形态和大小,B:外泌体标志蛋白

表1 外泌体对BT549细胞增殖能力的影响
细胞划痕实验结果示,对照组和实验组的细胞迁移率分别为0.55±0.02和0.79±0.02,两组比较差异有显著性(t=8.93,P<0.01)。见图2。

A:对照组BT549细胞迁移情况,B:实验组BT549细胞迁移情况
Transwell实验结果显示,对照组和实验组透过基质胶的细胞个数分别为21.33±1.45和12.33±1.20,两组比较具有显著差异(t=4.73,P<0.01)。见图3。

A:对照组BT549 细胞侵袭情况,B:实验组BT549 细胞侵袭情况
3 讨 论
外泌体为一个纳米级的囊泡,在细胞之间、细胞与微环境之间的物质交换和信号传导中发挥着重要的桥梁作用[13]。肿瘤细胞的信号传导和物质交换方式主要有两种,一种是细胞与细胞间的直接物质交换和信号传导,另一种是通过周围细胞进行间接的物质交换和信号传导。外泌体的主动释放机制是一种肿瘤细胞与周围的细胞相互作用的新机制,外泌体将其内含的物质传递给周围细胞,实现细胞间的物质交换和信号转导[8]。外泌体通过多种途径促进肿瘤的增殖侵袭与转移,如增加肿瘤的侵袭与转移能力和促进上皮间质转化与转移前微环境形成;增加肿瘤的血管形成,改变血管的通透性,参与形成免疫抑制微环境维持细胞增殖;逃避机体的免疫监督,在形成肿瘤代谢微环境等多方面发挥着重要作用[14-15]。本文研究了乳腺癌BT549细胞分泌的外泌体对乳腺癌细胞自身的增殖、侵袭和转移的影响,实验结果表明肿瘤来源的外泌体可作为一个交叉信号传导平台,在肿瘤的形成和生长等方面发挥自分泌作用,在促进肿瘤细胞生长方面发挥自分泌和旁分泌的作用,这一理论最早由QU等[16]于外泌体在胃癌中的作用研究中提出。
肿瘤微环境指肿瘤细胞周围的各种正常细胞、信号分子、血管和细胞外基质,常被比作肿瘤细胞生长的土壤,在调控肿瘤进展中发挥着关键作用,目前仅有少量学者研究外泌体在乳腺癌肿瘤微环境中的作用[14]。外泌体是微环境的重要组成部分,可以由肿瘤细胞释放到细胞外基质进而进入循环系统,且外泌体中含有的蛋白质和核酸等物质,可以作为肿瘤早期诊断以及预后检测的新型标志物。SCHW-ARZENBACH等[17]发现在乳腺癌患者的血清外泌体中miR-21以及miR-1246的表达水平明显升高,GALINDO等[18]发现在乳腺癌患者血清和胸腔积液的外泌体中基质金属蛋白酶10、热激蛋白90、膜联蛋白-1中异常表达,同时还在乳腺癌血浆外泌体中检测到发育内皮基因座-1以及纤维连接蛋白异常表达[19-20],因此miR-21、miR-1246、发育内皮基因座-1和纤维连接蛋白均可以作为乳腺癌早期诊断的生物标志物。恶性增殖是乳腺癌的重要特征,抑制乳腺癌细胞的恶性增殖是治疗乳腺癌的重要治疗手段,紫草素和卤夫酮可以抑制乳腺癌细胞外泌体的释放,调节细胞周期,抑制肿瘤细胞的增殖[21-22]。侵袭和转移是乳腺癌的另一重要特征,转移性乳腺癌可以危及生命安全,因此抑制乳腺癌侵袭和转移是另一治疗手段[23-25]。外泌体中的蛋白质、miRNA可通过激活一些信号通路影响乳腺癌的侵袭和转移过程[26]。PIAO等[27]证实,乳腺癌细胞来源的外泌体的增殖可通过刺激巨噬细胞极化的途径为淋巴结的转移创造有利条件。研究发现外泌体中的miR-105可以减少紧密蛋白的表达,破坏细胞间的紧密连接,从而促进细胞的侵袭和转移[28]。可见外泌体有望成为乳腺癌早期筛查的快速、简便的标志物,并可能对乳腺癌的治疗提供新思路。
本研究通过对乳腺癌BT549细胞来源的外泌体进行提取以及鉴定,首次证明了人乳腺癌细胞BT549来源的外泌体可以促进肿瘤细胞自身的增殖、侵袭和转移。但其中分子调控机制尚不明确。虽然对外泌体的研究逐步深入,其在液体活检和药物递送方面已在临床获得初步应用,但在肿瘤临床诊疗中的应用仍处于初级阶段[29-30]。相信在多学科的共同努力下,外泌体一定会在临床上展现出更多的应用价值,在不久的将来,越来越多的外泌体潜在应用价值将会被发现并逐步应用于临床。

