龙胆苦苷对慢性前列腺炎的作用及对NF-κB和MAPKs信号通路活化的研究
艾依热提·买买提,木拉提·热夏提
0 引言
慢性前列腺炎(Chronic prostatitis,CP/CPPS)是男性常见疾病之一,发病率在2.5%~16.0%之间,严重影响患者的生活质量[1]。临床主要表现为下腹疼痛、坠胀,同时出现排尿异常,表现为尿急、尿频、排尿困难及夜尿等[2]。目前,CP/CPPS的发病机制和病因尚不清楚。多种理论对CP/CPPS的病理发展做了解释,主要包括微生物感染、自身免疫理论、神经源性炎症理论、局部激素异常理论及尿液反流理论[3]。近年来,随着CP/CPPS动物模型和临床患者数据的发展,越来越多的证据表明,自身免疫在CP/CPPS的发病机制中起着重要作用[4]。国内外学者已通过不同方法成功制备了自身免疫性相关的CP/CPPS动物模型[5]。朱闽等[6]使用前列腺蛋白提纯液辅以免疫佐剂等制备实验性自身免疫性前列腺炎(EAP)小鼠模型。同样,尹学来等[7]按双缩脲法测定蛋白含量,以生理盐水稀释再加等量完全弗氏佐剂乳化成功制备了Wistar大鼠EAP模型。因此,随着EAP动物模型的发展,对后续的药物干预研究治疗过程起着至关重要的作用。
龙胆苦苷(Gentiopicrin)是一种环烯醚萜苷类化合物,是传统中药龙胆的主要活性成分之一。研究表明,龙胆苦苷具有抗炎抑菌、镇痛、肝脏保护及抗肿瘤等多种活性,且龙胆颗粒(龙胆是其主要成分之一)能够治疗慢性前列腺炎[8-9]。但是,龙胆苦苷对慢性前列腺炎的作用及相关分子机制尚不清晰,因此,本研究采用弗氏佐剂诱导的CP/CPPS大鼠模型评价龙胆苦苷的抗慢性前列腺炎作用及相关分子机制。
1 材料与方法
1.1 试药 60只雄性成年SD大鼠(220~250 g)购自新疆医科大学动物实验中心。龙胆苦苷购自成都瑞芬思生物科技有限公司(成都,中国);IL-6、IL-1β、TNF-α、COX-2及PGE2 ELISA大鼠试剂盒购自达科为(北京,中国);前列康片购自浙江康恩贝制药股份有限公司(杭州,中国);抗-p-p65、p65、p-ERK、ERK、p-JNK、JNK、p-p38、p38和GAPDH(CST,美国);RIPA蛋白裂解液(中)、蛋白酶抑制剂、磷酸酶抑制剂(碧云天,中国);HRP标记山羊抗兔IG、HRP标记山羊抗鼠IG(Abcam,英国)。
1.2 CP/CPPS大鼠模型建立 将60只雄性成年SD大鼠(220~250 g)随机分为假手术组(C组)、模型组(M组)、龙胆苦苷150 mg/kg组(L组)、龙胆苦苷300 mg/kg组(E组)、龙胆苦苷600 mg/kg组(H组)及阳性药组(P组),每组10只。麻醉SD大鼠,剖开腹腔完全暴露前列腺,龙胆苦苷和模型组大鼠前列腺注射100 μl完全弗氏佐剂免疫诱导CP/CPPS大鼠模型,对照组注射等体积生理盐水,术后缝合伤口,连续肌肉注射抗生素(氨苄青霉素,4×104U/d)4 d。龙胆苦苷组大鼠灌胃给予龙胆苦苷,假手术组(C组)和模型组(M组)均给予等体积的生理盐水,阳性药组灌胃给予前列康片500 mg/kg,1次/d,连续10 d。实验结束后,称重并脱颈椎处死大鼠,解剖分离大鼠前列腺并称重,计算前列腺器官指数。
1.3 HE染色 实验结束后,脱颈椎处死大鼠,解剖分离大鼠前列腺,将其取出并在4%多聚甲醛中固定24 h,然后石蜡包埋。在切片机上切成4 μm切片,二甲苯脱蜡,酒精脱水。然后,苏木精染色3 min,曙红染色1 min。在光学显微镜下观察切片,以评估前列腺炎症反应。
1.4 ELISA检测 采用ELISA法检测大鼠前列腺组织中白细胞介素(IL)-6、IL-1β、肿瘤坏死因子(TNF-α)及COX-2、PGE2分泌水平,收集大鼠前列腺组织,加入生理盐水0.5 ml,组织研磨仪匀浆,600×g离心15 min,收集上清,根据制造商的说明采用ELISA试剂盒检测大鼠前列腺中IL-6、IL-1β、TNF-α及COX-2和PGE2的含量。
1.5 诱导型NO酶活性检测 采用酶活性检测试剂盒(南京建成,南京,中国)检测前列腺组织上清iNOS的酶活性,收集大鼠前列腺组织,加入生理盐水0.5 ml组织研磨仪匀浆,600×g离心15 min,收集上清,根据说明检测大鼠前列腺iNOS的酶活性。
1.6 蛋白免疫印迹(Western blot)法检测有关指标 分离收集实验大鼠的前列腺组织,称取约30 mg,加入1 ml蛋白裂解液,研磨仪组织匀浆,采用Western blot检测前列腺组织p-p65、p65、p-ERK和ERK、p-JNK和JNK及p-p38和p38蛋白表达水平。根据说明提取组织总蛋白,采用BCA法(碧云天,中国)进行蛋白定量,加入Loading buffer(4×)于100 ℃煮沸5 min,然后采用SDS-PAGE电泳分离蛋白,电泳条件:80 V,30 min;120 V,60 min。随后采用100 V,90 min将电泳分离后的蛋白转移至聚偏佛乙烯(PVDF)膜(Millipore,美国),用5% 脱脂乳室温封闭60 min,TBST洗涤5次,每次5 min,用一抗(p-p65、p65、p-ERK和ERK、p-JNK和JNK及p-p38和p38及GAPDH,按1∶1 000稀释)4 ℃孵育过夜,TBST洗涤5次,5 min/次,用二抗(HRP标记山羊抗兔IG和HRP标记山羊抗鼠IG,按1∶10 000稀释)室温孵育90 min,TBST洗涤5次,5 min/次,用ECL化学发光法(Millipore,MA)显影检测,Image J分析灰度值。

2 结果
2.1 龙胆苦苷对CP/CPPS大鼠前列腺器官指数及病理学的影响 与C组相比,M组大鼠的前列腺器官指数显著升高(P<0.05),与M组相比,灌胃给予龙胆苦苷显著降低CP/CPPS大鼠的前列腺器官指数(P<0.05),见图1。病理HE染色结果表明,与C组相比,M组大鼠前列腺基质出现局灶性淋巴细胞浸润、上皮明显增厚、腔内折叠及腺泡显著变小和间质增生,灌胃给予龙胆苦苷能够显著减轻CP/CPPS的病理学变化,包括局灶性淋巴细胞浸润减少、上皮增厚及间质增生抑制等,见图2。
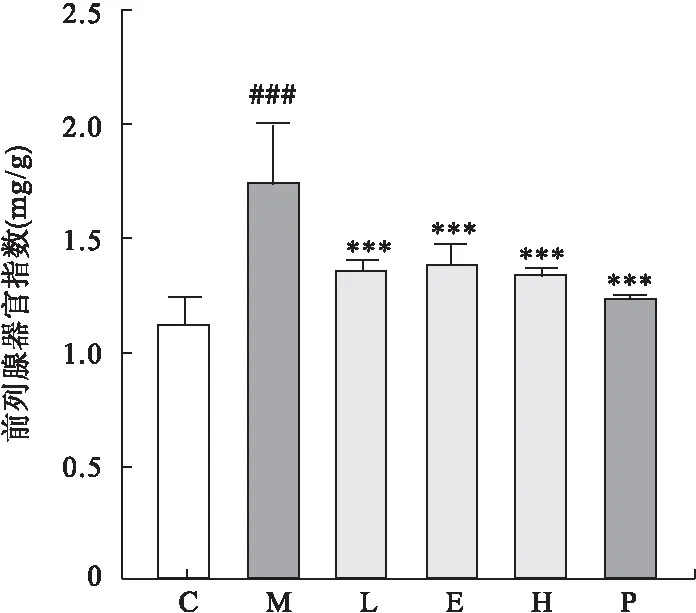
图1 龙胆苦苷对CP/CPPS大鼠前列腺器官指数的影响
2.2 龙胆苦苷对CP/CPPS大鼠前列腺组织中炎症因子表达的影响 采用ELISA法检测大鼠前列腺组织中炎症因子IL-6、IL-1β和TNF-α表达水平,结果表明,与C组相比,M组大鼠前列腺组织中炎症因子IL-6、IL-1β和TNF-α的含量显著增加,灌胃给予龙胆苦苷能够显著降低CP/CPPS大鼠前列腺组织中炎症因子IL-6、IL-1β和TNF-α的含量(P<0.05),见图3。

图2 龙胆苦苷对CP/CPPS大鼠前列腺病理学影响(HE病理染色结果)
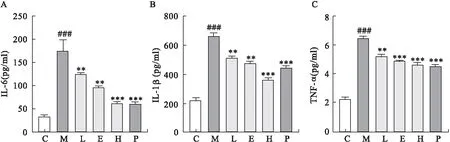
图3 龙胆苦苷对CP/CPPS大鼠前列腺组织中炎症因子表达的影响
2.3 龙胆苦苷对CP/CPPS大鼠前列腺组织炎症介质的影响 采用ELISA法检测大鼠前列腺组织中COX-2、PGE2的含量,结果表明,与C组相比,M组大鼠前列腺组织中COX-2和PGE2的含量显著增加,灌胃给予龙胆苦苷显著降低CP/CPPS大鼠前列腺组织中COX-2和PGE2的含量(P<0.05),见图4A、4B。同时,与C组相比,M组大鼠前列腺组织中iNOS酶活性显著增加,灌胃给予龙胆苦苷显著抑制CP/CPPS大鼠的前列腺组织中iNOS酶活性(P<0.05)。见图4C。
2.4 龙胆苦苷对CP/CPPS大鼠前列腺组织中NF-κB信号通路活化的影响 采用Western blot法检测大鼠前列腺组织中NF-κB信号通路分子的蛋白水平,结果表明,与C组相比,M组大鼠前列腺组织中p-p65蛋白表达水平显著上调(P<0.05),但p65蛋白表达水平变化差异无统计学意义(P>0.05),灌胃给予龙胆苦苷能够显著下调CP/CPPS大鼠前列腺组织p-p65的蛋白表达水平(P<0.05),见图5。
2.5 龙胆苦苷对CP/CPPS大鼠前列腺组织中MAPKs信号通路活化的影响 采用Western blot法检测大鼠前列腺组织中MAPKS信号通路分子的蛋白水平,结果表明,与C组相比,M组大鼠前列腺组织中p-ERK/ERK、p-JNK/JNK及p-p38/p38蛋白表达水平显著上调,灌胃给予龙胆苦苷显著下调CP/CPPS大鼠前列腺组织中p-ERK/ERK、p-JNK/JNK及p-p38/p38蛋白表达水平(P<0.05),见图6。
3 讨论
CP/CPPS病理机制复杂,随着CP/CPPS动物模型和患者数据的增加,越来越多的研究认识到自身免疫在CP/CPPS病理机制中的重要作用[10]。因此,本研究采用完全弗氏佐剂(CFA)诱导的自身免疫性CP/CPPS动物模型评价了龙胆苦苷的抗CP/CPPS作用及相关分子机制。

图4 龙胆苦苷对CP/CPPS大鼠前列腺组织中炎症介质表达的影响
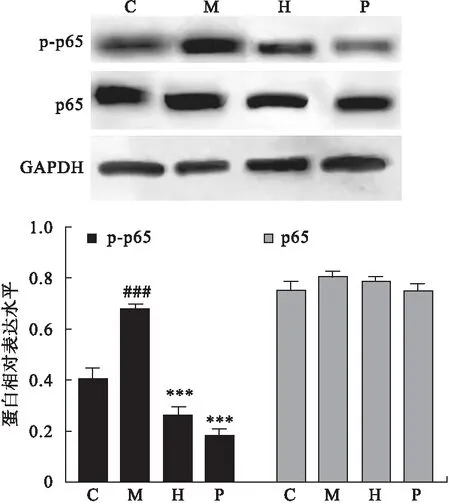
图5 龙胆苦苷CP/CPPS大鼠前列腺组织中NF-κB信号通路活化的影响
CFA诱导的CP/CPPS动物模型与前列腺的病理组织变化密切相关,表现为明显的前列腺受损、炎性细胞浸润及水肿和细胞间质纤维化,这些变化和之前的报道一致,而且这种模型复制方法易于操作[10]。同时,这些变化与非细菌性CP/CPPS患者临床症状相一致,有助于CP/CPPS的病理机制和药物干预研究。本研究表明,龙胆苦苷能够显著抑制CP/CPPS大鼠前列腺炎性细胞浸润、间质水肿及纤维化,同时降低前列腺的器官指数,这表明龙胆苦苷对CP/CPPS具有潜在的治疗价值。
近年来,越来越多的研究将注意力集中于炎症因子及炎症介质在CP/CPPS病理机制中的作用[11]。IL-1β和TNF-α作为两种重要的促炎因子,在CP/CPPS的病理发展过程中起着至关重要的作用[12]。IL-6作为机体炎症反应的主要免疫因子,能够调节IL-2的产生及下游IL-1β和TNF-α的合成[13]。本研究结果表明,龙胆苦苷能够抑制CP/CPPS大鼠前列腺中炎症因子包括IL-1β、IL-6及TNF-α的产生。同时,IL-1β和TNF-α作为炎症反应的关键因子,能够激活核因子-κB(NF-κB)信号通路,促进促炎因子及炎症介质COX-2、PGE2及iNOS的产生和释放[14-15]。本研究表明,龙胆苦苷也能够抑制COX-2、PGE2的产生及iNOS活性。因此,龙胆苦苷可能通过抑制炎症因子及炎症介质的释放发挥抗CP/CPPS作用。
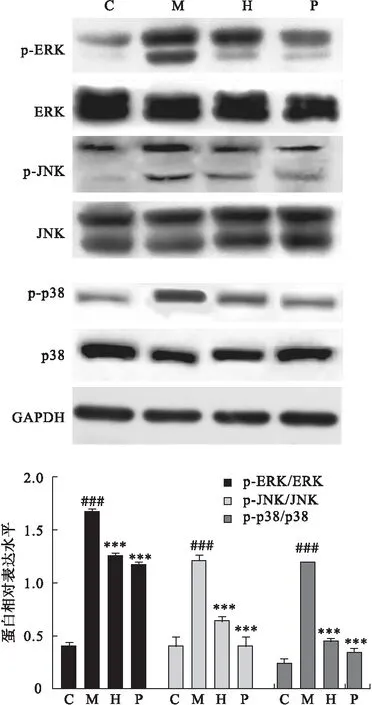
图6 龙胆苦苷CP/CPPS大鼠前列腺组织中MAPKs信号通路活化的影响
NF-κB信号通路在机体的炎症反应调节过程中起着至关重要的作用,正常情况下,p65或p50与IκBα形成共聚体存在于细胞质中,当受到细胞外信号的刺激(IL-1β和TNF-α),IκBα发生磷酸化并降解,p65或p50磷酸化进入细胞核,进而调节促炎因子(IL-1β、IL-6及TNF-α)及COX-2、PGE2等炎症介质的转录表达[16]。除此之外,丝裂原活化蛋白激酶(MAPK)信号通路是生物体内重要的信号转导通路,其亚族主要包括JNK、ERK及p38,参与介导细胞的生长、分化及发育等多种过程,在机体炎症调节过程中发挥着重要的作用[17]。在本研究中,龙胆苦苷能够抑制p65的磷酸化及JNK、ERK和p38磷酸化,因此,龙胆苦苷可能通过抑制NF-κB和MAPK信号通路的活化产生抗炎作用。
综上所述,本研究表明,龙胆苦苷对慢性前列腺炎具有保护作用,并且这种作用可能与抑制NF-κB和MAPK信号通路激活有关。但是,龙胆苦苷是直接还是间接作用于NF-κB和MAPK信号通路及其他信号通路,尚需进一步探讨。

