黑边石斑鱼体长、年龄与性成熟、性逆转的关系研究
徐文刚,刘立明,唐永政,王九龙,于文松,征矢野清,邹华锋
(1.烟台大学海洋学院,山东烟台 264005;2.烟台市海洋经济研究院,山东烟台 264003;3.長崎大学環東シナ海環境資源研究センター,日本長崎 851-2213;4.上海海洋大学水产科学国家级实验教学示范中心,水产种质资源发掘与利用教育部重点实验室,上海 201306)
石斑鱼(Epinephelus)隶属于鲈形目(Perciformes),鮨科(Serranidae),石斑鱼亚科(Epinephelinae),广泛分布在中国、日本、韩国以及其他亚洲国家的温带和热带海域,因其高品质的鱼肉和较高的商业价值而被认为是重要的海洋经济鱼类之一[1-2]。石斑鱼的人工养殖主要集中在我国广东、海南和福建,其产量逐年增加并在2018年达到13.15万t[3]。目前国内有关石斑鱼养殖生物学的研究报道主要集中在杂交试验[4-6]、环境胁迫[7]、营养成分分析[8]以及形态发育[9]等方面,有关其体长、年龄与性成熟、性逆转以及内分泌激素之间联系的研究较少报道。
硬骨鱼类的生活史包含生长、发育、成熟和繁殖阶段,其中性成熟受到内分泌激素的调节和体长、年龄以及与繁殖相关环境因子的综合影响。大量研究表明,鱼类性成熟的开始与体长和年龄因素相关。日本学者OKUZAWA[10]认为,鱼类初次性成熟与体长密切相关,当鱼类生长规格达到或超过性成熟所需要的最小体长时,即可视为初次成熟的开始,之后个体中成熟比例随着体长的增加而增加。对竹䇲鱼(Trachurus japonicus)的研究[11]表明,当其叉长超过19~23 cm的生物学最小形时即达到成熟。也有研究表明,鱼类初次性成熟与年龄密切相关,澳大利亚的墨瑞鳕(Maccullochella peelii peelii)在4龄后才达到性成熟[12-13];而牙鲆(Paralichthys olivaceus)雌鱼随着体长和年龄的增加其成熟率也逐渐提高[14]。然而有关石斑鱼初次性成熟与体长和年龄关系的研究仅在赤点石斑鱼(Epinephelus akaara)[15]和黑边石斑鱼(E.fasciatus)[16]中有少量报道。
黑边石斑鱼广泛分布于我国南海[2]以及印度洋和太平洋[16-17],是一种栖息于热带和亚热带地区的中小型石斑鱼类,其味道鲜美,具有很高的商业价值,是东亚地区重要的水产资源。黑边石斑鱼属于雌雄同体、先雌后雄的海水鱼类。目前日本东京都小笠原群岛每年进行黑边石斑鱼苗种的生产和放流[18],以增加其渔获产量。对日本长崎市沿岸海域市场的调查表明,通过垂钓或网捕所得渔获物中黑边石斑鱼的数量大幅增加,但捕获个体的规格却逐年减小。黑边石斑鱼原属南海主要珊瑚礁鱼类[2],近年随着日本近海水温的上升,其栖息地北迁至长崎沿岸海域。研究表明,在人工养殖环境下,其满1龄时体长为16.6 cm,满2龄时为23.5 cm[16],2~3龄时性腺发育成熟[18],此前均为雌性,之后经过短暂的间性过渡后性逆转为雄性。由于地域和环境的不同,其产卵期和性成熟规格也有差异。如在菲律宾热带海域,黑边石斑鱼雌性成熟个体体长为14~28 cm,成熟且完成卵黄蓄积后能够全年进行产卵[19],而在小笠原群岛其产卵期在4—6月,性成熟体长24 cm[20]。此外养殖条件的差异也会导致其产卵期的不同,如自然条件下小笠原群岛在4—6月,人工养殖条件下在4—11月[20]。但至今未见长崎沿岸海域有关黑边石斑鱼的生长和成熟之间关系的研究报道。本研究为探明日本长崎市沿岸海域黑边石斑鱼性成熟、性逆转期与体长、年龄之间的关系,于2015年7月至2018年6月逐月连续采样,并对其体长、体质量、年龄、性别、性腺发育成熟度和性腺指数以及血清中雌二醇(17β-Estradiol,E2)含量展开了调查研究,以为今后黑边石斑鱼的资源调查和人工繁殖提供更多信息。
1 材料与方法
1.1 实验材料
2015年7月至2018年6月,采用渔船捕捞作业和垂钓法相结合的方式,在日本长崎市沿岸海域随机捕获黑边石斑鱼,分别记录每月累计采样的数量,样本数量总计297尾。
1.2 实验方法
所捕获黑边石斑鱼用2-苯氧乙醇麻醉后,测定全长(total length,TL)和体质量(body weight,BW)。从尾柄部采血,血液在1 500 r·min-1、4℃离心机中离心20 min后取上层血清保存于-80℃冰箱。之后取出性腺,测定质量(gonadal weight,GW),计算性腺指数(gonadosomatic index,GSI),公式为:

将性腺固定在波恩试剂中,24~48 h后转移至70%的酒精中保存用于组织学分析。之后取出位于脑下部的耳石,左右各一个,将其保存在70%的乙醇或蒸馏水中,用于年龄的测定。
1.2.1 性腺组织学观察
对黑边石斑鱼性腺进行常规梯度酒精脱水,二甲苯透明,石蜡包埋,连续切片,厚度为5μm。采用苏木精-伊红(HE)染色,中性树胶封片,Olympus FX380型光学显微镜观察并拍照,以切片图中性细胞最发达阶段作为性腺的发育阶段。性腺中若观察到卵母细胞的个体为雌性;同时观察到卵细胞和精细胞的个体为间性;观察到精原细胞、精母细胞或精子的个体为雄性。此外,雌性参考国内外学者的研究[21-23]对卵母细胞发育情况作A~G分期。
1.2.2 耳石加工和年龄的鉴定
耳石加工和年龄的鉴定参照文献[24-25]中的方法加以改进,具体过程如下,将半片胶囊(Kobayashi Capsulae Co.,Ltd.,Japan)投入到牙科用树脂(Shofu Inc.,Japan)中后迅速将耳石垂直包埋其中,包埋后的耳石放置在低速精密切断机(MetaServTM250-Single,Switzerland)上于中心部位沿短轴方向切开,厚度约1.5 mm左右。之后置于研磨机(MetaServTM 250-Single,Switzerland)上研磨至厚度约0.5 mm。在1%盐酸溶液中浸泡20 s后于1%甲苯胺蓝溶液中染色60 s,最后用透明指甲油固定在载玻片上,在显微镜下根据所观察到的轮纹数鉴定黑边石斑鱼的年龄。
1.2.3 血清中雌二醇含量的检测
本实验中雌二醇(17β-Estradiol,E2)的检测参照左永松等[26]的方法进行测定,具体过程如下,-80℃冷冻的血清样品经过4℃解冻离心后取得上层血清,血清经过甲醇-乙醚低温冷冻蒸发系统进行类固醇的提纯,经3次冷冻蒸发后的血清样品可用于检测。E2的测定采用Cayman Chemical公司购置的EIA(enzyme immunoassy)酶联免疫试剂盒。
1.3 数据分析
利用SPSS 22.0软件对数据进行比较分析,所有数据均表示为平均值±标准误(means±SEM)。采用Kolmogorov-Smirnov法进行正态分布检测,利用ANOVA检验以及Tukey’s HSD法进行差异性比较分析,取P<0.05为差异显著。
2 结果与分析
2.1 黑边石斑鱼的累计数量及其生长指数的变化
2015年7月至2018年6月,每月捕获黑边石斑鱼的累计数量及其生长指数的变化如表1所示。黑边石斑鱼体长在9月显著高于5、6、8、10、12月(P<0.05),体质量在9月显著高于1、2、5、6、8、10、11、12月(P<0.05);其性腺质量和GSI的变化一致,两者均在7月显著高于1—5月和8—12月(P<0.05)。
2.2 未成熟与成熟雌性、间性和雄性个体累计数量及其比例的变化
调查期黑边石斑鱼性腺发育各阶段切片如图1所示,其中未成熟雌性性腺发育见图1-A~B,成熟雌性见图1-C~G,间性图1-H,雄性图1-I。调查期每月未成熟与成熟雌性、间性和雄性个体累计数量及其比例的变化如表2所示。每月均观察到未成熟雌性个体,其比例在1—5月较高,在3月和5月均达到100%;在6—12月较低,其中7月最低,仅为20.7%。在1、2、4及6—11月观察到成熟雌性个体,在6—8月比例较高,6月为45.5%,7月升至最高为64.6%,8月为43.8%;之后逐渐降低,在11月仅为7.1%。此外,在7、8、11、12月观察到间性个体;在1、7、8、10、11、12月观察到雄性个体。每月间性和雄性个体比例为0~30%,均较雌性个体比例低。
2.3 7月未成熟与成熟雌性、间性和雄性个体累计数量、生长指数、GSI和年龄的差异
根据表2的结果,取成熟雌性比例最高的调查期7月累计捕获的82尾黑边石斑鱼统计未成熟与成熟雌性、间性和雄性个体累计数量、生长指数、GSI及年龄如表3所示。间性和雄性个体体长和体质量均显著高于未成熟和成熟雌性个体(P<0.05)。成熟雌性的性腺质量和GSI显著高于未成熟雌性、间性以及雄性(P<0.05)。未成熟和成熟雌性的年龄在2~4龄,间性在9龄,雄性在7~12龄。

表1 调查期月捕获黑边石斑鱼累计数量及其生长指数的变化Tab.1 Changes of cumulative number and grow th index of Epinephelus fasciatus in each month from July 2015 to June 2018
2.4 7月雌性黑边石斑鱼年龄、性腺发育阶段、累计数量、生长指数、GSI和雌二醇含量的变化
根据表3的结果,取成熟雌性比例最高的调查年7月累计捕获的70尾雌性黑边石斑鱼统计其年龄、性腺发育阶段、累计数量、生长指数、GSI和雌二醇(E2)含量的变化如表4所示。在2龄鱼中未检测到成熟个体,其性腺发育检测为核仁外周期(Pn)和卵黄囊泡期(Yv)阶段,各指标均无显著性差异,其Yv阶段体长为(21.92±0.83)cm,GSI为(0.35±0.04)%,E2含量为(73.38±12.94)pg·mL-1。3龄鱼中开始检测到三级卵黄球期(Ty)阶段成熟个体,其体长为(24.52±1.55)cm,GSI为(4.05±1.24)%,E2含量为(247.28±45.34)pg·mL-1。4龄鱼中大部分个体检测为Ty阶段成熟个体,其体长为(28.96±0.51)cm,GSI为(3.89±0.63)%,E2含量为(253.88±45.47)pg·mL-1。5龄鱼的性腺发育检测均为完熟期(R)阶段。
3龄鱼的性腺发育检测为Pn、Yv、Ty和核移动期(Mn)阶段,其中Ty和Mn阶段的性腺质量、GSI和E2含量显著高于Pn阶段(P<0.05),Ty和Mn阶段的E2含量显著高于Pn和Yv阶段(P<0.05)。4龄鱼的性腺发育检测为Yv、Ty和R阶段,其中Ty和R阶段的性腺质量、GSI和E2含量显著高于Yv阶段(P<0.05)。

图1 不同发育阶段黑边石斑鱼性腺切片图Fig.1 Histological sections of different gonadal developmental stages of Epinephelus fasciatus
3 讨论
3.1 黑边石斑鱼卵巢发育成熟期的推测及其与E2之间的联系
本研究中,在长崎市沿岸海域捕获的黑边石斑鱼在6—8月观察到较高比例的成熟雌性个体,且其GSI和成熟比例均在7月达到峰值。已有研究表明,褐石斑鱼(E.bruneus)卵黄球形成期出现在4月且在5—6月确认产卵[27]。七带石斑鱼(E.septemfasciatus)卵黄囊泡以及卵黄球形成期在3月,5月迎来产卵期[28]。蜂巢石斑鱼(E.merra)产卵期在5—7月[26,29]。赤点石斑鱼[30]和鞍带石斑鱼(E.lanceolatus)[31]的人工繁殖期分别在6—9月和7—9月。已有研究表明,长崎地区黑边石斑鱼性腺在2017年7月和8月能发育成熟并产卵,是水温、性激素E2和性成熟激素DHP共同调节所致[32]。以上结果表明,由于石斑鱼种类的不同,其性腺发育成熟和产卵期也会有所差异,在长崎市沿岸海域海水水温每年变化不大的情况下,黑边石斑鱼性成熟期大致在7月。

表2 调查期各月未成熟与成熟雌性、间性和雄性个体累计数量及其比例Tab.2 Changes of cumulative number and proportion between the immature and mature female,intersex,and male Epinephelus fasciatus in each month from July 2015 to June 2018
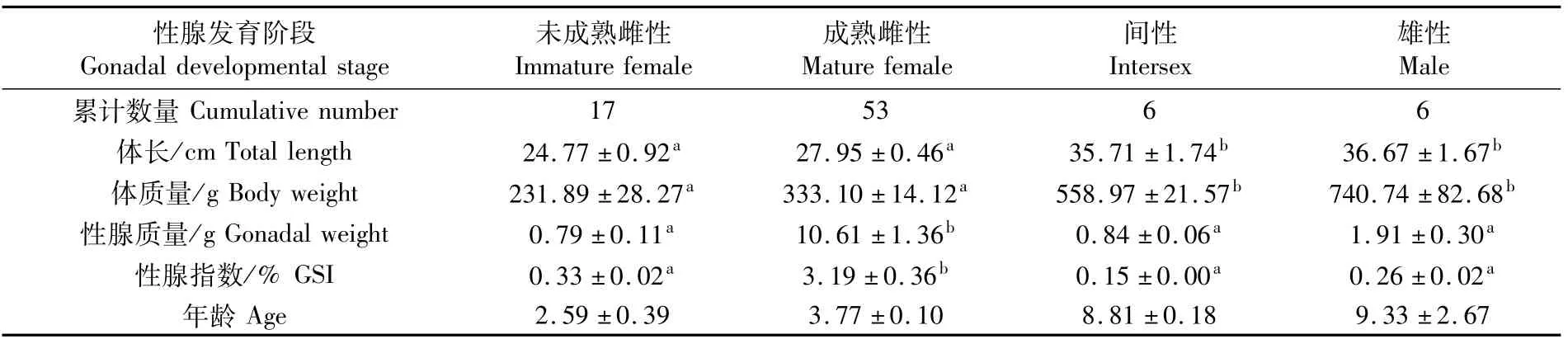
表3 调查期7月未成熟与成熟雌性、间性和雄性个体累计数量、生长指数、GSI和年龄的差异Tab.3 Differences of cumulative number,grow th index,GSI,and age between the immature and mature female,intersex,and male Epinephelus fasciatus in July from July 2015 to June 2018

表4 调查期7月雌性黑边石斑鱼年龄、性腺发育阶段、累计数量、生长指数、GSI和雌二醇(E2)含量的变化Tab.4 Changes of age,gonadal developmental stage,cumulative number,grow th index,GSI,and 17β-Estradiol(E2)content of Epinephelus fasciatus in July from July 2015 to June 2018
大量研究[33]表明,鱼类脑垂体分泌的促性腺激素(gonadotropins,GtHs)能够诱导性腺合成性激素E2,从而促进卵母细胞发育成熟。本研究3龄和4龄成熟雌性个体中E2含量和GSI显著高于未成熟雌性个体,表明E2在诱导卵母细胞发育成熟过程中起重要作用。以往的研究表明[32],黑边石斑鱼E2含量在成熟季节显著高于非成熟季节。斜带石斑鱼(E.coioides)成熟雌鱼血清中E2含量在生殖季节最高,且其平均性腺成熟系数GSI也显著高于其他月份,表明其血清E2水平的季节变化与性腺成熟系数的变化基本一致,都是在生殖季节达到最高峰[34]。此外,给鲻(Mugil dussumieri)注射外源激素E2能够诱导其性腺发育成熟[35]。斜带髭鲷(Hapalogenys nitens)血清中E2含量在产卵期之前达到最高值,且其变化趋势与卵母细胞发育和GSI的变化一致[36]。本研究中黑边石斑鱼成熟阶段性激素和GSI的变化趋势与上述结果一致,表明E2含量的增加与卵巢发育成熟密切相关。
3.2 黑边石斑鱼体长、年龄与性成熟、性逆转之间的联系
本研究中2龄黑边石斑鱼最小体长为21.4 cm,3龄为24.5 cm,4龄为27.8 cm。已有研究表明[17],在日本小笠原人工养殖的黑边石斑鱼最小体长2龄为23.5 cm,3龄为27.6 cm。本研究中的黑边石斑鱼均为长崎市沿岸海域捕获,因此其体长与小笠原人工养殖的有所差异。本研究中黑边石斑鱼在3龄时检测到成熟个体,而小笠原养殖群体的成熟期在2~3龄[17]。褐石斑鱼在3龄时出现成熟个体,但比例较低,仅为4%;4~6龄时成熟率分别为45%、63%和63%,随着年龄的增长成熟率逐渐增加[37]。赤点石斑鱼在2~3龄时出现成熟个体[38],表明不同种类石斑鱼成熟的年龄也不相同。本研究中3龄成熟个体的体长在24.5 cm左右,随着体长的增加,成熟个体的数量也逐渐增加,表明长崎市沿岸海域黑边石斑鱼初次性成熟年龄在3龄、体长在24.5 cm左右。
鱼类性逆转是一个复杂的生理过程,雌性先熟的雌雄同体鱼类(如石斑鱼)在自然条件下激素的平衡首先趋向于雌性发育成熟,直到产卵后的一定发育阶段才开始产生卵巢退化、精巢发育的性逆转过程[39]。本研究中黑边石斑鱼在体长35.7 cm左右、9龄时检测到间性个体;体长36.7 cm左右、7~12龄时检测到雄性个体,表明其性逆转期大致在7~12龄。已有研究表明,自然海区的石斑鱼性逆转一般发生在体长和年龄足够大的个体,如赤点石斑鱼发生在6龄[15,40],鲑点石斑鱼(E.tauvina)在7龄以上[41-42],褐石斑鱼在11龄左右[27]。此外,在人工养殖条件下赤点石斑鱼体长17~24 cm时性逆转出现雄鱼,但自然环境下体长27 cm时仍未见雄鱼[38],表明除年龄和体长外,生活环境也会影响石斑鱼性逆转时期。因此,本实验中黑边石斑鱼性逆转期可能受到体长、年龄和生活环境的影响。
综上所述,2015年7月至2018年6月通过连续调查取样,长崎市沿岸海域黑边石斑鱼性成熟期在7月且与E2含量的增加密切相关,其初次性成熟年龄在3龄,性逆转在7~12龄。本研究结果为黑边石斑鱼的资源保护及人工繁殖方面提供了基础生物学资料和理论依据。

