谷子白发病典型症状观测及细胞壁降解酶活性测定
刘 琴,张 蕊,张育铭,任 璐,张宝俊
(山西农业大学植物保护学院,山西太谷 030801)
由禾生指梗霉(Sclerospora graminicola(Sacc.)Schroet)引起的谷子白发病在各主产区均有发生。据统计,每年因谷子白发病造成的产量损失平均可达5.75 亿kg[1]。谷子白发病从苗期到成熟期均可发生,根据发病时期和发病部位,发病症状可分为芽腐、灰背、枪杆或白尖、刺猬头和发丝。特别是在抽穗前,病株顶部2~3 片叶丛生,叶尖或全叶黄白,心叶抽出后不能正常展开,而是呈卷筒状直立,心叶组织逐渐变褐直至枯死,叶片沿叶脉分裂成细丝,叶肉细胞被病原菌分解,只留下灰白色如发丝的叶脉组织,严重影响谷子的光合作用及产量的提高。
病原菌对植物寄主的侵染过程涉及复杂的致病机理。病原菌和寄主的种类不同,致病因子也不相同,主要涉及的致病因子包括毒素、激素和细胞壁降解酶等[2-3]。有研究表明,细胞壁降解酶是一种重要的致病因子[4]。植物病原菌在侵染致病的过程中会产生一系列细胞壁降解酶,通常包括果胶酶(EC)、纤维素酶(CE)、半纤维素酶(hCE)和其他酶类[5],通过酶解植物多糖来破坏和分解细胞壁,以提供病原菌自身营养促进其对寄主组织的侵染[6-7]。侵染寄主的病菌进入有性态时期,会自上而下从寄主植物形态学的顶端至穗下节产生大量卵孢子,并通过细胞壁降解酶等的作用,降解植物叶肉细胞的细胞壁。病原真菌对寄主植物的伤害一般是通过果胶酶和纤维素酶协同作用完成的[8-9]。陈晓林等[10]研究发现,苹果树腐烂病菌(Valsa ceratosperma)在活体组织内、外均能分泌多聚半乳糖醛酸酶(PG)、果胶甲基酯酶(PME)、纤维素酶等一系列的细胞壁降解酶,对寄主植物的细胞壁造成了破坏。
谷子白发病白尖症状的形成可能与病菌分泌的植物细胞壁降解酶有关,为深入了解这一特殊的生理现象,本研究重点测定了病叶的形态特点及其细胞壁降解酶活性,旨在为进一步探索禾生指梗霉菌与谷子的互作机制提供理论依据,也为后续的研究提供新的研究方向与思路。
1 材料和方法
1.1 试验地概况
试验在山西省太谷区、交口县和榆次区试验田进行。其中,太谷区试验田(112°30′E,37°12′N)属暖温带大陆性气侯,春温高于秋温,夏季暖热多雨,冬季长而偏冷,年平均气温9.8 ℃,无霜期175 d,降雨量458 mm;交口县试验田(111°34′E,36°43′N)属中温带大陆性气候区,四季分明,春季干旱多风少雨,夏季炎热雨量集中,秋季相对温凉湿润,冬季寒冷干燥少雪,年平均气温6.8 ℃,年均日照2 700 h,无霜期142 d,降雨量618 mm;榆次区试验田(113°08′E,37°54′N)属暖温带半湿润大陆性季风气候,夏季炎热多雨,冬季寒冷干燥,春、秋短促,年平均气温9.8 ℃,年日照时数2 662 h,无霜期158 d,降雨量483 mm。
1.2 试验材料
供试谷子品种晋谷57(JG57)、大白谷(DBG)、晋谷54(JG54)、晋谷21(JG21)、长生08(CS08)和晋汾52(JF52)由山西农业大学生物工程研究所种质资源库提供。
1.3 主要试剂及仪器设备
供试试剂为2.5%戊二醛固定液、牛血清白蛋白、0.1 mol/L 磷酸缓冲液(PBS)(pH 值7.2)、0.1 mol/L磷酸缓冲液(pH 值6.8)、50 mmol/L 乙酸钠缓冲溶液(pH 值5.2)、3,5-二硝基水杨酸试剂(DNS)、50mmol/L柠檬酸缓冲液(pH 值4.5)、50 mmol/L 柠檬酸缓冲液(pH 值5.0)、考马斯亮兰G-250、水杨苷、果胶酸钠、果胶、甲基红等,均购自生工生物工程(上海)股份有限公司。
主要仪器设备有叶面积仪(LI-3000C,美国LI-COR)、叶绿素仪(SPAD-502 PLUS,日本KONICA MINOLTA)、扫描电镜(JEM-6490LV,日本电子株式会社JEOL)、酶标仪(VERSA)、体视显微镜(SZX16,奥林巴斯)。
1.4 试验方法
1.4.1 谷子白发病白尖表型观测 2019 年按禾生指梗霉卵孢子与种子1∶50 的比例拌菌处理6 个品种谷子,播种于山西省太谷区试验田作为试验组,同时以播种未拌菌处理的不同品种谷子种子作为对照组。在谷子抽穗后,分别随机选定6 个品种发病植株和健康植株各30 株,10 株为一次重复,重复3 次。用直尺或游标卡尺测定倒2 叶的叶长、叶宽和叶厚,用叶面积仪测定倒2 叶叶面积;用叶绿素仪测定倒2 叶的SPAD 值,并在成株期测定寄主植物的株高,分析谷子白发病菌侵染对寄主植物株高及叶片发育的影响,同时期以健康植株同部位测定结果为对照。
1.4.2 叶片表皮毛形态观测及不同地区表皮毛数量统计 2019 年谷子抽穗后,分别采集山西省交口县(晋谷21-Ⅰ)、榆次区(晋谷21-Ⅱ)和太谷区(晋谷21-Ⅲ)谷子的健康叶与病叶各30 片,10 片为一次重复,重复3 次。用直径为6 mm 的打孔器在倒2叶基部靠近主叶脉处切取叶碟,借助体式显微镜观测单位面积内病叶及健康叶片表皮毛的数量及密度。另选取山西太谷区晋谷21 病叶与健康叶片叶碟装入加有2.5%戊二醛固定液进行固定,依次用50%、70%、80%、90%、100%乙醇、乙醇与醋酸戊酯混合液(2∶1、1∶1、0∶1)脱水30 min,等到样品充分干燥后镀金,于扫描电镜下观察叶片表皮毛形态。
1.4.3 细胞壁降解酶提取及活性测定 采集山西榆次区晋谷21 病株,将不同发病程度取材并对不同部位编号为TG1~TG5,其中,TG1 表示第1 茎节植株;TG2 表示心叶基部退绿白化;TG3 表示心叶中部白化转棕;TG4 表示心叶上段叶片全部变为棕色;TG5 表示倒2 叶为褐色发生纵裂形成发丝。健康植株的取材参照相同时期病株部位进行,编号为CK1~CK5(图1)。参照曹建康等[11]的细胞壁降解酶提取方法,称取1 g 新鲜组织样本,加入pH 值7.2 的PBS 缓冲液9 mL,用匀浆器将标本匀浆充分,5 000 r/min 离心30 min 后,收集上清液(粗酶液),分装成2 份,其中一份用于CE、PG、PME、PL 酶活的测定,另一份沸水浴10 min 后取出冷却,制成失活粗酶液,作为测定PG、PME 酶活时的对照组,于-20 ℃保存(同时注意CE、PL 酶活性使用试剂盒测得,不需要失活酶液作为对照)。其中,CE 酶活性的测定使用上海酶联生物的植物纤维素酶酶联免疫分析试剂盒,450 nm 波长处测定吸光度值;测定PG酶和PME 酶活性参照HAGERMAN 等[12]的方法并修改,PG 酶活性的测定显色剂为甲基红,在525 nm波长处测定吸光度值,PME 酶活性测定显色剂为DNS,在540 nm 波长处测定吸光度值;PL 酶活性测定是使用上海酶联生物的植物果胶裂解酶酶联免疫分析试剂盒进行操作,在450 nm 波长处测定吸光度值,同时以健康植株同部位组织为对照,3 次重复。
1.5 数据分析
采用Excel 软件进行数据整理与作图;利用SPSS 21.0 软件对试验数据进行方差分析,采用邓肯氏(Duncan)新复极差法进行差异显著性比较。
2 结果与分析
2.1 不同品种健康植株与病株的叶片表型观测结果
图2 结果表明,谷子白发病菌侵染谷子植株后,对谷子的叶片的正常发育造成严重影响,6 个不同品种的病株与健康植株的表型各指标相比均差异显著(P<0.05),株高降低,降低范围为9.06~32.17 cm;叶面积减小,减小范围为19.07~87.12 cm2;叶片增厚,增加范围为0.50~1.00 mm;叶片叶绿素SPAD 值降低,降低范围为20.27~37.19;叶片长度缩短,缩短范围为5.23~17.49 cm;受侵染寄主的叶片会发生不正常横向生长,叶片平均宽度与健康植株相比宽7.50~11.50 mm。

2.2 晋谷21 健康植株与病株叶片表皮毛观测结果
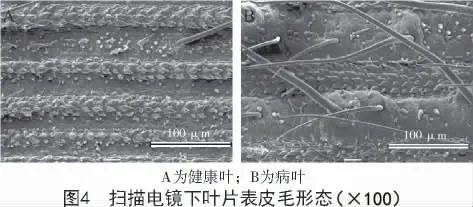
2.2.1 叶片表皮毛数量观测结果 健康叶与病叶表皮体式显微镜下观测结果发现(图3),与健康叶片相比病叶表皮毛数量明显增多。

扫描电镜下观测结果发现(图4),健康叶片表皮毛稀少,而病叶表皮毛密集且数量多。
2.2.2 叶片表皮毛数量统计结果 山西省交口县、榆次区、太谷区3 个地点晋谷21 品种的健康叶与病叶表皮毛数量测定结果如表1 所示,结果表明,不同地点健康叶与病叶的表皮毛数量相比差异显著(P <0.05),病叶上的表皮毛数量平均约为1.481~1.509 个/mm2,相同部位的健康叶的表皮毛数量约为0.093~0.111 个/mm2,病叶表皮毛数量约为健康叶的13~18 倍,表明病菌侵染可刺激寄主叶片的表皮毛过度生长。
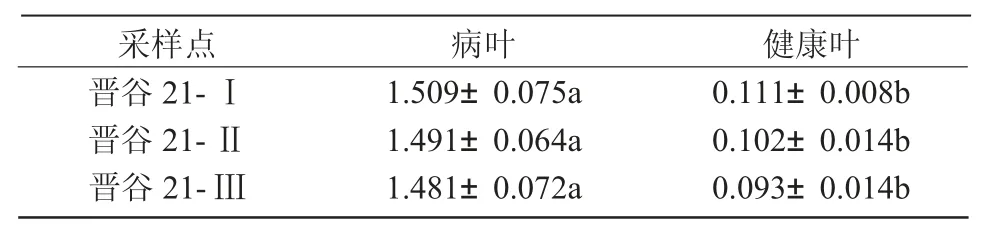
表1 晋谷21 健康植株与病株叶片表皮毛数量测定结果 个/mm2
2.3 细胞壁降解酶活性测定结果
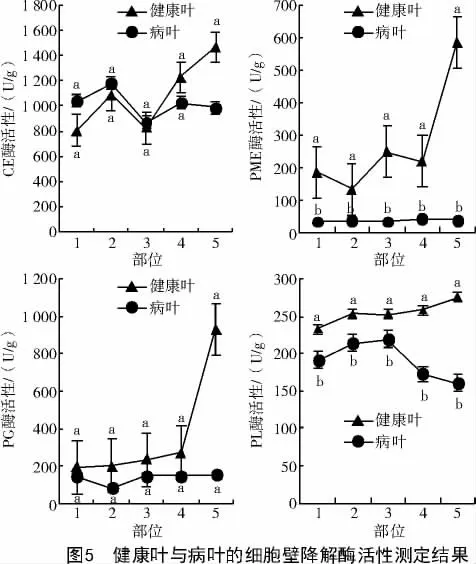
健康叶和病叶的细胞壁降解酶活性测定结果显示(图5),病叶CE 酶活性前期低于健康叶,随着发病程度加重,CE 酶活性呈上升趋势,发病程度处于所测定TG5 时,CE 酶活性达到最高值,为1 467.04 U/g,与健康叶CE 酶活性差值也达到最大,为480.47 U/g;病叶PME 和PL 的酶活性在不同发病程度均显著高于健康叶(P<0.05),尤其是在叶片发生纵裂时(即TG5),其酶活性分别达到最高值585.22、275.55 U/g;病叶PG 酶活性与健康叶相比差异不显著(P>0.05),其中,处于TG5 时也达到最高值931.34 U/g,与健康叶差值也达到最大,为777.70 U/g,在TG5 时酶活性明显升高,并且差值达到最大时比CE、PME、PL 处于最大值时的酶活性都高。
3 结论与讨论
本研究发现,谷子植株受到禾生指梗霉病菌侵染后,会发生植株矮化,叶片变宽、变厚,叶面积减少,叶表皮毛数量增多等特殊的症状。章元寿[13]研究发现,许多病原菌能合成植物激素,如植物生长素(IAA)、赤霉素(GA)、脱落酸(ABA)等,诱导植物产生矮化、畸形、偏上性等病变形态。同时有研究报道[14],生长素与油菜素内酯(BR)、细胞分裂素(CTK)与赤霉素之间的相互作用对调控叶片形态、叶面积等方面可能发挥着重要作用。因此,下一步将重点通过测定相关激素含量的变化,探索禾生指梗霉菌致病过程中的关键激素类型及变化特点。同时,本试验还调查统计了不同谷子品种病叶的变化,结果显示,植株矮化,叶片变宽、变厚等现象不存在品种的差异。
HEILER 等[15]研究证明,在活体营养型蚕豆单胞锈菌(Uromyces viciae fabae)中纤维素降解酶被严格的分化专化性调控。JPR 等[16]研究报道,在禾白粉菌(Erysiphe graminis DC.)产生分化的附着胞时有纤维素酶活性,从而支持了专性寄生真菌产生分化特异的细胞壁降解酶的论点。这些研究结果表明,细胞壁降解酶在病原菌侵染寄主植物时发挥着重要的作用。CHI 等[17]和COOPER 等[18]研究发现,病原菌与寄主植物互作过程中,病原菌分泌的细胞壁降解酶不仅能够抵御植物的抗性反应,还能维持自身的正常功能。大部分病原菌产生多种细胞壁降解酶协同作用,可有效分解寄主细胞壁利于其成功侵染。本研究发现,病原菌侵染后的植株,细胞壁降解酶的活性发生了变化,病原菌在侵染寄主时纤维素酶活性会发生变化,纤维素酶活性在前期活性较低,但随着发病程度的加重,酶活性升高,与石延霞等[19]对接种黄瓜霜霉菌(Pseudoperonospora cubensis Berk.et Curt.Rostov.)叶片的细胞壁降解酶活性测定的结果非常相近。GIBSON 等[20]和PURBASHA 等[21]研究表明,病原菌在发病前期会抑制果胶酶的活性,而在发病后期酶活性显著升高,与本研究果胶酶在病原菌侵染后期发挥重要作用的结果一致。本研究通过测定果胶酶等细胞壁降解酶活性,结果发现,不同发病程度的叶片果胶甲基酯酶和果胶裂解酶的酶活性在病菌侵染的不同时期均显著高于健康叶,叶片发生纵裂时酶活性分别达到最高值,而多聚半乳糖醛酸酶酶活性病叶与健康叶相比差异不显著,在TG5 时酶活性明显升高,并且差值达到最大时比纤维素酶、果胶甲基酯酶和果胶裂解酶处于最大值时的酶活性都高。表明多聚半乳糖醛酸酶在叶片形成发丝时(TG5)发挥重要作用。
在本研究基础上,可以进一步研究细胞壁降解酶相关基因在病原菌侵染过程中发挥的作用,为研究病原菌与寄主的互作机制奠定基础。病原菌侵染后植株表型的变化可能与植物激素含量的变化密切相关,但尚需进一步研究证实。

