先天性心脏病合并心外畸形同期手术效果分析
王双兴,李诗兰,张 伟,张 辉
先天性心脏病(congenital heart disease,CHD)约占活产婴儿8‰~13.08‰[1-2],其中CHD 合并心外畸形约占CHD 人群9.3%[3]。以往针对这类患儿均采用分期手术治疗,这不仅增加了患儿的创伤,同时也加重了家长的负担。本文以本院收治的CHD合并心外畸形施行同期手术的31 例患儿作为研究对象,探讨同期手术的临床效果,现报告如下:
1 资料与方法
1.1 研究对象 选取2015 年5 月至2019 年9 月间,在本院心脏外科行CHD 合并心外畸形的同期手术共31 例患儿资料作为观察组,其中男25 例,女6例,中位年龄28(17,51)个月,平均体重(14.2±6.4)kg,其中心脏畸形为:房间隔缺损19 例、室间隔缺损9 例、右心室双出口1 例、主动脉缩窄1 例、部分型肺静脉异位引流1 例。心脏外畸形包括:腹股沟斜疝9 例、鳃源性囊肿1 例,鞘膜积液7 例、隐睾6 例、尿道下裂(Ⅱ°阴茎型)1 例、先天性阴茎阴囊转位1例、多指2 例、双足多趾1 例、霰粒肿3 例。
选取与观察组患儿年龄、体重、心脏畸形、手术方式相匹配的31 例单纯CHD 手术患儿资料作为对照组。其中男25 例,女6 例,中位年龄30(16,49)个月,平均体重(14.9±7.4)kg。
1.2 研究方法
1.2.1 观察组 31 例患儿均在静脉、吸入复合麻醉气管插管下,由普外科、泌尿外科、骨科、眼科先行合并心外畸形矫治手术,之后再行心脏畸形矫治手术,其中5 例患儿在非体外循环下进行心脏畸形矫治(4 例房间隔缺损患儿为食道超声心动图引导下经胸房间隔缺损介入封堵术;1 例为非体外循环下主动脉缩窄矫治术),其余26 例均在体外循环下行心脏畸形修补术,术后返回心脏外科术后监护室;心脏及心脏外畸形均由本院具有10 年以上高级职称医师进行主刀手术。
1.2.2 对照组 为保证数据一致性,对照组中31例患儿采取的麻醉方式、手术方式及术者与观察组患儿相同。
所有患儿术后均返回心脏外科重症监护室治疗,并由专门负责数据收集的人员进行住院期间各项数据的采集录入,包括麻醉时间、手术时间、体外循环时间、主动脉阻断时间、术中出血量、气管插管时间、监护室滞留时间、住院时间、术后0 h(T0)、4 h(T1)、8 h(T2)、12 h(T3)、16 h(T4)、20 h(T5)、24 h(T6)内血糖、乳酸及血管活性药物评分等指标。
1.3 统计方法 采用SPSS 20.0 统计软件进行数据统计分析:服从正态分布的计量资料,采用均数±标准差表示(±s),两组间比较采用配对样本t检验,不服从正态分布的计量资料,采用中位数和四分位数间距[Q(Q1,Q3)]表示,两组间比较采用配对样本的秩和检验。组间血流动力学参数比较采用重复测量的方差分析进行比较,P<0.05 认为差异具有统计学意义。
2 结果
2.1 一般资料比较 观察组与对照组患儿相比较,月龄、身高、体重无统计学差异(P>0.05),见表1。
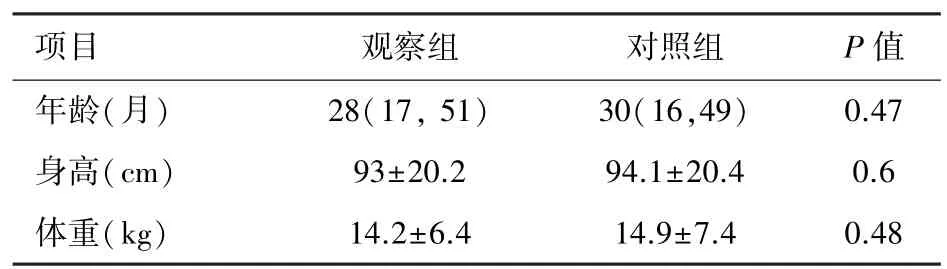
表1 两组患儿一般资料(n=31)
2.2 两组患儿住院指标比较 两组患儿均治愈出院,无术中出血量增多、延迟关胸、二次开胸、伤口感染等并发症。观察组与对照组相比,麻醉时间、手术时间差异有统计学意义(P<0.05);体外循环时间、主动脉阻断时间、术中出血量、气管插管时间、ICU 滞留时间及住院时间差异均无统计学意义(P>0.05)。见表2。
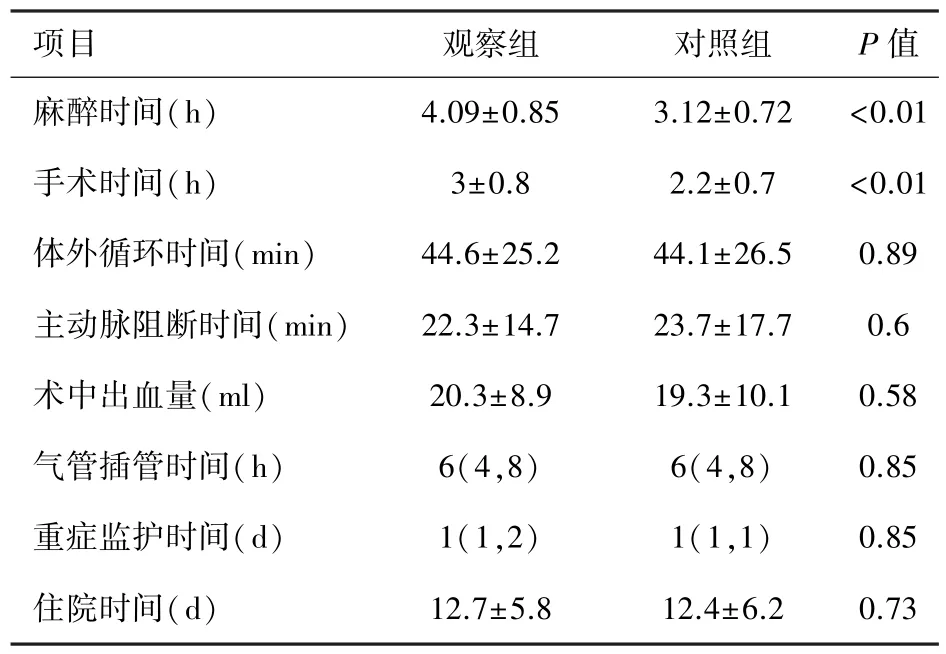
表2 两组患儿住院指标比较(n=31)
2.3 两组患儿术后各时点血流动力学参数比较观察组与对照组相比,术后24 h 血糖(glucose,Glu)、乳酸(Lactic acid,Lac)及血管活性药物评分(vasoactive-inotropic score,VIS)差异均无统计学意义(P>0.05),见图1~3。
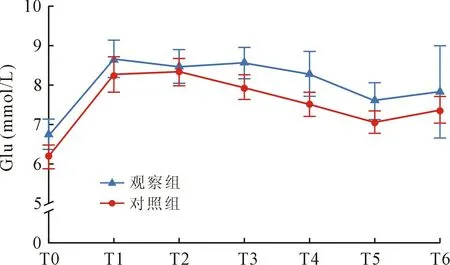
图1 两组患儿术后24 h 各时点Glu 变化
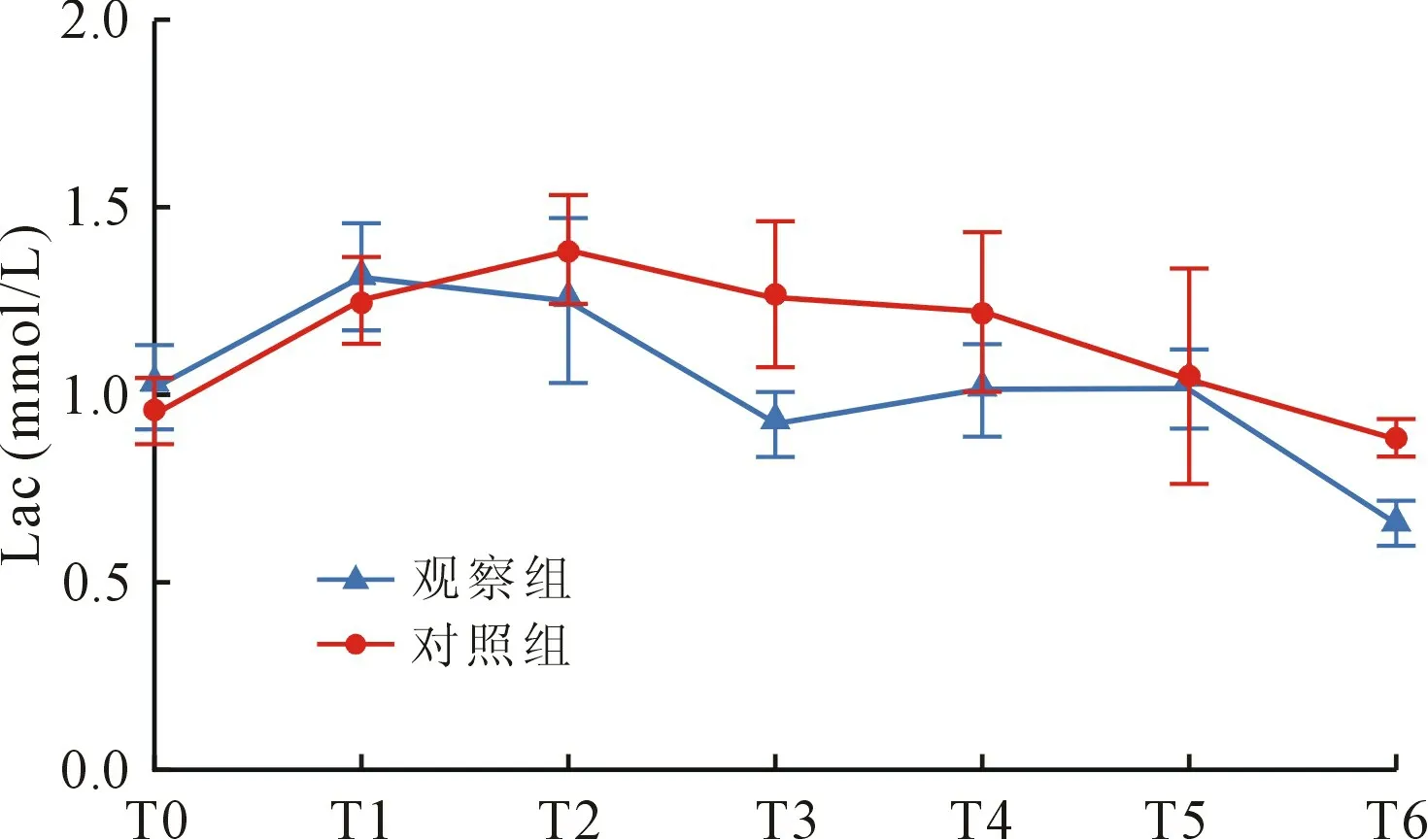
图2 两组患儿术后24 h 各时点Lac 变化
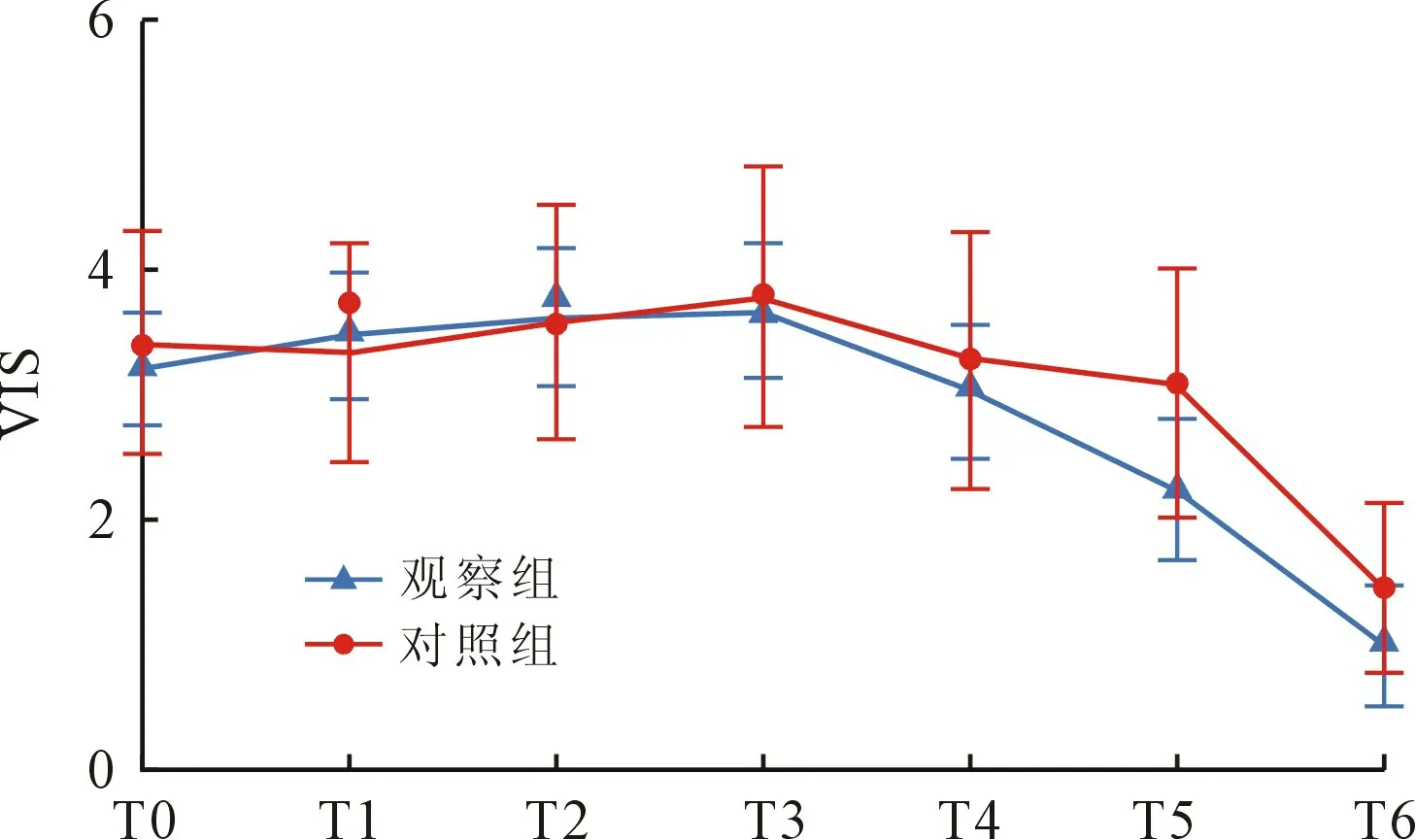
图3 两组患儿术后24 h 各时点VIS 变化
3 讨论
随着CHD 诊疗水平和外科技术的提高,CHD儿童的死亡率和预期寿命在过去几十年间有了很大程度的改善[4],由于他们中的大部分可以存活至成年,这就产生了一组新的群体,即需要进行CHD 合并心外畸形手术的儿童[4-5]。
以往对这类患儿均采用分期治疗,即先行CHD手术,出院一段时间后再行心外畸形手术,这是因为同期手术需要满足以下几点:①同期手术需要在能够同时实施小儿外科手术与心脏外科手术的儿童医院进行,并且需要一定专业技术力量;②要求麻醉医师具有较高的水平,能够完成普外科麻醉及小儿心脏外科麻醉;③对术后监护及护理也有较高的要求,需要具备小儿心脏外科手术后监护经验的医师与护士团队及小儿外科手术后监护经验的医师与护士团队;④要求手术室护士既能够完成小儿外手术的配合又能完成心外科手术的配合。然而由于以上各种因素影响,同期手术目前还未能在我国范围内儿童医院常规开展。
对于传统的分期手术而言,患儿需要经历多次住院、多次抽血、多次检查、多次麻醉,不仅增加患者的麻醉风险及术后监护风险[6-7],同时也加重了家长的经济负担。对于这类患儿能否在一次麻醉下行同期手术以同时解决合并畸形,规避由于多次麻醉、插管而给患儿带来的损伤,是值得探讨的课题。
本文以在本院心脏外科行CHD 合并心外畸形的同期手术的31 例患儿临床资料作为研究对象。从所选择的合并畸形里,笔者发现心脏畸形中,房间隔缺损的占比最高,而在合并畸形中,消化及泌尿系统畸形是最常见的相关缺陷,其次为五官及骨骼畸形。这与其他学者的报道结果存在一定的差异[8-10],可能是由于CHD 和心外畸形的入组标准不同,导致发病比例有所差别。
虽然与单纯心外畸形相比,中、重度CHD 合并心外畸形患儿行心外手术的风险和死亡率要明显升高,但对于如房间隔缺损、室间隔缺损等相对简单类型的CHD 患儿来说,并没有明显差异[11-13]。如果手术、麻醉及监护等各学科团队配合得当,可以有效提高患儿麻醉及手术的安全性,改善预后[14]。因此本文心脏畸形主要选择对患儿血流动力学影响较小的相对简单的CHD,如左向右分流型CHD:室间隔缺损、房间隔缺损、动脉导管未闭、部分型肺静脉异位引流、部分型心内膜垫缺损;单纯右向左分流型CHD:如法洛四联症(不跨环)右心室双出口(主动脉瓣下型室间隔缺损),血管环、简单型主动脉缩窄。对于合并心外畸形的选择主要是集中在未涉及到重要实质、腹腔脏器(肝、脾、胰、肾脏、肾上腺、脑等)或体表肿物等简单先天性心外畸形,如腹壁疝、鞘膜积液、隐睾、泌尿生殖器畸形、多指/趾及软组织肿物等。目的是避免因手术创面过大、操作时间过长、出血过多等导致患儿血流动力学不稳定,进而更好的探索同期手术的临床效果。
本组临床资料显示,同期手术组及对照组共62例患儿均治愈出院,无一例出现术中出血量增多、延迟关胸、二次开胸、伤口感染等并发症;与对照组相比,麻醉时间及手术时间差异有统计学意义,这是因为CHD 手术大多数需要在体外循环下进行,由于心脏手术创伤及体外循环炎性介质释放,导致心脏、肺脏等组织器官明显水肿以及机体凝血功能障碍[15-16],所以对于此类患儿,首先施行心外畸形手术,然后再进行心脏手术,两者之间需有约30 min手术间隔,这是造成同期手术的麻醉时间及手术时间较对照组稍长的原因,但是这样做的益处是可以减少非心脏手术时创面出血的风险,降低术中循环及呼吸功能的维护难度。另外,从两组患儿的体外循环时间、主动脉阻断时间、术中出血量、气管插管时间、ICU 滞留时间、住院时间及术后24 h 内两组患者的Glu、Lac 及VIS 上看,并无明显差异,说明同期手术并未增加患儿的围术期手术风险,并且通过一次麻醉和手术同时解决患儿多系统问题,手术效果满意,减少患者医疗成本,节约社会医疗资源。
尽管多发畸形结构复杂性、生理紊乱及血流动学异常,使得围术期管理更加困难[17-19],但是通过术前细致评估患儿情况、采取个体化麻醉、手术方案,组建训练有素的多学科团队,可以很大程度降低CHD 合并心外畸形同期手术的风险,避免了二次手术给患儿带来创伤。
我们的经验表明对于相对简单的CHD 合并常见心外畸形,同期手术安全可行,方法值得推广。对于存在严重CHD 或复杂心外畸形患儿,是否需要同期手术以及手术方案还需个体化评估,也是未来进一步研究的方向。

