老年人群心脑血管动脉钙化与骨密度减低的关系研究*
洪文娟,周 锐,刘 冬,黄 洁,马晶晶,王从过,符晓艳,周华东,△
(1.蚌埠医学院,安徽蚌埠 233000;2.陆军军医大学西南医院骨科,重庆 400042;3.陆军特色医学中心创伤外科,重庆 400042;4.陆军特色医学中心神经内科,重庆 400042)
心脑血管疾病是老年人群死亡的主要原因,心脑血管动脉钙化与心脑血管死亡密切相关,但与骨密度减低的关系尚不清楚。骨质疏松症和心脑血管疾病是常见的老年病,二者通常在老年人群共存,表明二者之间存在潜在联系[1]。有研究显示,骨密度降低与心脑血管事件的发生相关[2]。血管钙化已被证明是心脑血管疾病的重要病理基础,可预测心脑血管疾病的发病率和病死率。因此,推测骨密度降低会增加心脑血管事件的发生,这可能与颈动脉和冠状动脉钙化斑块的形成有关。最新的实验研究发现,血管钙化发生过程中存在着血管平滑肌细胞向成骨细胞转分化的病理过程[3]。还有研究提示,骨保护素等骨代谢生物标志物可能与血管钙化的形成有关[4]。本研究旨在探讨老年人群颈动脉和冠状动脉钙化斑块与骨密度降低的关系,以期为缺血性卒中和缺血性心脏病的防治提供重要依据,现报道如下。
1 资料与方法
1.1 一般资料
本项目为横断面对照研究,选取2016年1月至2017年12月陆军特色医学中心神经内科和蚌埠医学院第一附属医院神经内科收治的1 566例住院患者为研究对象。纳入标准:(1)年龄大于或等于60岁,自愿参加本项研究,愿意完成本项目所需的各项检查。(2)完成颈动脉和冠状动脉CT血管成像(CTA)检查,颈动脉和冠状动脉发现有斑块,包括钙化斑块和非钙化斑块。(3)长期居住在本城市居民。排除标准:(1)严重骨关节炎等风湿类疾病,或长期服用激素类药物。(2)近3年有恶性肿瘤,呼吸衰竭、肝、肾衰竭,痴呆,精神疾病,B超检测为周围动脉疾病患者。根据心脑血管动脉是否钙化分为钙化斑块组和非钙化斑块组,钙化斑块组523例,平均年龄(68.57±9.70)岁;非钙化斑块组1 043例,平均年龄(68.72±10.14)岁。本研究获得医院医学伦理审查委员会的批准,所有受试者均提供知情同意书。
1.2 方法
1.2.1临床资料收集
包括卒中、缺血性心脏病、外周动脉疾病、恶性肿瘤、发热、慢性阻塞性肺疾病、慢性肝炎、慢性肾功能不全、高血压、糖尿病和血脂异常等情况。空腹采血测定血糖、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、三酰甘油(TG)、骨保护素(OPG)、骨钙素(OC)、Ⅰ型胶原交联末端肽(CTX)、Ⅰ型胶原N-氨基末端肽(PINP)、骨碱性磷酸酶(BALP)和1,25-二羟维生素D[1,25(OH)2D]。并计算BMI。
1.2.2骨密度检测
采用双能X线骨密度仪(美国DEXA公司)测定骨密度。采用腰椎(L1~L4)骨密度衡量整体骨骼健康状况。纳入研究的患者中有1 037例接受骨密度检测,根据四分位法,分为骨密度Q1(≥1.013 g/cm3)、Q2(0.883~<1.013 g/cm3)、Q3(0.753~<0.883 g/cm3)、Q4(<0.753 g/cm3)。
1.2.3动脉钙化斑块检测
采用64多排扫描仪(GE Healthcare,Milwaukee,WI)进行颈动脉和冠状动脉CTA检测。CTA影像由有经验的医师解读。根据CT密度,分为非钙化斑块和钙化斑块[4]。根据钙化斑块的位置,分为颈动脉钙化斑块、冠状动脉钙化斑块和共存钙化斑块。颈动脉斑块检测左右颈总动脉、颈内外动脉6段动脉。冠状动脉斑块检测7段心脏动脉,包括左主干、左前降支、回旋支动脉、右心动脉,以及对角支、钝缘支和后降支3大支。
1.3 统计学处理
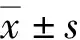
2 结 果
2.1 两组一般资料比较
钙化斑块组吸烟、高血压、糖尿病、血脂异常和缺血性心脏病比例及血清生物标志物OPG、OC、CTX水平更高,骨密度更低[(0.78±0.05)g/cm3vs.(0.93±0.07)g/cm3](P<0.05)。随着年龄的增加,钙化斑块组钙化斑块的发生率增高,见表1。
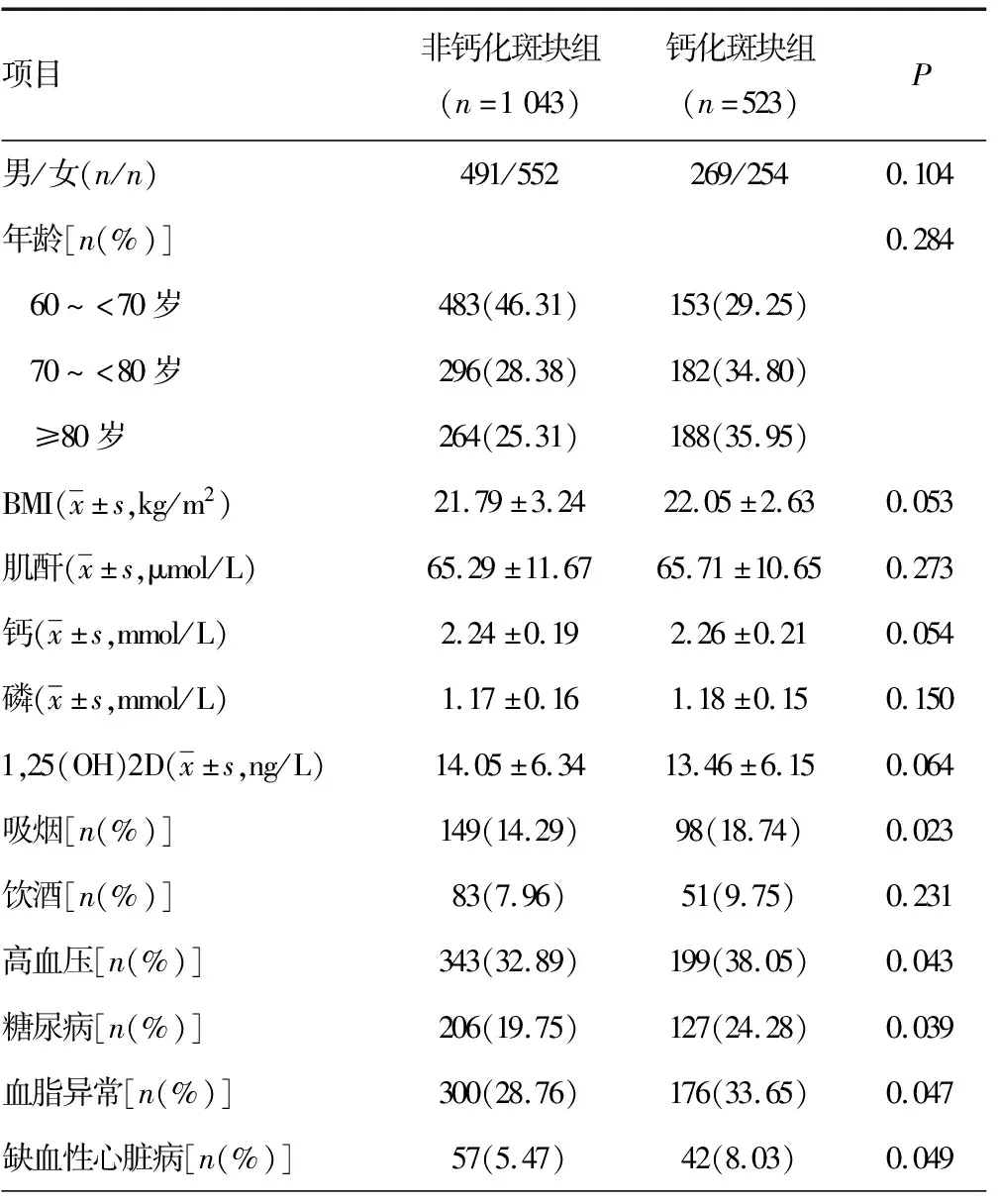
表1 两组一般资料比较
2.2 心脑血管动脉钙化斑块与骨密度关系的多因素分析
为获取颈动脉和冠状动脉钙化斑块发生风险的独立预测因子,多因素logistic回归分析显示,在调整了年龄、性别、骨密度、吸烟、高血压、糖尿病、血脂异常、缺血性心脏病、OPG、OC和CTX混杂因素后,发现低骨密度、吸烟、高血压、糖尿病、血脂异常与动脉钙化斑块的发生风险明显相关(P<0.05),血清OPG、OC及CTX水平升高增加了钙化斑块的发生风险(P<0.05),见表2。

表2 心脑血管动脉钙化斑块与骨密度关系的多因素分析
2.3 心脑血管动脉钙化斑块与骨密度的相关性分析
在调整了混杂因素后,骨密度Q3区间和Q4区间与动脉钙化斑块的发生风险明显相关(P<0.05)。严重的骨密度减低(Q4区间)使颈动脉钙化斑块的发生风险增加2.481倍,使冠状动脉钙化斑块的发生风险增加3.015倍,使共存钙化斑块的发生风险增加3.338倍,见表3。

表3 心脑血管动脉钙化斑块与骨密度的相关性分析
2.4 血清骨代谢生物标志物与不同骨密度心脑血管动脉钙化斑块的相关性分析
在骨密度Q1区间中,无任何血清骨代谢生物标志物与动脉钙化斑块发生的风险明显相关。在骨密度Q2区间中,OPG水平与动脉钙化斑块发生的风险明显相关(P<0.05)。在骨密度Q3区间中,OPG、OC和CTX水平与动脉钙化斑块发生的风险明显相关(P<0.05)。在骨密度Q4区间中,Ca、1,25(OH)2D、OPG、OC、CTX、PINP和BALP的水平与动脉钙化斑块发生的风险明显相关(P<0.05),见表4。

表4 血清骨代谢生物标志物与不同骨密度心脑血管动脉钙化斑块的相关性分析
3 讨 论
本研究表明在老年人中,心脑血管动脉钙化与骨密度减低和骨代谢生物标志物变化密切相关,骨密度与颈动脉和冠状动脉钙化斑块的发生呈明显负相关。以上研究结果提示骨密度的减低增加了动脉钙化斑块的形成,是心脑血管疾病发生的病理基础。
在以前的研究中,骨密度降低已被证明与动脉粥样硬化钙化斑块的发生有关[6-7]。关于骨密度与冠状动脉钙化斑块的研究较多,而与颈动脉钙化斑块的研究较少。2020年的一项横断面研究比较了1 459例患者的临床特征和骨密度,按照有无颈动脉钙化和颈动脉钙化斑块将这些患者分为3组,结果发现,有血管钙化的女性患者颈动脉粥样硬化与骨密度呈负相关[8]。有研究探讨了在非裔美国人中骨密度与动脉粥样硬化钙化斑块之间的关系,使用单排和多排螺旋CT系统结合标准化扫描方案,对300例受试者进行了冠状动脉、腹主动脉和颈动脉钙化斑块测量[3]。在调整了年龄和其他混杂因素后,观察到骨密度的降低与动脉钙化斑块之间呈明显的负相关。另一项横断面研究探讨了892例年龄大于70岁的妇女的骨密度与动脉粥样硬化钙化斑块之间的关系[9],通过检查椎体骨密度和冠状动脉,颈动脉和主动脉的钙化斑块。在单因素分析中,有钙化斑块患者的骨密度低于无钙化斑块患者的骨密度。骨密度降低与3个部位血管床的钙化斑块之间均存在明显的负相关。另一项横断面研究也证实了骨密度与动脉钙化斑块的发生呈负相关[10]。研究者测量了340例受试者的动脉钙化斑块负荷和骨代谢情况,观察到随着年龄的增长,动脉矿物质沉积活性明显增加,而局部骨代谢是降低的,结果表明,骨密度降低与动脉粥样硬化钙化斑块的发生风险相关。
以上结果显示,骨密度与动脉钙化斑块的发生密切相关。有些研究结果不一致,可能是由于受到以下各种因素的影响,包括受试人群的多少、年龄的大小和动脉钙化检测方法的不同。以上这些研究主要在欧美国家进行,也有一项日本的研究,但国内的报道较少。
研究表明,血清OPG、OC和CTX等骨形成生物标志物可能在血管钙化的发生中起着重要作用[11],提示骨密度降低与血管钙化的发生密切相关。有研究证明矿化标记物可以在动脉粥样硬化斑块中表达,且动脉粥样硬化斑块钙化的形成过程涉及成骨细胞和破骨细胞样动脉细胞,与骨形成生理过程有许多相似之处[12]。许多流行病学研究已经表明,OPG可以增加心脑血管疾病的发生风险。OPG通过阻断NF-κB配体(RANKL)成为骨重塑的主要调节因子。最近一项研究表明,血清OPG水平是血管钙化和动脉粥样硬化进展的重要标志[13]。本研究还证明了血清OPG水平升高与骨密度不同四分位数的钙化斑块有关。也有不同的实验结果,认为OPG可以减小动脉粥样硬化病变的大小并抑制动脉壁钙的沉积[14]。OC是骨矿化基质中含量最丰富的非胶原蛋白之一,OC能扩展骨骼的内分泌功能,具有明显的骨外效应[15-16]。本研究还发现OC与动脉钙化斑块之间存在明显的正相关。但其他研究也有不同的结论,有研究认为OC与冠状动脉粥样硬化性心脏病和冠状动脉粥样硬化无明显影响[17]。造成差异的潜在原因可能包括OC测量方法、人群特征、种族和性别的差异,以及测量钙化或动脉粥样硬化的方法不同[18]。作为Ⅰ型胶原的降解标志物,CTX出现在内膜增生区域和晚期钙化斑块中[19]。泡沫细胞可以通过组织蛋白酶K介导动脉粥样硬化钙化斑块的降解过程,有主动脉钙化的患者血清CTX水平与没有主动脉钙化的患者相比,具有差异性[20]。本研究也发现,CTX水平的增高与动脉钙化斑块的存在有着密切的关系。
血管钙化是心脑血管疾病重要的病理基础,本研究证明了骨密度降低与血管钙化斑块之间存在着一定的联系,为心脑血管疾病的防治提供了一条重要的思路。但本研究还存在一些局限性:(1)未随访骨密度的降低是否会影响动脉钙化斑块的发展;(2)未对骨密度降低与动脉钙化之间的具体机制进行研究;(3)未探讨骨密度降低后的治疗是否能改善动脉钙化斑块的发展。
综上所述,心脑血管动脉钙化与骨密度减低的分子机制有待进一步研究,以获取预测颈动脉和冠状动脉钙化斑块发生风险的独立因子。

