p38-MAPK介导AT2R对低氧/复氧损伤后PC12细胞的保护作用研究*
罗 敏,刘雅婷,龙双涟,彭凤玲,4△
(1.南华大学附属第二医院麻醉科,湖南衡阳 421001;2.南华大学衡阳医学院应用解剖与生殖医学研究所组织学与胚胎学教研室,湖南衡阳 421001;3.南华大学衡阳医学院2017级卓越医师班,湖南衡阳 421001;4.南华大学附属第一医院神经内科,湖南衡阳 421001)
缺血性脑病是最常见的脑血管疾病,临床治疗往往以重建脑血流、挽救濒死细胞、改善神经细胞功能为主要目的。但脑血流重建的同时也可能进一步加重缺血区组织的病理损害,即脑缺血/再灌注损伤[1]。神经细胞的缺氧/复氧(hypoxia/reoxygenation,H/R)损伤及缺血区神经细胞凋亡是脑缺血/再灌注损伤的主要表现[2]。研究发现,Bax和Bcl-2分别作为促凋亡基因和抑凋亡基因在细胞凋亡过程中发挥着重要作用[3],缺血可抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,参与细胞应激反应、凋亡和增殖等过程[4]。其中p38-MAPK与神经细胞的凋亡密切相关,调控p38-MAPK信号途径可明显改善大鼠脑缺血造成的神经损伤[5-6]。
血管紧张素Ⅱ型受体(angiotensin Ⅱ type 2 receptor,AT2R)是肾素-血管紧张素系统中主要活性分子之一。韩素芳[7]分析认为AT2R与血管紧张素Ⅱ相互作用后对缺血性脑损伤起保护作用,但具体机制仍不清楚。因此,本研究用化学性缺氧剂连二亚硫酸钠(Na2S2O4)处理大鼠肾上腺嗜铬细胞瘤(pheochromocytoma-derived cell line-12,PC12)细胞以复制H/R损伤的细胞模型,采用抑制剂、激活剂干预p38-MAPK信号分子,观察Bax和Bcl-2表达变化,以探讨AT2R活化影响H/R损伤PC12细胞存活的可能分子机制,现报道如下。
1 材料与方法
1.1 材料
PC12细胞株(受赠于南华大学神经科学研究所);四氮唑盐(MTT,北京康为世纪生物科技有限公司);2×Taq PCR Mastermix(上海市碧云天生物技术有限公司),FastQuant cDNA第一链合成试剂盒(长沙市佳和生物科技有限责任公司),Bax、Bcl-2和GAPDH引物(上海生工生物工程有限公司),p38-MAPK抗体、磷酸化p38-MAPK(p-p38-MAPK)抗体(美国Cell Signaling Technology公司),GAPDH、Bax及Bcl-2抗体(美国Biosharp公司),AT2R抑制剂PD123319(美国Abcam公司),AT2R激动剂CGP42112和p38-MAPK抑制剂SB203580(美国Sigma公司),GAPDH(美国CST公司),高糖DMEM培养基和无糖DMEM培养基(美国Solarbio公司),胎牛血清(杭州四季青生物工程材料责任有限公司);其他试剂均为进口或国产分析纯。
1.2 方法
1.2.1H/R损伤PC12细胞模型的建立及实验分组
PC12细胞置于含10%胎牛血清的高糖DMEM完全培养基中,于5% CO2、37 ℃恒温培养箱中孵育。取对数生长期细胞,弃培养液,以无菌磷酸盐缓冲液(PBS)洗3次,加入新鲜配制含40 mmol/L Na2S2O4的无糖无血清DMEM培养基中孵育,1 h后取出细胞,用无菌PBS洗3次,加入新鲜含10% 胎牛血清的高糖DMEM培养基,再置入5% CO2、37 ℃恒温培养箱中继续孵育1 h,复制H/R损伤细胞模型。
将H/R损伤PC12模型细胞分为4组:对照组(仅Na2S2O4处理)、CGP42112组(Na2S2O4+1×10-6mol/L CGP42112共处理)、SB203580组(Na2S2O4+1×10-6mol/L SB203580共处理)和CGP42112+SB203580组(Na2S2O4+1×10-6mol/L CGP42112+1×10-6mol/L SB203580共处理)。此外,分别以CGP42112和PD123319处理细胞,观察其作用的浓度和时间效应。
1.2.2MTT比色法检测细胞存活率
细胞接种于96孔培养板,40 mmol/L Na2S2O4处理细胞1 h,加MTT(20 μL 5 g/L),继续孵育4 h,弃孔内液体后收获细胞,每孔加入150 μL二甲基亚砜(DMSO),振荡混匀10 min以溶解结晶物,经全自动酶标仪测定各孔的吸光度(A值,波长为490 nm),取均值计算不同药物浓度和作用时间的生长抑制率。设定对照组A值代表的细胞存活率为100%,按以下公式计算细胞存活率:细胞存活率(%)=(实验孔A值—调零孔A值)/(对照组A值—调零孔A值)×100%。
1.2.3台盼蓝染色观察细胞活力
细胞接种于96孔培养板,经相应处理后以无菌PBS洗涤3次,加入约100 μL 0.4%的台盼蓝,静置染色3 min,显微镜下观察细胞形态。死亡细胞常被染成蓝色,活细胞则拒染呈无色透明状。
1.2.4Western blot
收集细胞提取蛋白质样品,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE,积层胶60 mV,分离胶120 mV)后电转移(100 mA,2 h)至聚偏氟乙烯(PVDF)膜。5%的牛奶封闭2 h后,依次孵育一抗和二抗,用高灵敏度化学发光检测试剂盒显色,凝胶成像系统采集图像并进行半定量分析。
1.2.5逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)
采用TRIzoL试剂常规提取细胞总RNA,按试剂盒说明,序列合成cDNA并进行PCR。产物经1%琼脂糖凝胶电泳后,以天能凝胶成像系统采集图像并进行半定量分析。实验中使用的引物序列见表1。

表1 引物序列
1.3 统计学处理
2 结 果
2.1 CGP42112和SB203580对H/R损伤PC12细胞存活的影响
与对照组比较,CGP42112组、SB203580组和CGP42112+SB203580组PC12细胞存活率升高,且CGP42112+SB203580组存活率高最高,差异有统计学意义(P<0.05),见图1。
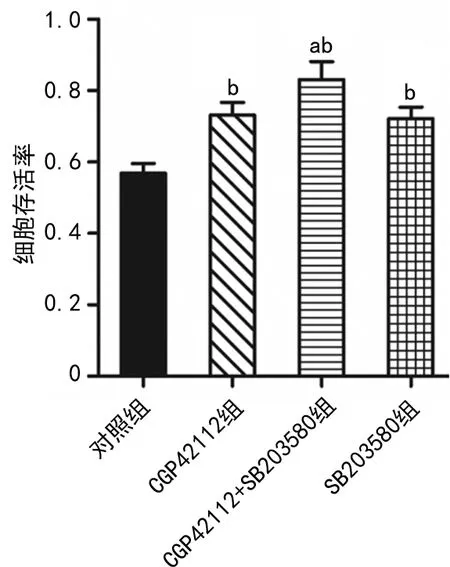
a:P<0.05,与CGP42112组、SB203580组比较;b:P<0.05,与对照组比较。
2.2 CGP42112和PD123319对H/R损伤PC12细胞p38-MAPK磷酸化的影响
CGP42112可下调细胞p-p38-MAPK蛋白表达,且随着CGP42112浓度升高和处理时间延长,p-p38-MAPK蛋白表达水平均逐渐降低,见图2。
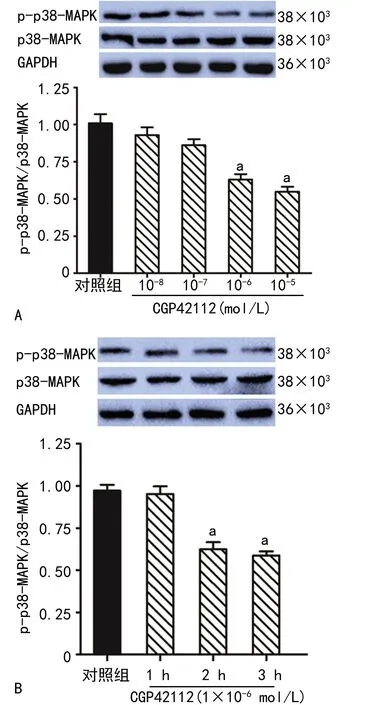
A:不同浓度CGP42112对p-p38-MAPK蛋白表达的影响;B:1×10-6 mol/L CGP42112处理不同时间对p-p38-MAPK蛋白表达的影响;a:P<0.05,与对照组比较。
PD123319可上调H/R损伤PC12细胞的p-p38-MAPK蛋白表达,且随着PD123319浓度升高和处理时间延长,p-p38-MAPK蛋白表达水平逐渐升高,见图3。台盼蓝染色法发现,与对照组比较,PD123319处理细胞后显微镜视野下被染成蓝色的死亡细胞数量增多,且随着PD123319浓度升高,死亡细胞数量逐渐增多,见图4。
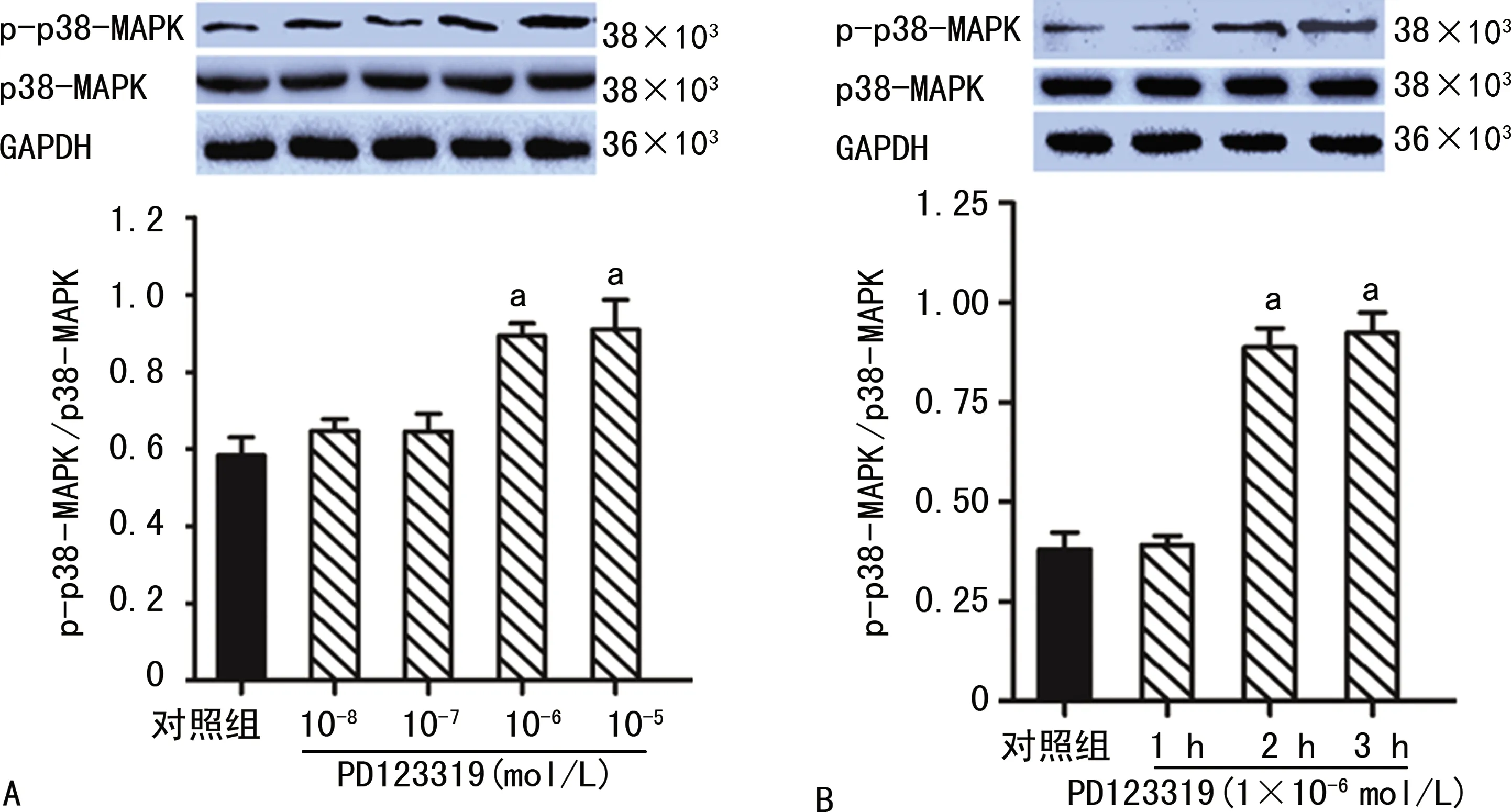
A:不同浓度PD123319对p-p38-MAPK蛋白表达的影响;B:1×10-6 mol/L PD123319处理不同时间对p-p38-MAPK蛋白表达的影响;a:P<0.05,与对照组比较。

图4 台盼蓝染色观察PD123319对H/R损伤PC12细胞活力的影响(10×20)
2.3 CGP42112和SB203580对H/R损伤PC12细胞Bax、Bcl-2 mRNA及Bax、Bcl-2蛋白表达的影响
与对照组比较,CGP42112组、SB203580组和CGP42112+SB203580组Bax mRNA表达水平降低,Bcl-2 mRNA表达水平升高,且CGP42112+SB203580组Bax mRNA表达水平最低,Bcl-2 mRNA表达水平最高,见图5。

A:H/R损伤PC12细胞中Bax mRNA的表达;B:H/R损伤PC12细胞中Bcl-2 mRNA的表达;C:Bax和Bcl-2 mRNA表达的灰度分析;a:P<0.05,与GP42112组、SB203580组比较;b:P<0.05,与对照组比较。
与对照组比较,CGP42112组、SB203580组和CGP42112+SB203580组Bax蛋白表达水平降低,Bcl-2蛋白表达水平升高,且CGP42112+SB203580组Bax蛋白表达水平更低,Bcl-2蛋白表达水平更高,见图6。

A:H/R损伤PC12细胞中Bax和Bcl-2蛋白的表达;B:Bax和Bcl-2蛋白表达的灰度分析;a:P<0.05,与CGP42112组、SB203580组比较;b:P<0.05,与对照组比较。
3 讨 论
MAPK是细胞内重要的蛋白激酶之一,其介导的信号通路可以将胞外刺激信息传导至胞核内,调控基因的转录和表达,从而参与细胞的生物学功能[8]。p38-MAPK是MAPK家族中的重要成员,它与应激反应、脑缺血等病理条件下所诱导的细胞凋亡密切相关。有研究发现,抑制MAPK信号转导通路介导的炎性反应,可减少缺血引起的脑损伤[9],p38-MAPK在缺氧缺糖预处理后的神经损伤中也起着重要的作用[10]。
PC12细胞是大鼠肾上腺嗜铬细胞瘤细胞株,它在形态和功能上与神经细胞类似,常作为体外细胞模型被广泛应用于神经细胞分化和凋亡等方面的研究[2]。神经细胞的H/R损伤是脑缺血/再灌注损伤的主要表现之一,因此,本研究中以PC12细胞为研究对象,以化学性缺氧剂Na2S2O4模拟细胞缺氧反应环境,复制H/R损伤细胞模型,结果发现p38-MAPK特异性抑制剂SB203580能诱导H/R损伤PC12细胞的存活,提示抑制p38-MAPK可以减轻H/R所导致的PC12细胞损伤。
AT2R是肾素血管紧张素系统中的一种G蛋白偶联受体,它在大脑发育、脑缺血及高血压发病过程中有重要作用[11-12]。研究发现,AT2R与AngⅡ相互作用后可舒张血管、调节细胞生长发育、促进细胞增殖和分化、参与组织结构的修复和重塑,还可以促进侧支循环开放、改善脑血液循环、影响炎性因子分泌,保护缺血性脑损伤的组织和细胞[13]。本研究发现,AT2R激动剂CGP42112可促进Na2S2O4诱导的H/R损伤PC12细胞的存活,且与p38-MAPK特异性抑制剂具有协同作用,提示p38-MAPK信号通路参与了AT2R活化影响H/R损伤PC12细胞存活的作用。
磷酸化的MAPK是发挥其生物学作用的有效形式[14]。因此,检测细胞内磷酸化MAPK的水平可反映MAPK的活性。本研究采用AT2R激动剂CGP42112处理H/R损伤PC12模型细胞后发现,CGP42112可下调细胞p-p38-MAPK蛋白的表达。相反,AT2R抑制剂PD123319则上调该模型细胞的p-p38-MAPK蛋白的表达,抑制细胞的存活,提示AT2R活化可抑制p38-MAPK蛋白磷酸化,这也是AT2R活化减轻H/R致PC12细胞损伤的机制之一。
Bax是促凋亡基因,Bcl-2则为抑凋亡基因,两者在细胞凋亡过程中发挥着重要作用[3]。多项研究发现,在缺血性脑血管疾病中诱导Bcl-2/Bax表达比值增大,则可抑制缺血所诱导的神经元凋亡,提示Bax和Bcl-2之间的平衡或比值的变化在脑缺血神经元的凋亡过程中有着十分重要的作用[15-17]。本研究中,p38-MAPK特异性抑制剂SB203580和AT2R激动剂CGP42112均能下调H/R损伤PC12细胞Bax的表达,上调Bcl-2的表达,从而增大细胞内Bcl-2/Bax表达比值,这提示AT2R活化可减轻H/R所致的PC12细胞损伤,其机制可能是通过抑制细胞p38-MAPK蛋白磷酸化,影响细胞内Bcl-2/Bax表达比值,从而抑制PC12细胞的凋亡。
综上所述,脑血管疾病以颅内血液循环障碍导致脑组织损伤为特点,主要病理过程涉及缺血再灌注损伤后造成的神经细胞凋亡,但其机制尚未完全阐明。本研究以H/R损伤的PC12细胞为研究模型,探讨AT2R活化影响H/R损伤PC12细胞存活的机制,发现AT2R活化可抑制细胞p38-MAPK蛋白磷酸化,增高Bcl-2/Bax的表达比值,提示AT2R活化是通过调控p38-MAPK信号通路而影响Bcl-2、Bax的表达,从而保护H/R损伤的PC12细胞,增加其存活率。

