MMP伴喘息患儿血清NF-κB、HMGB1表达与炎性细胞因子水平的相关性及其诊断价值*
谢 菲,陈瑞东,赵 洁,徐春艳,岳 彬
沧州市中心医院:1.儿内一科;2.儿内二科,河北沧州 061000
肺炎支原体肺炎(MMP)是儿童常见的呼吸系统感染性疾病,近年来发病率呈升高趋势[1]。MMP不仅引起咳嗽、咳痰等症状,部分儿童可出现喘息症状,严重影响儿童健康和生活质量,目前对于MMP伴喘息的发病机制仍未完全明确,相关研究表明,气道炎性反应和免疫紊乱可能是造成喘息发作的重要基础[2]。核转录因子-κB(NF-κB)参与多种炎症性疾病的发生与发展,其相关通路的激活在机体抗感染性疾病中发挥重要作用,与机体抗MMP有密切关系[3]。高迁移率族蛋白B1(HMGB1)是近年来新发现的一种炎症介质,在MMP发生和发展中起到重要作用[4]。NF-κB和HMGB1及其相关炎性因子可能与MMP伴喘息的发生密切相关。本研究分析血清NF-κB、HMGB1表达水平与MMP伴喘息患儿炎性细胞因子的关系及其诊断价值,旨在初步探究NF-κB、HMGB1对MMP伴喘息的可能作用机制及两者的诊断价值,现报道如下。
1 资料与方法
1.1一般资料 选择2018年1月至2019年10月本院收治的MMP患儿90例,纳入标准:(1)所有患儿均符合MMP的诊断标准[5]。①患儿发热,表现为弛张热或不规则热,咳嗽重;②双肺呼吸音粗、干啰音或湿罗音;③胸片可见大叶性肺炎、间质性肺炎、支气管肺炎或肺门淋巴结肿大;④血MMP-IgG或MMP-IgM≥1∶160。(2)患儿年龄1~8岁,入院时病程<2周。(3)入院前6个月内未服用抗感染及影响免疫功能的药物。(4)患儿家属对研究知情同意且签署知情同意协议。排除标准:(1)有支气管哮喘、慢性呼吸系统疾病的患儿。(2)患有先天性免疫疾病的患儿。(3)合并其他部位感染和炎症的患儿。(4)不能完成研究的患儿。根据是否伴有喘息分为MMP伴喘息组38例和MMP不伴喘息组52例。另选取同期健康儿童40例作为健康对照组,纳入标准:(1)年龄1~9岁;(2)家属对研究知情同意,能完成研究。本研究经医院伦理委员会批准,伦理审批号[(伦审)H20171109]。
1.2研究方法
1.2.1标本采集 所有患儿于入院当日采集外周静脉血5 mL,健康对照组儿童采集外周静脉血5 mL,均用两个试管分装,静置后经4 000 r/min离心5 min,离心半径12 cm,分离血清用于荧光定量PCR和酶联免疫吸附试验法检测。
1.2.2荧光定量PCR检测NF-κB、HMGB1表达水平 取一试管血清,应用Trizol-氯仿-异丙醇-乙醇法提取血清中总RNA,并按照试剂盒操作步骤逆转录合成cDNA,试剂盒购自上海吉凯基因化学技术有限公司。利用Primer 5软件设计目的基因和内参引物,内参采用3-磷酸甘油醛脱氢酶(GAPDH),以上引物由上海吉凯基因化学技术有限公司设计完成,引物序列见表1。应用荧光定量PCR检测各组血清NF-κB、HMGB1表达水平,仪器为瑞士Roche公司生产的Cobas 480荧光定量PCR仪,反应条件:95 ℃,3 min;95 ℃,30 s;60 ℃,35 s,共40个循环,经过40个循环扩增后收集荧光信号,根据目的因子、内参GAPDH的循环阈值(Ct),使用2-ΔΔCt法计算相对表达量:ΔCt=Ct(目的因子)-Ct(GAPDH);ΔΔCt=ΔCt-ΔCt(对照样本),每个样本设计3个复孔,取3个复孔的平均值作为相对表达量。

表1 荧光定量PCR引物序列
1.2.3酶联免疫吸附试验法检测炎性细胞因子水平 取另一试管血清,采用酶联免疫吸附试验法测定血清白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平,试剂盒为上海酶联生物技术有限公司生产,严格按照试剂盒操作进行。
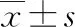
2 结 果
2.1各组儿童基线资料比较 90例MMP患儿中,MMP伴喘息组患儿38例,男性21例、女性17例,平均(5.38±2.04)岁,平均病程(5.92±2.12)d;MMP不伴喘息组患儿52例,男性29例、女性23例,平均(5.42±2.11)岁,平均病程(5.34±2.15)d ;健康对照组,男性22例、女性18例,平均(5.32±2.27)岁,各组性别、年龄比较差异无统计学意义(P>0.05);MMP伴喘息组与MMP不伴喘息组性别、年龄、病程比较,差异无统计学意义(P>0.05),具有可比性。
2.2各组血清NF-κB及HMGB1表达水平比较 MMP伴喘息组、MMP不伴喘息组患儿血清NF-κB及HMGB1表达水平高于健康对照组,MMP伴喘息组患儿血清NF-κB及HMGB1表达水平高于MMP不伴喘息组,差异有统计学意义(P<0.05),见表2。
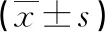
表2 各组血清NF-κB及HMGB1表达水平比较
2.3各组血清IL-1β、IL-6及TNF-α水平比较 MMP伴喘息组、MMP不伴喘息组患儿血清IL-1β、IL-6及TNF-α水平高于健康对照组,MMP伴喘息组患儿血清IL-1β、IL-6及TNF-α水平高于MMP不伴喘息组,差异有统计学意义(P<0.05),见表3。
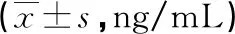
表3 各组血清IL-1β、IL-6及TNF-α水平比较
2.4MMP伴喘息患儿血清NF-κB及HMGB1表达水平与血清IL-1β、IL-6及TNF-α水平的相关性分析 经Pearson相关分析结果显示,MMP伴喘息患儿血清NF-κB表达水平与血清IL-1β、IL-6及TNF-α水平呈正相关(P<0.001),血清HMGB1表达水平与血清IL-1β、IL-6及TNF-α水平呈正相关(P<0.001),见表4。

表4 MMP伴喘息患儿血清NF-κB及HMGB1表达水平与血清IL-1β、IL-6及TNF-α水平的相关性分析
2.5血清NF-κB、HMGB1、IL-1β、IL-6及TNF-α水平对MMP伴喘息患儿诊断的ROC曲线分析 绘制ROC曲线分析血清NF-κB、HMGB1、IL-1β、IL-6及TNF-α对MMP伴喘息的诊断价值,结果显示血清NF-κB最佳临界值为4.78,其灵敏度为88.28%,特异度为87.38%,ROC曲线下面积(AUC) 为0.863,95%CI为0.752~0.895;血清HMGB1最佳临界值为3.67,其灵敏度为84.74%,特异度为80.43%,AUC为0.815,95%CI为0.746~0.895;血清IL-1β最佳临界值为19.53 ng/mL,其灵敏度为70.24%,特异度为64.55%,AUC为0.685,95%CI为0.621~0.732;血清IL-6最佳临界值为16.24 ng/mL,其灵敏度为73.47%,特异度为66.89%,AUC为0.703,95%CI为0.637~0.754;血清TNF-α最佳临界值为42.87 ng/mL,其灵敏度为65.54%,特异度为58.23%,AUC为0.635,95%CI为0.596~0.685,血清NF-κB、HMGB1对MMP伴喘息的诊断价值优于血清IL-1β、IL-6及TNF-α,见图1。
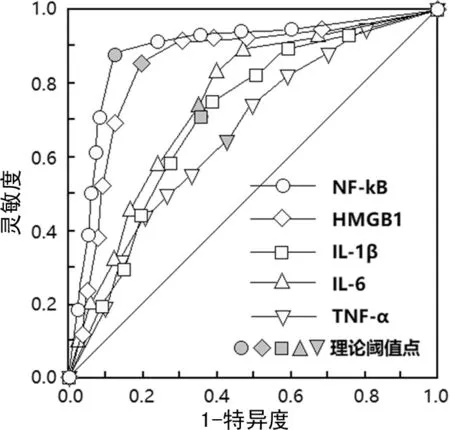
图1 血清NF-κB、HMGB1、IL-1β、IL-6及TNF-α水平对MMP伴喘息患儿诊断的ROC曲线分析
3 讨 论
MMP是一种好发于学龄前儿童的呼吸系统感染性疾病,近年来发病率居高不下,有报道显示,在冬春季等高发季节,MMP占儿童下呼吸道感染的30%[6]。与普通肺炎不同,MMP可引起胸腔积液、坏死性肺炎、肺不张等,另外约有25%的MMP患儿可出现血液系统、心血管系统并发症[7-8]。尤其是部分患儿可发生喘息,严重影响患儿的生活质量。目前对于MMP患儿发生喘息的机制仍未完全明确,研究表明其机制可能与以下几方面有关:(1)肺炎支原体直接造成呼吸道上皮损伤,增加呼吸道的反应性[9];(2)肺炎支原体细胞膜中含有丰富的脂质相关蛋白,进入体内后促进炎性因子的释放,引起喘息[10];(3)肺炎支原体感染后激活体内免疫细胞,导致机体免疫功能失调,诱导IgE产生[11]。
NF-κB是一类可以参与多种炎症性疾病的发生与发展的蛋白质,主要存在于细胞核内,正常情况下仅少量分泌入血液,当机体发生炎性反应时,可以刺激细胞核合成NF-κB,并释放入血[12]。有研究表明,NF-κB可以选择性结合B细胞κ轻链增强子,进而调节机体多个信号通路[13]。另外当机体发生炎性反应时,NF-κB可以与TNF受体相关因子1结合,引起机体TNF-α水平升高,NF-κB还可以通过与白细胞表面Toll样受体结合,导致IL-6、IL-8等炎性细胞因子表达升高,引起级联反应,促进炎症的发生[14-16]。HMGB1主要存在于细胞核当中,是一种广泛分布的非组蛋白[17],XUE 等[18]发现,HMGB1是一种重要的晚期致炎因子,其生成受多种炎性细胞因子的调控,当HMGB1释放到细胞外,可激活HMGB1/NF-κB通路,从而引发炎性反应。刘丽芬[19]报道指出,HMGB1、TNF-α、C-反应蛋白在支气管哮喘急性发作中起重要作用。
本研究采用荧光定量PCR检测MMP伴喘息、MMP不伴喘息和健康儿童血清中NF-κB及HMGB1表达水平,结果显示,MMP伴喘息组患儿血清NF-κB及HMGB1表达水平高于MMP不伴喘息组和健康对照组,提示在MMP喘息发生中NF-κB及HMGB1起重要作用。分析原因可能为MMP伴喘息患儿存在呼吸道高反应性、免疫功能失调及呼吸道的慢性炎症,这部分患儿感染肺炎支原体后,诱发机体产生NF-κB,并调节机体多个信号通路,引起级联反应,促进炎症的发生[20];MMP伴喘息患儿HMGB1也大量释放到细胞外,引发炎性反应[21]。进一步观察发现,MMP伴喘息组患儿血清IL-1β、IL-6及TNF-α水平高于MMP不伴喘息组和健康对照组儿童,提示IL-1β、IL-6及TNF-α促进MMP喘息的发生。IL-1β主要由单核细胞、内皮细胞和成纤维细胞产生,具有诱发机体免疫应答、刺激T细胞活化、促进B细胞分泌抗体的作用[22]。IL-6则具有活化T细胞、刺激细胞因子产生、增强自然杀伤细胞功能的作用[23]。当机体发生免疫功能失调时,可以出现IL-1β、IL-6水平升高。TNF-α是机体重要的炎性细胞因子,适当的TNF-α可以对机体起到保护作用,但当TNF-α产生过多时可以促进炎症细胞的募集和B淋巴细胞增殖,导致机体免疫应答增强[24]。笔者推测,MMP伴喘息患儿存在免疫功能失调和炎性反应,因此血清IL-1β、IL-6及TNF-α水平升高。
经Pearson相关分析显示,MMP伴喘息患儿血清NF-κB与IL-1β、IL-6及TNF-α水平呈正相关,血清HMGB1与IL-1β、IL-6及TNF-α水平呈正相关,说明各指标可能参与了MMP伴喘息的发展过程,与陈敏等[25]报道结果相符,推测当MMP患儿发生喘息后HMGB1可促进机体产生IL-1β、IL-6及TNF-α,进而促进疾病发展。本研究还分析了血清NF-κB及HMGB1对MMP伴喘息患儿的诊断价值,结果显示血清NF-κB诊断MMP伴喘息的灵敏度为88.28%,特异度为87.38%,血清HMGB1诊断MMP伴喘息的灵敏度为84.74%,特异度为80.43%,血清NF-κB、HMGB1对MMP伴喘息的诊断价值优于血清IL-1β、IL-6及TNF-α,提示对疑似MMP患儿进行血清NF-κB及HMGB1检测可以为MMP伴喘息的诊断提供辅助依据。
综上所述,MMP伴喘息患儿血清NF-κB、HMGB1表达水平、IL-1β、IL-6及TNF-α水平异常升高,患儿血清NF-κB、HMGB1与IL-1β、IL-6及TNF-α呈正相关。血清NF-κB、HMGB1的检测对MMP伴喘息具有较好的诊断价值。由于本研究开展时间尚短,收集的病例样本量较少,因此未进一步对不同病情程度的患儿进行分组且未对入组患儿进行随访,以探究血清NF-κB、HMGB1与病情严重程度及预后的关系,后续研究将扩大样本量并增加随访以期获取更加全面的结论。

