伊曲康唑对前列腺癌细胞增殖与迁移的影响
毕菡,于涛,孙希瑞,王晓丽,孙秀梅
1 潍坊医学院临床医学院,山东潍坊261000;2 潍坊医学院生命科学与技术学院
前列腺癌是男性泌尿系统常见的恶性肿瘤[1]。随着人口老龄化、吸烟、生活习惯的改变以及诊断水平进步,前列腺癌的发病率逐年上升[2]。目前,前列腺癌主要以手术、化疗、放疗、内分泌治疗等治疗方式为主,雄激素剥夺治疗(ADT)是前列腺癌治疗的基石,但多数患者会出现耐药并发展为转移性去势抵抗性前列腺癌(mCRPC),生存率较低[3]。伊曲康唑是一种广泛应用于临床的抗真菌药物[4]。近年来研究发现,伊曲康唑能抑制胰腺癌、肺癌、乳腺癌、前列腺癌、基底细胞癌等恶性肿瘤的进展[5],但其对前列腺癌细胞增殖与迁移的具体影响及机制尚不清楚。2019 年10 月—2020 年10 月,我们通过实验研究了伊曲康唑对前列腺癌细胞增殖与迁移的影响,并利用生物信息学联合网络药理学挖掘了相关作用的潜在分子机制。
1 材料与方法
1.1 材料 人前列腺癌细胞PC-3 购于上海吉凯基因化学技术有限公司。伊曲康唑(I8250)、MTT细胞增殖及细胞毒性检测试剂盒(M1020)、二甲基亚砜DMSO(D8375)、青霉素、链霉素、D-PBS 缓冲液(D1040-500)和胰蛋白酶(T1360)购于北京索莱宝生物科技有限公司;F-12K 培养基及灭活胎牛血清购于美国ATCC公司。
1.2 PC-3 细胞培养 使用F-12k 培养基,配制胎牛血清为体积分数10%,青霉素100 U/mL、链霉素100 μg/mL 的完全培养基。在细胞培养瓶内接种PC-3细胞,在37 ℃、5%CO2细胞培养箱中常规培养。
1.3 伊曲康唑溶液的配制与保存 称取250 mg 伊曲康唑溶于17.7 mL DMSO 溶液中,配成20 mmol/L的伊曲康唑存储液,再用培养基将存储液稀释40倍,配成500 μmol/L 的伊曲康唑稀释液。将DMSO溶于完全培养基,配制浓度为2.5%的DMSO 稀释液。使用伊曲康唑稀释液、DMSO 稀释液、培养基配制成DMSO 浓度为2.5%、伊曲康唑浓度分别为25、50、100、200、400 μmol/L的伊曲康唑工作液。
1.4 细胞增殖能力检测 采用MTT 法。取对数生长期的PC-3 细胞,用完全培养基配成细胞悬液后接种于96 孔板,每孔加入200 μL,5 000 个细胞/孔,再设置5 个调零孔,调零孔加200 μL 完全培养基。置于37 ℃、5%CO2细胞培养箱中培养过夜,待细胞贴壁后,小心吸去上清液,实验组加入180 μL 完全培养基,20 μL 不同浓度的伊曲康唑工作液,使每孔的DMSO 终浓度均为0.25%,伊曲康唑浓度分别为2.5、5、10、20、40 μmol/L,每个浓度设5 个复孔。溶剂对照组加入180 μL 完全培养基,20 μL 2.5%的DMSO 稀释液,使DMSO 终浓度为0.25%,设5 个复孔。空白对照组加入200 μL 完全培养基,设5 个复孔。37 ℃、5%CO2细胞培养箱中培养细胞48 h,弃上清,每孔加入完全培养基90 μL、MTT 溶液10 μL,常规培养4 h 后弃上清,每孔加入Formazan 溶解液110 μL,于摇床上震荡20 min,在酶联免疫检测仪490 nm 处测量各孔的OD 值,OD 值大小与细胞数量呈正相关。计算细胞增殖抑制率=1-(实验孔OD值-调零孔OD 值)/(空白对照孔OD 值-调零孔OD值)×100%。
1.5 细胞迁移能力检测 采用细胞划痕愈合实验。取对数生长期的PC-3 细胞,用完全培养基配成细胞悬液后接种于6 孔板,每孔接种2 mL,每孔9×105个细胞,共6 个孔。置于37 ℃、5%CO2细胞培养箱中,待细胞贴壁后,用1 mL 的枪头在单层细胞上垂直于标记线划一直线,吸去培养基,再用PBS清洗3 次。实验组加入无血清培养基、伊曲康唑工作液配制的溶液2 mL,使DMSO的终浓度均为0.25%,伊曲康唑终浓度为20 μmol/L,对照组加入2 mL 用无血清培养基配制的浓度为0.25%的DMSO 溶液,每组设3 个复孔。于37 ℃、5%CO2细胞培养箱中培养0、24 h 后在倒置显微镜下观察并拍照,计算细胞的相对迁移距离。
1.6 统计学方法 采用Graphpad prism 6.01 统计软件。计量数据用±s表示,两组数据间比较使用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 伊曲康唑对前列腺癌细胞PC-3 增殖的影响伊曲康唑处理PC-3 细胞48 h 后,实验组每一浓度的伊曲康唑均表现出PC-3 细胞增殖抑制,并且随伊曲康唑用药浓度增加,OD 值减小,即对PC-3 细胞增殖的抑制作用增强(表1)。溶剂对照组细胞48 h 后增殖抑制率为8.54%,实验组浓度为2.5、5、10、20、40 μmol/L 的伊曲康唑对细胞增殖的抑制率分别为12.22%、23.43%、35.30%、48.05%、60.09%,两组比较有统计学差异(P均<0.05)。
表1 用药处理PC-3细胞48 h后细胞增殖活力比较( ± s)
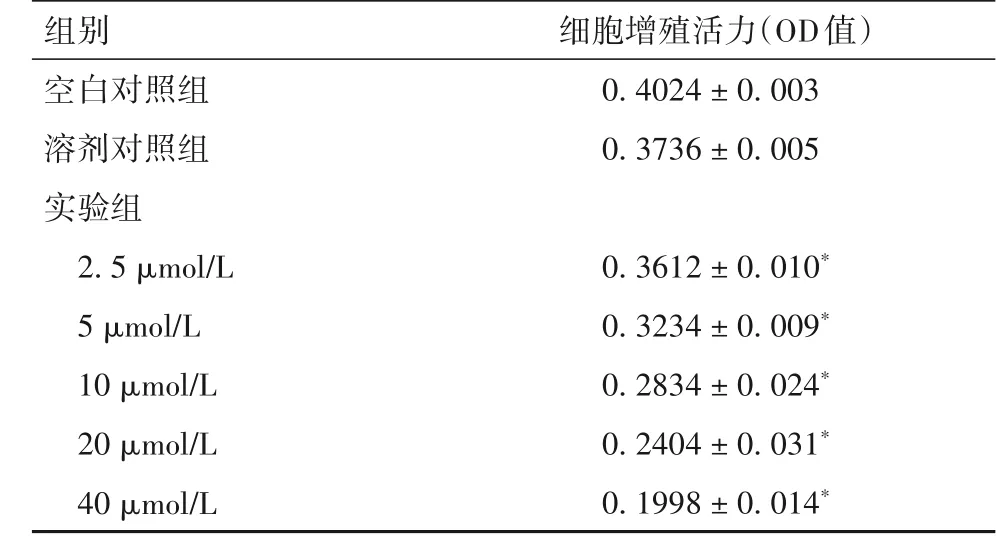
表1 用药处理PC-3细胞48 h后细胞增殖活力比较( ± s)
注:与溶剂对照组相比,*P<0.05。
组别空白对照组溶剂对照组实验组2.5 μmol/L 5 μmol/L 10 μmol/L 20 μmol/L 40 μmol/L细胞增殖活力(OD值)0.4024±0.003 0.3736±0.005 0.3612±0.010*0.3234±0.009*0.2834±0.024*0.2404±0.031*0.1998±0.014*
2.2 伊曲康唑对前列腺癌细胞PC-3 迁移的影响实验发现伊曲康唑可降低癌细胞的迁移能力,对照组细胞能更快地迁移并覆盖划痕处。24 h后实验组与溶剂对照组细胞的相对迁移距离分别为0.694 7±0.022 7、1±0.016 5,两组比较差异有统计学意义(t=15.41,P=0.000 1)。
3 讨论
伊曲康唑在2007 年被美国食品和药物管理局(FDA)确定为抗血管生成剂,2010 年被确定为Hedgehog 信号传导抑制剂[6]。Antonarakis 的一项Ⅱ期临床试验发现高剂量伊曲康唑(600 mg/d)能降低转移性去势抵抗性前列腺癌患者的循环肿瘤细胞计数但睾酮和硫酸脱氢表雄酮水平不受影响,其临床活性独立于雄激素调节,其机制可能与抑制Hedge‑hog信号有关[7]。SUZMAN等[8]报道过1例65岁生化复发的前列腺癌患者接受伊曲康唑300 mg 治疗,2次/天,12 周后PSA 水平下降50%以上,睾酮水平无明显变化,5 个月后,患者因高胆红素血症停止治疗,PSA 水平上升,发现伊曲康唑能有效降低PSA 水平。一系列临床试验表明伊曲康唑对前列腺癌治疗有适度的临床疗效,但其对癌细胞生物学行为的影响及作用机制尚不清楚。本实验研究发现,浓度为2.5、5、10、20、40 μmol/L 的伊曲康唑溶液均表现出对PC-3 细胞增殖的抑制作用,并且随用药浓度增加,抑制作用增强。伊曲康唑能明显降低癌细胞的迁移能力,20 μmol/L 的伊曲康唑溶液处理PC-3 细胞24 h后,细胞迁移抑制率为31%。
本研究还预测了伊曲康唑影响前列腺癌细胞增殖与迁移的机制,首先使用SWISS Target、STITCH、STRING 数据库预测伊曲康唑的作用靶点,其中直接靶点40 个、间接靶点219 个。从TCGA 数据库中下载了1 653个样本的转录组测序数据,其中前列腺癌组织样本1 497 个,正常组织标本156 个,分析得到差异基因3 844 个(P <0.05,|log2FC| >1.0)。药物和疾病的交集靶点69 个。利用DAVID 数据库进行KEGG 富集分析,发现伊曲康唑可能通过调节cAMP、Ca2+信号通路、癌症途径影响前列腺癌细胞的增殖和迁移,P分别为0.032 3、0.005 2、0.023 8。
伊曲康唑可能通过调节cAMP、Ca2+信号通路抑制前列腺癌细胞的增殖。钙信号是多种细胞过程的关键调节因子,细胞生存取决于钙动态平衡。大量的钙离子内流导致癌细胞快速而强烈的增殖,而钙离子浓度低的癌细胞生长受到抑制[9]。在前列腺癌中,Ca2+进入癌细胞激活T 细胞核因子(NFAT)转录因子,促进前列腺癌上皮细胞的增殖,雄激素非依赖性前列腺肿瘤细胞系也表达多种能够升高Ca2+水平的通道[10]。诸多恶性肿瘤与高钙血症有关,高钙血症可促进肿瘤的增殖和转移,并被认为是疾病末期的标志。钙通道阻滞剂已被证明可以影响细胞的增殖,细胞内Ca2+的轻微上调可促进多种肿瘤的发生和进展,而持续的大量的Ca2+流入可能导致肿瘤细胞死亡,Ca2+这一复杂的双重功能仍有待深入研究[11]。环磷酸腺苷(cAMP)是参与信号级联反应的第二信使,已成为包括癌症在内的多种疾病治疗的靶点[12]。比如,cAMP 途径在胰腺导管腺癌及其癌前病变中普遍被激活,cAMP 的大量外流触发细胞增殖过程,引起患者的低生存率[13]。而前列腺细胞内cAMP 介导的信号通路长期与上皮性肿瘤的发生和癌症的进展有关,在体外培养的前列腺癌细胞中,cAMP能抑制癌细胞增殖[14]。
伊曲康唑可能通过调节Ca2+信号通路、癌症途径抑制前列腺癌细胞的迁移。Ca2+通过调控锌指转录因子的表达介导上皮-间充质转换,减少肿瘤细胞与基底膜的黏附,有利于细胞迁移[15]。同时,在KEGG 富集的通路中,我们发现癌症途径富集的基因MMP-1、MMP-9 也与癌细胞迁移密切相关。基质金属蛋白酶(MMPs)是一组蛋白水解酶,其活性的发挥需要Ca2+、Zn2+等金属离子的辅助[16]。miRNA是一组小非编码RNA,能调节MMP 基因的表达,MMP-1是MMPs的一个家族成员,它作为蛋白酶激活受体1(PAR1)的激动剂,涉及大量的病理生理过程,如MMP-1 激活PAR1 并发挥亲肿瘤功能,包括增强内皮细胞通透性促进肿瘤转移,诱导蛋白活化以促进内皮细胞血管生成[17]。MMP-1 在黑色素瘤、宫颈癌、头颈癌多种肿瘤细胞中的表达失调促进癌细胞迁移,提示患者生存期更短,预后不良,MMP-1 不仅对胞外基质降解和细胞入侵有直接作用,还可以通过降解其他生物活性蛋白的受体来调节肿瘤细胞迁移[18]。MMP-1 表达水平与前列腺癌肿瘤转移范围呈正比,抑制MMP-1 活性能抑制大鼠前列腺癌肺转移的发生率[19]。研究[20]发现,MMP-9 可降解间质胶原,促进癌细胞侵入基质屏障并通过组织间质迁移,MMP-9 在前列腺癌组织中的表达高于癌旁正常组织,同样能促进肿瘤转移。
综上所述,伊曲康唑能有效抑制前列腺癌细胞的增殖和迁移,这可能是通过调控cAMP、Ca2+信号通路、癌症途径实现的,但其具体机制仍有待实验进一步验证。

