重组人尿激酶原与阿替普酶溶栓治疗急性ST段抬高型心肌梗死的作用评价
赵小辉, 卢双动, 陈 杰, 徐 阳, 王会哲
(保定市第二中心医院急诊科,河北省保定市 072750)
早期心肌再灌注治疗被证实能够有效降低急性心肌梗死的病死率,并改善患者预后[1-2]。目前主要的心肌再灌注治疗方法包括经皮冠状动脉介入(percutaneous coronay intervention,PCI)与溶栓疗法,其中溶栓疗法作为急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)的重要疗法之一,能够有效完成病变血管的再通,从而降低病死率[3]。结合中国大多数基层医院的医疗条件及实际情况,相当一部分STEMI患者无法得到及时的PCI治疗[4],尤其对于身处交通不便、偏远地区或者严重血流动力学不稳定的患者来说,选择合适的溶栓药物至关重要。
阿替普酶作为第二代溶栓药物,能够通过结合纤维蛋白赖氨酸使纤维蛋白结合的纤溶酶原转变成纤溶酶发挥溶栓作用[5-6]。而重组人尿激酶原(recombinant human prourokinase,rhPro-UK)为尿激酶的前体,能够通过激活与血纤维Y/E片段的结合实现溶栓的选择性,相较尿激酶出血风险更低,溶栓效果更强[7],理论上其疗效及安全性也优于阿替普酶。近年来有关新型溶栓药物对比第一代溶栓药物的临床研究较多[8-10],而关于重组人尿激酶原与阿替普酶的临床研究相对缺乏,且大多基线数据处理较为粗糙,无法得出相对可靠的结论。
本研究拟通过对STEMI患者使用重组人尿激酶原或阿替普酶溶栓疗法,利用冠状动脉造影评估溶栓后病变血管再通情况,观察并记录一系列临床不良事件,为重组人尿激酶原静脉溶栓治疗STEMI的疗效及安全性提供临床依据。
1 资料和方法
1.1 研究对象
选取2017年1月—2019年12月于本院住院确诊的STEMI患者100例。100例入选患者随机均分为尿激酶原组(50例)和阿替普酶组(50例)。
病例入组标准:诊断符合美国心脏协会/美国心脏病学会(AHA/ACC)相关标准,STEMI定义为持续缺血性胸痛大于30 min,心电图检查至少存在2个导联ST段上抬(V1~V3导联上抬至少0.2 mV以上,其余部位导联至少上抬0.1 mV以上)或者存在新发完全性左束支传导阻滞,同时肌钙蛋白T超过正常第99百分位点。排除标准:存在活动性出血、卒中或中枢神经系统外伤、颅内或脊髓手术史、恶性肿瘤或存在严重进展性疾病的患者、存在药物控制效果不佳的高血压患者(收缩压>170 mmHg或舒张压>110 mmHg),存在心源性休克且扩容或血管升压药物效果不佳、与首发心肌梗死部位相同的二次心肌梗死患者、口服抗凝药物的患者。
本研究经本院伦理委员会批准通过,所有患者及家属均知情同意。
1.2 治疗方案
尿激酶原组于3 min内静脉推注20 mg重组人尿激酶原[上海普佑克,5 mg(50万IU)/支],随后于90 min内静脉泵入重组人尿激酶原30 mg。
阿替普酶组有两种给药方法。①全量给药法:首先静推15 mg阿替普酶(德国Boe-bringer Ingelheim公司,50 mg/支),随后0.75 mg/kg在30 min内持续静脉泵入(最大剂量<50 mg),继之0.5 mg/kg在60 min内持续静脉泵入(最大剂量<35 mg)。②半量给药法:于2 min内静脉推注8 mg阿替普酶,随后90 min内静脉泵入42 mg。
所有患者溶栓前予300 mg阿司匹林口服,静脉注射普通肝素5 000 U(60~80 U/kg),溶栓后继续静脉泵入普通肝素,速率每小时12 U/kg,持续24 h,并给予阿司匹林100 mg/天。输注肝素过程中,每6 h监测活化部分凝血活酶时间(activated partial thromboplastin time,APTT),调整肝素用量,将APTT控制在50~70 s。冠状动脉造影结束,拔除动脉鞘管须在停用肝素后4~6 h、APTT≤50 s的情况下进行,压迫止血完成后1 h,继续予低分子肝素皮下注射(体质量≥75 kg者予60 mg/12 h,体质量<75 kg者予40 mg/12 h,持续4天)。
两组患者其余治疗按STEMI疾病治疗常规进行,若患者合并高血压、糖尿病等基础疾病予相应治疗。
1.3 冠状动脉造影
所有患者均在溶栓后24 h内行冠状动脉造影检查,如在溶栓过程中患者病情急剧恶化或者出现心源性休克,可提前进行冠状动脉造影。介入手术首先完成梗死相关冠状动脉(IRA)造影,行多体位造影确定冠状动脉狭窄程度、病变血管数量以及罪犯血管,并评估IRATIMI分级。所有介入均由2位以上从事冠状动脉介入工作>5年的心血管介入医师完成并评估造影结果,最终根据心肌梗死溶栓治疗临床试验(TIMI)血流分级标准制定处理方案:①TIMI 0~1级:予补救性PCI;②TIMI 2级:可行择期PCI。
行补救性PCI患者术前需追加口服氯吡格雷600 mg或替格瑞洛180 mg,并在术后口服氯吡格雷75 mg/天或替格瑞洛90 mg剂量(每天2次),维持至少8周。
1.4 终点事件及定义
主要终点事件:①冠状动脉造影评估的TIMI分级结果;②溶栓后30天内全因死亡、非致死性二次梗死、心肌缺血症状复发或以上3项事件同时发生。
二次心肌梗死:①溶栓或溶栓后行补救性PCI术心肌梗死相关症状消失后,再次出现持续15 min以上的心肌缺血症状;②心电图出现新的ST段改变或新的异常Q波;③心肌酶再次升高超过正常上限值(如已超过正常上限,则定义为再次超过20%);④原本冠状动脉造影证实通畅的冠状动脉再次发生闭塞。以上4项中至少出现2项,则可以定义为二次心肌梗死。
心肌缺血复发:经心内科医师诊断的心肌缺血相关症状复发、心电图改变、新发肺水肿或低血压或心脏听诊可闻及的因心肌缺血引发的心脏杂音。
次要终点事件为出血,包括微小出血、临床相关非重大出血(CRNM出血)、严重出血。出血事件严重程度按照国际血栓形成和止血学会(ISTH)分级标准[6]进行划分,依次为:①严重出血事件(包括血红蛋白下降>2 g/天以上、需要输血>2 U红细胞或全血、重要器官出血、致命性出血);②临床相关非重大出血(CRNM出血);③微小出血。
1.5 随访观察指标
分别于溶栓后1月、3月、6月进行临床随访,主要观察指标包括全因死亡、二次心肌梗死、心肌缺血复发、二次血运重建以及需要临床干预的心力衰竭的发生以及发生时间。
1.6 统计学分析
2 结 果
2.1 两组患者基线资料的比较
本研究共纳入100例患者,平均年龄(49.70±4.29)岁。逆概率加权前,两组患者基线资料在高血压、血脂异常等方面存在不平衡(P<0.05);经逆概率加权后,两组间各基线指标差异无显著性(P>0.05),且各项P在加权后均有上升。详细临床基线资料见表1,实验室检查结果见表2。
2.2 两组溶栓后造影结果(TIMI等级)的比较
溶栓后全部患者在24 h内接受冠状动脉造影。TIMI 0级、1级以及3级患者占比两组差异有显著性(P<0.05)。尿激酶原组与阿替普酶组两组造影结果存在补救性PCI指征(TIMI 0~1级)的患者例数分别为5例与19例,两组差异存在统计学意义(加权前P=0.021,加权后P=0.025)。溶栓后24 h内冠状动脉造影结果详见表3。
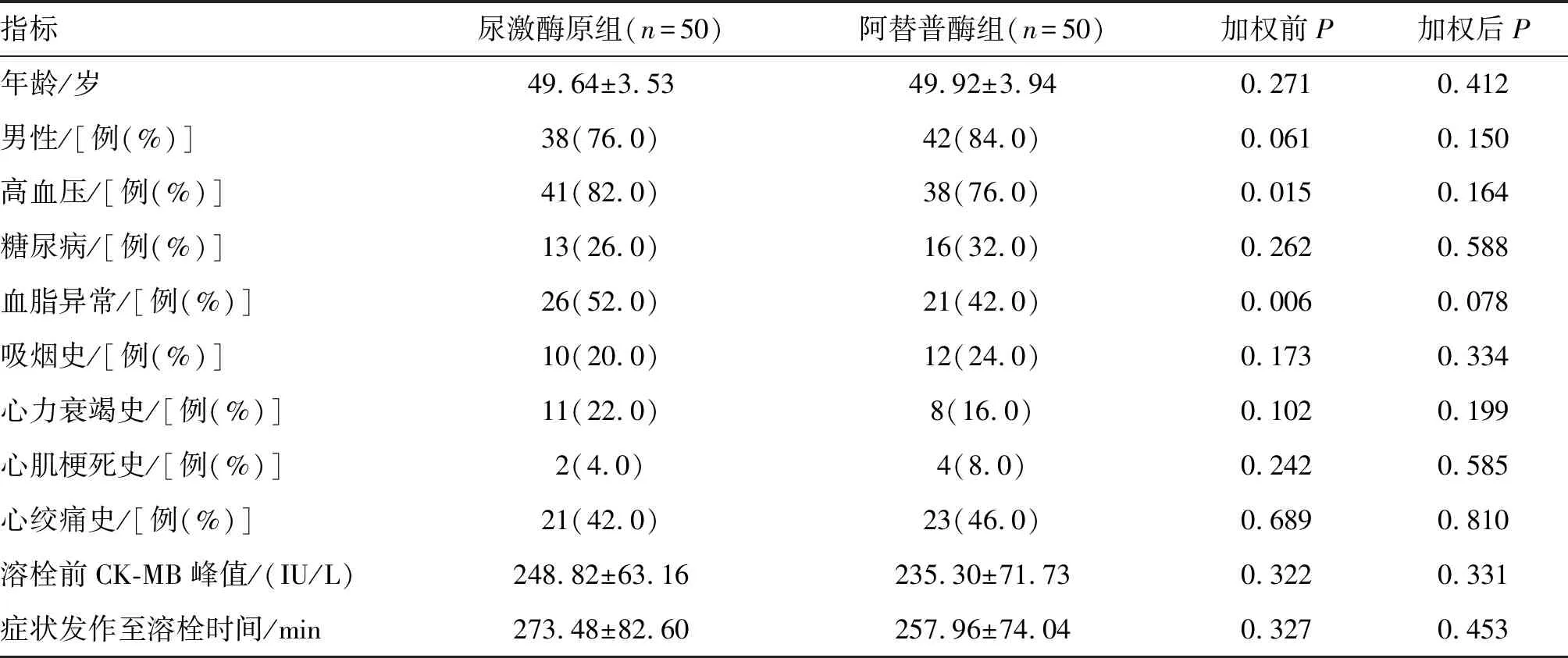
表1 两组患者基线资料的比较
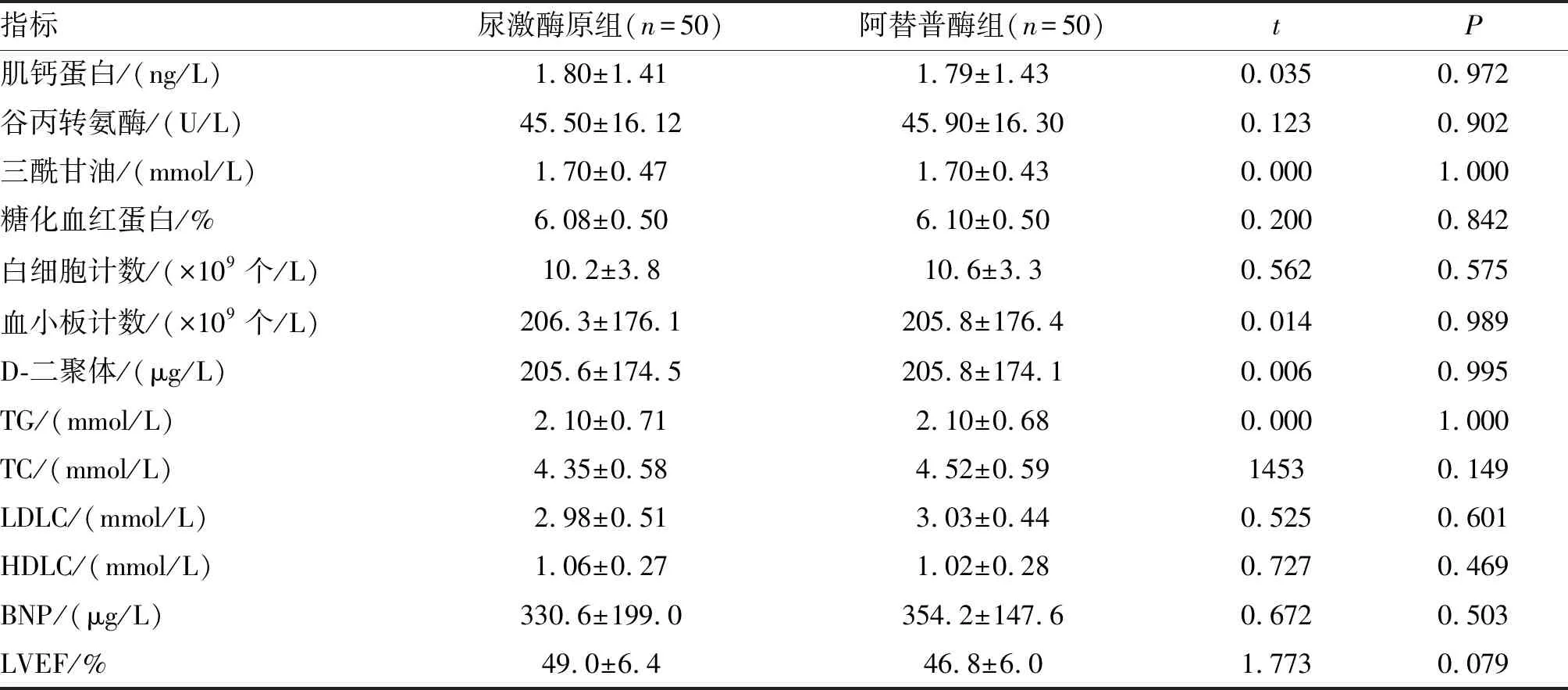
表2 两组患者术前实验室检查指标的比较

表3 两组患者溶栓后造影结果的比较 单位:例(%)
冠状动脉造影后,所有存在补救性PCI指征的患者(包括尿激酶原组5例,阿替普酶组19例)接受了PCI手术;其余TIMI等级患者IRA溶栓后狭窄程度良好,无方案外PCI手术。补救性PCI术后详情见表4,两组患者行补救性PCI术后TIMI血流差异无显著性(P>0.05)。
2.3 两组临床终点事件的比较
两组临床终点事件发生率的比较详见表5。主要临床终点事件方面,两组在溶栓后30天内全因死亡、非致死性二次心肌梗死以及心肌缺血症状复发均差异无显著性(加权前后P>0.05)。尿激酶原组死亡病例3例(5.0%),其中1例死于心源性休克,1例死于颅内出血,1例死于心脏破裂;阿替普酶组死亡病例5例(10.0%),其中3例死于心源性休克,1例死于术后心脏电风暴,1例死于心脏破裂。
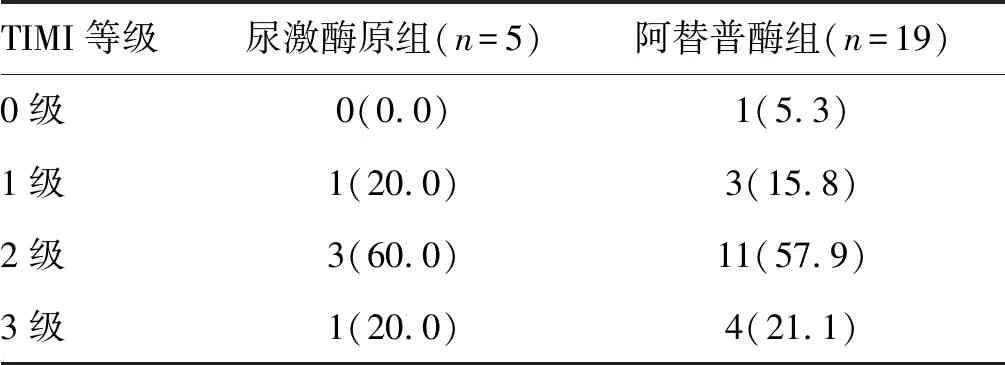
表4 行补救性PCI术后造影结果的比较 单位:例(%)

表5 两组患者临床终点事件的比较 单位:例(%)
2.4 两组住院期间不良临床事件的比较
两组患者在住院期间不良事件发生率比较见表6。尿激酶原组与阿替普酶组患者在住院期间心源性休克、心室颤动、室性心动过速、心房扑动或心房颤动以及房室传导阻滞发生率方面差异无显著性(加权前后P均>0.05)。溶栓后24 h内行冠状动脉造影方面,尿激酶原组存在补救性PCI指征的患者数量低于阿替普酶组,且差异有显著性(加权前P=0.021,加权后P=0.025)。
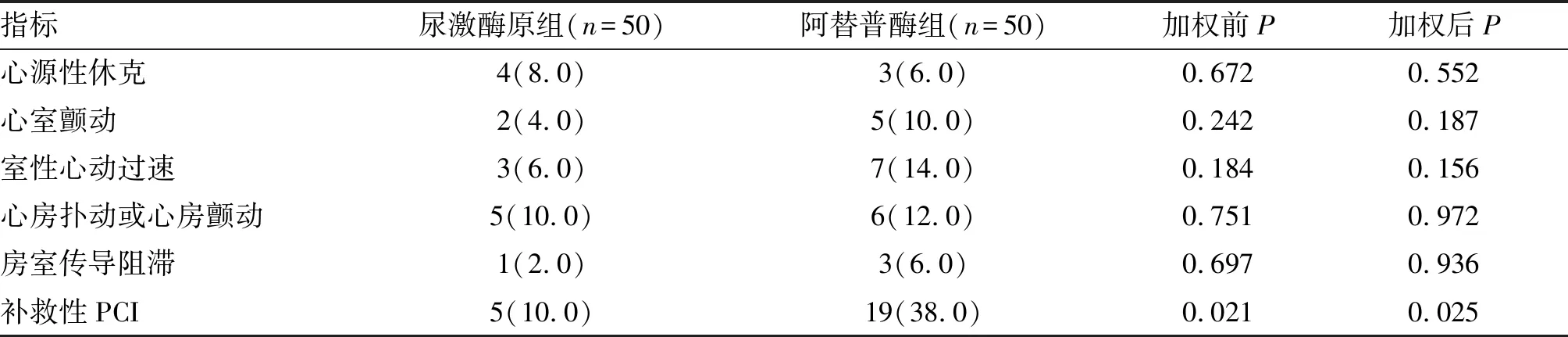
表6 两组患者住院期间不良临床事件的比较 单位:例(%)
2.5 两组随访期间不良临床事件的比较
除溶栓30天内死亡患者,两组其余患者均接受了临床随访。临床随访期间,两组患者在全因死亡、二次心肌梗死、心肌缺血症状复发、二次心肌血运重建以及出现需要临床干预的心力衰竭等方面差异无显著性(校正前后Log-RankP>0.05;表7)。其中尿激酶原组全因死亡2例,均死于二次心肌梗死引发的心源性休克;阿替普酶组全因死亡3例,2例死于心源性休克,1例死于心脏电风暴。尿激酶原组随访期间2例患者经历了二次心肌血运重建,均为PCI;阿替普酶组3例患者经历二次心肌血运重建,其中2例为PCI,1例为CABG。Kaplan-Meier曲线见图1。

表7 两组患者随访期间不良临床事件的比较 单位:例(%)
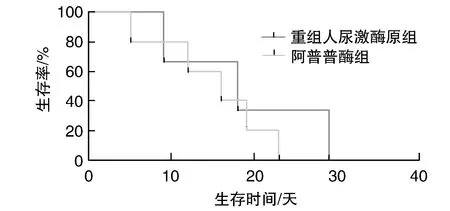
图1 两组Kaplan-Meier曲线
3 讨 论
本研究为单中心、前瞻性实验,经IPTW法加权校正后,两组溶栓患者的基线资料差异无显著性,具备可比性。本研究结果表明,与阿替普酶组比较,尿激酶原组患者在接受静脉溶栓后24 h内冠状动脉通畅率更高;尿激酶原组和阿替普酶组在溶栓后24 h内的冠状动脉造影方面,溶栓后存在补救性PCI指征(TIMI 0~1级)的患者数量差异有显著性(10.0%比38.0%,加权前P=0.021,加权后P=0.025);TIMI 0、TIMI 1、TIMI 4的患者数量两组差异有显著性,TIMI 3的患者数量两组间差异无显著性。两组在临床终点事件、住院期间不良事件发生率以及随访过程中不良事件方面的差异无统计学意义。
重组人尿激酶原为尿激酶的前体,能够通过激活与血纤维Y/E片段的结合实现溶栓的选择性,相较尿激酶出血风险更低,溶栓效果更强[11-13]。作为新型静脉溶栓药物,近年来关于重组人尿激酶原的临床实验不在少数[14-16]。本实验利用IPTW法加权控制组间基础信息偏倚,方法学方面在国内较为新颖。本研究中,重组人尿激酶原按照国内常规使用剂量及方法进行静脉溶栓,即3 min内静脉推注20 mg,随后用生理盐水稀释于90 min内静脉滴注30 mg,结果显示尿激酶原组冠状动脉再通率为90%,高于阿替普酶组的62%。金会群[17]将重组人尿激酶原以同样的剂量及方法行静脉溶栓治疗,根据溶栓后的冠状动脉造影检查判断血管再通情况,尿激酶原组的血管再通率为97.9%,阿替普酶组为91.5%,两组间血管再通率差异有显著性,与本研究的结论一致;不同组的血管再通率与本研究稍有出入,除了与不同研究病人的基线资料差异有关,阿替普酶的剂量和使用方法也存在差异;与上述研究不同,本研究中阿替普酶的使用方法按照国内常用的小剂量给药方案(于2 min内静脉推注8 mg,随后于溶于生理盐水在90 min内静脉滴注42 mg),可能导致血管再通情况的差异。此外,王影霞等[16]关于重组人尿激酶原对比尿激酶溶栓治疗急性心肌梗死的研究显示,尿激酶原组的溶栓血管再通率为91.11%,与本研究接近。
住院临床不良事件发生率方面,本研究中两组间差异无统计学意义;但除微小出血及重大出血发生率以外,尿激酶原组的其余不良事件发生率均低于阿替普酶组,说明重组人尿激酶原治疗急性心肌梗死疗效具备显著优势,而临床不良事件及安全性方面略优于阿替普酶,与金会群[17]研究结论相一致。杜立峰[18]的研究则表明,重组人尿激酶原的治疗效果与阿替普酶相似,且两者在不良心血管事件以及出血事件发生率方面差异无显著性,与本研究结论部分一致。而上述两份研究由于对基线数据的处理较为粗糙,组间差异较明显,可能是其研究中重组人尿激酶原的治疗效果与本文差异较大的原因。
为探究不同溶栓方案对心肌梗死患者短期预后的影响,本研究针对溶栓后存活患者进行了为期6月的随访工作,其中两组患者在全因死亡、二次心肌梗死、心肌缺血症状复发、二次心肌血运重建以及出现需要临床干预的心力衰竭发生等方面差异无显著性(校正前后Log-RankP>0.05),表明重组人尿激酶原静脉溶栓急性心肌梗死对患者短期内的预后无显著优势。但由于随访病人中有相当一部分住院期间接受了补救性PCI,可能影响最终的随访结果。本研究后期将专门针对接受重组人尿激酶原静脉溶栓的患者进行短期至中期随访,进一步分析探究其治疗效果以及对预后的影响。
综上所述,重组人尿激酶原静脉溶栓方案相比静脉注射阿替普酶,在提高血管再通率方面有显著优势,针对急性心肌梗死的疗效更好;另外,在心脏不良事件与出血事件方面,重组人尿激酶原的安全性略高,对于无法提供及时的PCI治疗的基层医疗机构来说,值得作为一线溶栓药物在临床应用。

