马铃薯病毒外壳蛋白融合基因转化马铃薯及其抗病性分析
胡新元,贾小霞,刘石,陈晓艳,黄伟,齐恩芳*
(1.甘肃省农业科学院,甘肃兰州730070;2.甘肃省马铃薯种质资源创新工程实验室,甘肃兰州730070;
3.甘肃省农业科学院马铃薯研究所,甘肃兰州730070;4.农业部西北旱作马铃薯科学观测实验站,甘肃渭源748201;5.哈密市伊州区种业研究开发中心,新疆维吾尔自治区哈密839001)
马铃薯是世界第四大粮食作物,宜粮、宜菜、宜饲、宜做工业原料,很多国家都非常重视马铃薯生产。种薯退化一直是制约马铃薯产业快速发展的重要问题,病毒侵染是引起马铃薯种性退化的主要原因。马铃薯X病毒(Potato virus X,PVX)、马铃薯Y病毒(Potato virus Y,PVY)、马铃薯卷叶病毒(Potato leaf roll virus,PLRV)和 马 铃 薯S病 毒(Potato virus S,PVS)在中国分布广泛、危害严重,是造成马铃薯种性退化的主要病毒[1,2]。而且在田间马铃薯病毒病发生比较复杂,经常混合感染,2种甚至多种病毒混合侵染带来的损失远大于各病毒单独侵染。病毒侵染造成马铃薯种质退化,产量降低,品质变劣。
目前在世界上还没有发现较成功的化学方法来防治病毒病,利用茎尖组织培养技术脱毒,工作量大,成本偏高,由于病毒的田间再侵染,能保持无病毒或低含量病毒的有效期限很短,脱毒2~3年后因再侵染问题产量又会严重降低。用常规育种方法改良品种抗性,由于马铃薯栽培种是同源四倍体作物,育种周期长,天然抗病毒基因资源缺乏,杂交后代遗传分离广泛,使得常规育种效率很低。
在自然界中,一种植物往往是多种病毒的寄主,病毒的共存会造成更严重的危害。将不同种类病毒的基因片段整合成融合基因,转化获得具有多重抗病性的转基因植物,是解决这一问题的有效途径。1986年,Abel等[3]首次成功地将烟草花叶病毒(tmv)的外壳蛋白基因转化到烟草植物中。此外,外壳蛋白基因介导的抗病毒基因工程还在西瓜[4]、小麦[5]、水稻[6]、百合[7-10]等多种植物中成功,获得病毒抗性。在马铃薯抗病毒基因工程研究中,宋艳茹等[11]用PVX和PVY双价外壳蛋白基因转化了马铃薯‘虎头’和‘克新4号’,张鹤龄等[12]对转基因马铃薯的抗病性鉴定结果表明,转基因马铃薯的多数株系的平均病毒含量均明显低于非转基因的对照植株,一些株系病毒积累较慢,发病时间延迟。说明转PVX和PVY双价外壳蛋白基因的马铃薯,对PVX和PVY复合侵染发生不同程度的抗性和保护作用。进而有些学者把不同病毒的基因或基因片段构建成融合基因导入植物,亦获得了双抗转基因植株[13-15]。
为了培育同时抗PVX、PVY、PLRV和PVS 4种病毒的转基因马铃薯,本试验克隆了4种病毒CP基因300 bp左右较保守的基因片段并构建了融合基因的转化载体,试验旨在通过基因工程使马铃薯获得对多种病毒的抗性,探索一条获得多抗病毒转基因马铃薯的有效途径,解决马铃薯种性退化问题。
1 材料与方法
1.1 植物材料
以马铃薯品种‘陇薯3号’的脱毒试管苗为供试材料(甘肃省农业科学院马铃薯研究所种质资源与生物技术研究室提供),马铃薯PVX、PVS、PVY和PLRV病毒株,采自甘肃省农业科学院会川马铃薯育种试验站。
1.2 菌株与质粒
供试菌株LBA4404,含有质粒pART27-XSYV-rh(由本试验室构建)[16],pART27-XSYV-rh含4种病毒(PVX、PVS、PVY和PLRV)CP基因片段,抗性标记为卡拉霉素(Kan)。
1.3 马铃薯的遗传转化与植株再生
采用“固体+液体”试管薯诱导方法获得‘陇薯3号’试管薯[17]。以诱导10周、直径为0.5 cm的‘陇薯3号’试管薯为外植体,参照张宁等[18]方法进行转化,将试管薯切成厚度为1 mm的薄片,接种于试管薯片分化培养基[MS培养基1L、吲哚乙酸(Indole-3-aceticacid,IAA)1.0mg、6-苄氨基嘌呤(6-benzyl-aminopurine,6-BA)1.0 mg、玉米素核苷(Zeatinriboside,ZT)2.0 mg]上,暗培养2 d后将试管薯薄片转移到含50 mg/L Kan、500 mg/L Crb的分化培养基上,25℃、16 h/d光照培养,诱导抗性芽,长至1.5 cm左右时剪下接入含50 mg/L Kan、500 mg/L Crb的1/2 MS培养基上生根培养,然后进行生根筛选,能正常生根及生长的小苗为抗性植株。
1.4 转基因植株的筛选
1.4.1 PCR检测
用CTAB法提取转基因马铃薯植株及非转基因马铃薯植株总DNA,以pART27-XSYV-rh质粒为阳性对照,非转基因马铃薯为阴性对照,以4种病毒融合基因的引物:X1(5'-CGGACTAGT Spe I GCAACTCCTGCCACGGCTT-3'),V2(5'-CGAGCTC Sac I CTAATTTGGAATTTGTTGACGTAG-GACTG-3')进行PCR扩增,预期扩增片段大小为1 200 bp。
1.4.2 PCR-Southern检测
参照于凤丽等[19]的方法,质粒pART27-XSYV-rh PCR扩增产物电泳回收的1 200 bp片段,转移到尼龙膜上,以地高辛标记后作为探针进行杂交。采用瑞士Roche公司的DIG High Prime DNA Labeling and Detection Starter Kit II试剂盒进行探针标记、膜杂交和显色处理。
1.4.3 qRT-PCR检测
分别提取DNA检测呈阳性植株的总RNA,用PrimeScript RT reagent Kit with gDNA Eraser试剂盒反转录成cDNA。以马铃薯Ef1α基因(Ef1α-F:5'-ATT GGAAACGGATATGCTCCA-3'和Ef1α-R:5'-TCCTTACCT GAACGCCTGTCA-3')为内参,用X1/V2为特异性引物,根据RealMasterMix(SYBR Green)试剂盒(TIANGEN),ABI QuantStu 5实时荧光定量PCR仪(ABI,USA)进 行qRT-PCR分 析。95℃2 min;95℃10 s,60℃34 s,72℃,30 s;45个循环。同时进行荧光值变化曲线和溶解曲线分析,并根据公式2-ΔΔCT算出融合基因在转基因植株中的相对表达量。
1.5 转基因植株的抗病性鉴定
将繁殖获得的转基因马铃薯无性系和非转基因马铃薯‘陇薯3号’脱毒苗移栽到营养盆中,苗龄约为6叶期左右接种病毒。PVX、PVY、PVS采用机械摩擦接种[每株接种2片中上部叶片,取毒源叶片分别按1∶10(w/v)比例用磷酸缓冲液(PB,pH 7.4)进行研磨,取汁液摩擦接种];PLRV采用蚜虫接种(将无毒桃蚜在感染PLRV的马铃薯植株上饲毒3 d,然后用带毒桃蚜接种,每株10头,接种5 d后杀蚜)。接种方式为PVX、PVY、PVS、PLRV依次接种(间隔3 d,每份材料分别接10株)。接种20 d后,用双抗体夹心酶联免疫吸附鉴定法(Double antibody sandwich enzyme linked immunosorbent assay,DAS-ELISA)检测病毒含量,检测过程按DAS-ELISA试剂盒说明书进行,显色反应结束后用IMARK型酶标仪(Bio-Rad,美国)测定405 nm处的吸光值。接种病毒的非转基因马铃薯‘陇薯3号’脱毒苗为阳性对照,未接种病毒的非转基因马铃薯‘陇薯3号’脱毒苗为阴性对照,测试样品吸光值等于或大于2倍阴性对照吸光值,判断为阳性。
数据统计分析采用DPS v13.5软件。
2 结果与分析
2.1 转基因马铃薯的获得
携带pART27-XSYV-rh质粒的农杆菌侵染‘陇薯3号’试管薯薯片,在选择培养基上培养2~3周后,从薄片上直接再生出抗性小芽,待抗性芽长到1 cm时,将其切下转入生根培养基经过3周Kan抗性筛选,转基因植株生根并正常生长,未转化植株不能正常生根,共获得10株抗性转化植株(图1)。
2.2 转基因马铃薯的分子生物学鉴定
以抗性苗总DNA为模板,质粒pART27-XSYV-rh为阳性对照,非转基因植株为阴性对照,利用融合基因的2个特异引物X1/V2对部分转基因植株进行PCR鉴定,结果阳性对照和10株抗性苗扩增出约1 200 bp的特异性扩增条带,而阴性对照和空白对照无扩增条带(图2)。初步证明再生植株为转基因植株。为了排除假阳性的存在,进一步鉴定PCR产物是1 200 bp的融合基因片段,将PCR产物电泳转膜进行Southern杂交,杂交结果(图3,部分植株检测结果)显示,非转基因植株、空白对照无杂交带,而阳性对照和各转基因植株有杂交带,检测结果与前期PCR检测结果相吻合,进一步证明这些株系是阳性转基因植株。qRT-PCR结果分析表明(图4),转基因马铃薯植株有典型的荧光扩增曲线和溶解曲线,而非转基因植株和空白对照的荧光扩增曲线和溶解曲线是一条直线。在转pART27-XSYV-rh株系中能检测到融合基因的表达,但基因表达水平在不同植株中存在一定的差异。基因表达量最高为S3-13,其次为S3-14,表达量最低的是S3-15。
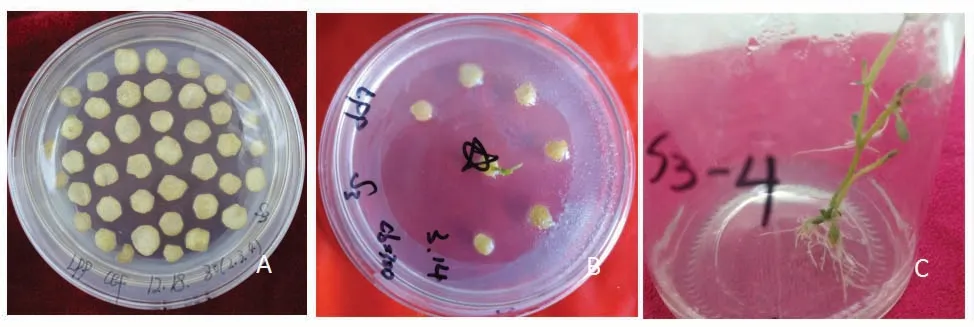
图1 抗性苗诱导过程Figure 1 Induction of resistant seedlings
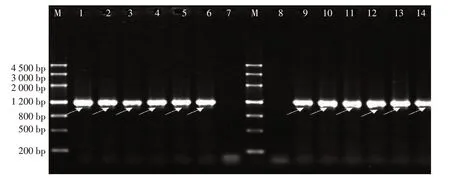
图2 转基因植株PCR鉴定Figure 2 PCR analysis of transgenic plants

图3 转基因马铃薯的PCR-Southern检测Figure 3 PCR-Southern analysis of transgenic potato

图4 转基因植株的qRT-PCR检测Figure 4 qRT-PCR analysis of transgenic potato
2.3 转基因马铃薯抗性鉴定
对经过qRT-PCR检测的3个转基因株系(S3-13、S3-14和S3-15)经切段快繁后移栽到营养钵,以非转基因‘陇薯3号’为对照,培养至6叶期时对转基因株系和对照进行病毒接种。接种20 d后各无性系的抗病性鉴定结果(表1中仅列出了经PCR-Southern和qRT-PCR分析的转基因植株的ELISA检测结果)表明:转pART27-XSYV-rh株系中,S3-13、S3-14的检测结果均为阴性,对4种病毒均具有抗性;S3-15的PVS、PVX和PVY检测结果为阴性,PLRV检测结果为阳性,但检测数值低于阳性对照。
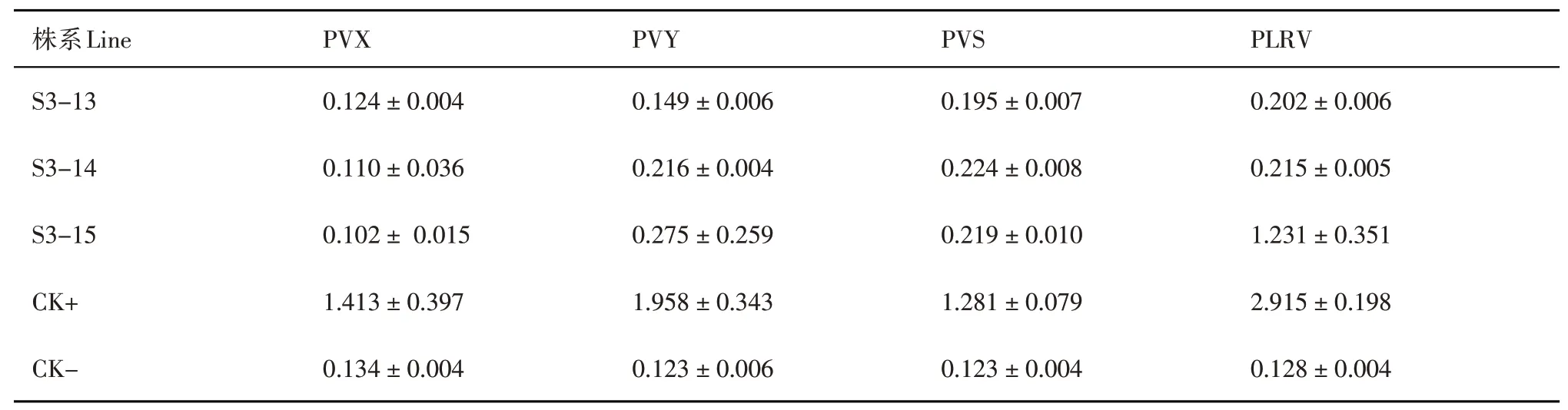
表1 转基因植株的ELISA检测(OD405)Table 1 ELISA analysis of transgenic potato plants(OD405)
3 讨论
PVX、PVY、PLRV和PVS 4种病毒分布广泛,为害严重,且多由蚜虫传播,自然条件下难以控制。由于马铃薯病毒病往往同时发生,单一抗性的品种改良已不能满足需要,而传统育种方法很难将4个抗性基因通过四倍体遗传集中到一个品种中。利用基因工程方法,将构建在不同载体上的多个基因转入同一受体,因为载体间的相互影响,致使效率大大降低[20]。对于多病毒抗性,国内外已开展诸多有关马铃薯转外壳蛋白基因抗病毒方面的研究[21-23],但主要针对PVX、PVY、PLRV 3种病毒复合侵染以及这3种病毒的两两复合侵染开展。PVS也是影响马铃薯产量和品质的主要病毒之一,且分布广泛,在世界各马铃薯种植区均有发生,PVS单独侵染时可减产10%~15%,与其他病毒复合侵染时可造成减产11%~38%[24],齐恩芳等[25]对甘肃省马铃薯主要病毒病发生情况调查发现,PVS发生比例最高,且易和其他病毒混合侵染。该病毒不易觉察,主要靠接触传毒,通过热处理及茎尖脱毒技术较难脱除干净,因此,也应加强针对PVS抗性的品种改良。
本研究将含PVX、PVY、PLRV和PVS 4种病毒外壳蛋白基因片段的融合基因,通过一次转化获得多抗转基因植株,可大大提高育种效率,对马铃薯的多基因转化可行性及马铃薯的抗病毒的研究具有重要的意义。
‘陇薯3号’是甘肃省生产主栽品种,且易受病毒感染,所以选为供试品种。因马铃薯是无性繁殖植物,转基因植株无性后代不发生分离,给转基因植株的检测、鉴定带来诸多方便。从试验结果分析来看,本研究利用农杆菌介导法转化马铃薯的研究中,分子检测证明融合基因已整合到‘陇薯3号’马铃薯基因组中,并在转基因植株中转录表达,抗病性鉴定结果也反映了某些转基因植株对4种病毒均具有抗性。
本试验用双抗体夹心酶联免疫吸附鉴定法(DAS-ELISA)检测病毒含量,用ELISA读数所显示的病毒滴度来表达转基因植物对病毒的抗性,转pART27-XSYV-rh株系中,S3-13、S3-14的4种病毒检测结果均为阴性,虽然PVY、PVS、PLRV的检测数值高于阴性对照,但对4种病毒均具有抗性;S3-15的PVS、PVX和PVY检测结果为阴性,PLRV检测结果为阳性,但检测数值也低于阳性对照,造成PLRV为阳性的原因也可能与接种病毒方法有关,PLRV采用蚜虫传毒,有一定的随机性。试验结果也表明,转4价CP基因株系的抗性程度不同,因此有必要筛选抗性株系。引起抗性差异的原因可能和转基因植株表达外源基因水平有关,也可能和病毒在植株体内增殖条件和症状发育条件不同有关。后续研究中将对抗病植株抗病性与目的基因RNA的累积关系开展进一步研究,同时对转基因株系的表型、症状发育、田间表现、品质及产量也进行鉴定和分析,最终筛选出对4种病毒同时具有抗性的转基因马铃薯新种质,从而为马铃薯抗病育种工程提供良好的亲本材料。

