趋化因子CXCL2及其受体CXCR2在子宫颈鳞状细胞癌和子宫颈上皮内瘤变组织中的表达
杨丽丹,齐曼古丽·如孜,图荪阿依·吾麦尔,张飞娥,刘玉武*
(1新疆医科大学基础医学院形态中心,乌鲁木齐 830017;2新疆维吾尔自治区人民医院消化科,乌鲁木齐 830011;3中南大学湘雅二医院爱尔眼科学院,长沙 410011)
子宫颈癌发病率居女性恶性肿瘤发病率的第二位,严重威胁着全世界女性的健康。子宫颈癌细胞可通过与人HPV病毒相互作用,进一步诱导细胞因子和化学趋化因子的产生而逃避宿主免疫监视[1],趋化因子能够引导细胞产生趋化运动。根据其氨基端(N端)半胱氨酸的排列方式,可分为CXC(α亚家族,其N端含C‐X‐C(X为任一氨基酸)) 、CC(β亚家族,其N端含C‐C) 、C(γ亚家族,其N端仅含一个C)和 CX3C(C‐X3‐C家族)亚族 4大类[2],各自相对应的受体分别是 CXCR、 CCR、CR与 CX3CR。其中CXC 趋化因子家族,依据其结构中是否含有谷氨酸‐亮氨酸‐精氨酸( Glu‐Leu‐Arg)功能区,又可分ELR 趋化因子和非 ELR 趋化因子两类。趋化因子与其受体相结合后能诱导相应靶细胞进行迁移和细胞骨架重排,从而增强靶细胞与相应细胞的附着能力[3]。另外,CXC 趋化因子在细胞的发育、生长、凋亡、分化等多种生理作用方面发挥着重要的作用,并参与许多病理过程[4]。大量研究显示大多数肿瘤细胞可以产生 CXC 趋化因子并且作用于自身,促进自身细胞增殖和新生血管生成、参与肿瘤的生长和转移[5,6]。
CXCL2是CXC亚族的一个成员,也称为GRO‐2或GRO‐β,它通过与受体的特异性结合发挥作用,近年来,CXCL2作为一种潜在致癌因子已用于食管鳞状细胞癌[7]、恶性胃肠道间质细胞瘤[8]等几种人类癌症的检测。近期的一项研究表明,CXCL2‐CXCR2信号轴在结肠癌细胞在腹膜创面的粘附和生长也起着促进作用[9]。本文旨在运用免疫组织化学方法检测分析CXCL2/CXCR2在CIN及子宫颈鳞状细胞癌(cervical squamous cell carcinoma, CSCC)中的表达特点,以期为宫颈癌的诊断和防治提供依据。
材料与方法
1 一般资料
收集新疆医科大学第一附属医院2015年至2017年活检组织标本(石蜡包埋块),其中CSCC组织46例,高分化12例,中低分化34例、淋巴结转移25例,无淋巴结转移21例,另外收集子宫颈内皮瘤变(cervical intraepithelial neoplasia,CIN)宫颈组织25例、慢性子宫颈炎(chronic cervicitis,CC)组织23例进行对照分析,并收集所用受试者的其他完整资料,进行各项相关病理指标的评价。所有受试者均签署知情同意书,本研究所有项目通过新疆医科大学第一附属医院伦理委员会的审核批准。
2 免疫组织化学染色
采用链霉亲和素‐生物素‐过氧化物酶法(SABC法)[10‐14]进行CXCL2和CXCR2免疫组织化学染色。石蜡切片置于二甲苯溶液中脱蜡,然后用梯度酒精(无水乙醇—95%乙醇—75%乙醇)水化,蒸馏水冲洗,PBS缓冲液冲洗,然后置于EDTA抗原修复液中微波炉加热进行抗原修复,滴加0.3%H2O2溶液室温孵育10 min,封闭内源性过氧化物酶;PBS缓冲液冲洗,滴加封闭用正常山羊血清工作液,室温孵育10 min,倾去血清,滴加兔抗CXCL2和CXCR2一抗(1:600和1:200;北京博奥森技术有限公司),4℃冰箱孵育过夜。第二天室温放置30 min复温,PBS缓冲液冲洗,滴加生物素标记山羊抗兔IgG工作液(北京中杉金桥生物技术有限公司),37℃孵育10 min;PBS缓冲液清洗,滴加辣根酶标记链酶卵白素工作液(北京中杉金桥生物技术有限公司),37℃孵育10 min,PBS缓冲液清洗,滴加DAB工作液(北京中杉金桥生物技术有限公司),显微镜下观察显色程度,及时终止显色,苏木素溶液复染,盐酸酒精分化,碳酸锂溶液返蓝,脱水透明,封片,阅片。
3 免疫组织化学染色结果判断
两位病理学专家按照标准进行显微镜阅片,从阳性肿瘤细胞所占百分数和着色深浅来评分。染色强度评分通过肿瘤细胞与间质细胞的比较来决定:无着色为0分,浅着色或模棱两可为1分,中等着色为2分,强着色为3分;根据阳性肿瘤细胞占所有观察细胞的百分数评分:<10%、10%~49%、50~74%、≥75%分别评为0、1、2、3分。两项评分最后相加,0~1分为阴性,≥2分均为阳性;2分为弱阳性(+),3~4分为中等阳性(++),5~6分为强阳性(+++)。
4 统计学处理
采用SPSS19.0统计软件进行分析,各实验组CXCL2和CXCR2的表达水平的比较用χ2检验,CXCL2和CXCR2在子宫颈鳞状细胞癌组织中表达的相关性分析用Spearman等级相关分析完成,以P<0.05为差异有统计学意义。
结 果
1 CXCL2 和CXCR2在子宫颈鳞状细胞癌组织中高表达
CXCL2 及CXCR2阳性的免疫组织化学染色在光学显微镜下表现为棕黄色颗粒,在细胞膜和细胞质阳性着色(图1)。CXCL2 和CXCR2在CSCC组织中的染色明显强于在CIN宫颈组织和CC组织中的染色(图1)。

图1 CXCL2和 CXCR2在CSCC、CIN和CC组织中表达的免疫组织化学检测。比例尺,100μmFig.1 Immunohistochemical examination of the expression of CXCL2 and CXCR2 in the CSCC, CIN and CC tissues. Scale bar, 100μm
2 CXCL2和CXCR2在子宫颈鳞状细胞癌组织的阳性率增高
在46例CSCC组织中检测到21例呈CXCL2阳性表达,阳性率为 45.7%;在25例CIN组织及23例CC组织中,CXCL2的阳性表达率分别为12%和4%。CXCL2在CSCC组织中的阳性表达率显著高于CIN及CC组织(表1),而在CIN和CC组织中的表达没有显著差异。
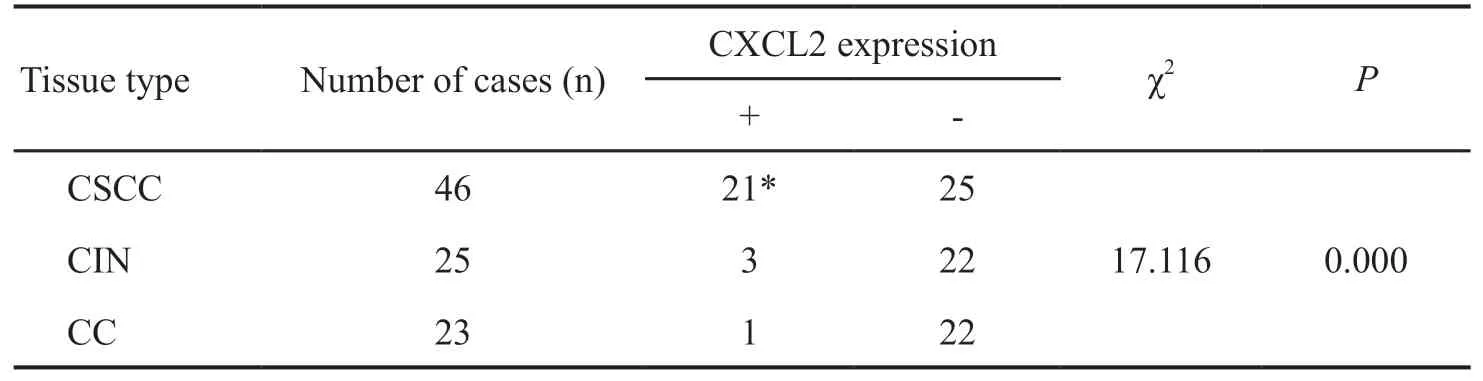
表1 CXCL2在CSCC、CIN和CC组织中的表达Tab.1 The expression of CXCL2 in CSCC, CIN and CC tissues
在46例CSCC组织中检测到17例呈CXCR2阳性表达,阳性率为36.9% , 在24例CIN组织及22例CC组织中,CXCR2阳性表达率分别为12%和9%。CXCR2在CSCC组织中的阳性表达率显著高于CIN及 CSCC组织(表2),但在CIN和CC组织中的阳性率无明显差异。

表2 CXC R2在CSCC、CIN和CC组织中的表达Tab. 2 The expression rate of CXCR2 in CSCC, CIN and CC tissues
3 CXCL2与CXCR2在子宫颈鳞状细胞癌组织的表达无相关性
免疫组织化学染色显示CXCL2在CSCC组织中阴性(-)表达病例25例,弱阳性(+)表达病例5例,中等阳性(++)表达病例4例,强阳性(+++)表达病例12例。CXCR2在CSCC组织中阴性(-)表达病例29例,弱阳性(+)表达病例6例,中等阳性(++)表达病例1例,强阳性(+++)表达病例10例。Spearman等级相关分析显示, CXCL2和CXCR2在CSCC组织中的表达无相关性(rs=0.220,P<0.141)。
讨 论
子宫颈癌是最常见的妇科恶性肿瘤。原位癌高发年龄为30~35岁,浸润癌为45~55岁,近年来其发病有年轻化的趋势。肿瘤的发生发展是一个复杂的过程,在这一进程中很多因素都会影响到肿瘤的发生发展,例如各种炎症反应、精神因素和其他慢性疾病。任何组织的生长都离不开血液的营养供应,因此,血管新生对于肿瘤组织的生长非常重要。趋化因子作为肿瘤浸润转移中重要的信号分子之一,在肿瘤的生物学行为中有两方面相反的作用,一方面是促进肿瘤的生长和转移,趋化因子与相应受体结合后通过一系列复杂的信号传导使肿瘤细胞增值生长,还可以间接促进血管的生成,为肿瘤组织提供丰富的营养供应;另一方面是抑制肿瘤的生长和转移这一作用的产生与促进肿瘤生长和转移相反,除此之外趋化因子还可以引导免疫细胞对肿瘤细胞产生对抗作用[15‐17]。趋化因子分为很多种类,其中CXC超家族与血管新生关系最为密切。根据大量文献的报道和综述的总结,基本可以下定论ELR+CXC 趋化因子促进血管新生关系最为密切[18]。CX‐CL1、CXCL2、CXCL3、CXCL5、CXCL6、CXCL7和CXCL8归属于ELR+CXC类趋化因子。CXCL2也称为GROβ、MIP2‐α、GRO‐2 蛋白,最早在黑色素细胞瘤细胞表面被发现,随后通过一系列研究,发现该因子可以趋化各种炎症细胞参与炎症反应,之后又通过实验显示 CXCL2 在黑色素瘤中表达率非常高,并且阳性率与黑色素细胞瘤的恶性程度成正相关[19]。CXCR1 和 CXCR2可以与多种趋化因子发生特异性结合,但有研究证实只有后者能与上述所有因子结合并产生效应[20]。有研究发现, CXCR2通过抑制AKT1和激活COX2,促进乳腺癌细胞的转移和趋化[21]。
为探讨CXCL2及CXCR2在CSCC组织中的作用,本研究通过免疫组织化学染色法检测92例宫颈病变组织标本,其中包括46例CSCC组织、24例CIN宫颈组织、22例CC组织,发现CXCL2及CXCR2表达从CC到CSCC的发生呈逐渐上升的改变,但CXCL2及CXCR2的表达没有呈现相关性。由此说明CXCL2及CXCR2参与宫颈癌发生、发展进程。有文献报道CXCR2 与ELR +CXC趋化因子结合后通过胞内一系列信号传导作用于酪氨酸激酶受体产生一系列使血管新生的生物学效应[22]。Sanchez等[23]的研究也间接证实了CXCR2在新血管形成过程中的重要作用。本研究结果显示CXCL2/CXCR2在子宫颈鳞状细胞癌中的表达分别高于CIN及CC组织,提示CXCL2、CXCR2的高表达可能与CSCC的发生、发展及转移相关。但未发现CXCL2和CXCR2表达具有相关性,需进一步研究两者之间的关系。在临床应用领域,宫颈涂片和活检组织中CXCL2及其受体CXCR2 表达水平检测可能成为一个全新的子宫颈癌生物标记物,但 CXCL2及其受体CXCR2是否可进一步用于临床作为子宫颈癌诊断或筛查工具仍需进一步通过大样本实验进行证实。

