三氧化二砷通过诱导自噬抑制肝癌细胞增殖和迁移
汪瑞,钱燕,魏伟,汪敏,赵竞
(安庆医药高等专科学校生理教研室,安庆 246052)
据2020年全球最新癌症统计报告,世界范围内肝癌新发病例91万例,死亡83万例,发病率和死亡率分别位居第6位和第3位。我国肝癌的发病率和死亡率均高于欧美国家。2020年我国新发肝癌病例41万,约占全球的一半,死亡病例39万,位居我国癌症死亡的第2位[1]。肝癌患者一经确诊,大多已发展至中晚期,且常伴随有HBV感染及肝硬化,手术难度大且术后复发率较高。As2O3是砒霜的有效成分,在我国传统中医药研究中具有悠久的历史。2000年,FDA批准As2O3用于急性早幼粒细胞白血病的治疗。此后,体内外实验及临床研究均显示,As2O3可诱导肝癌细胞凋亡,抑制肝癌细胞增殖,并可抑制肿瘤的生长[2‐5]。
自噬是一种基本的生命现象,在维持细胞稳态的过程中发挥着至关重要的作用。自噬机制失调与神经退行性疾病、代谢性疾病和肿瘤等复杂性疾病密切相关。近年来的研究表明,自噬不仅对肝癌的发生发展具有双向调节作用,且在肝癌的治疗中亦具有双重作用。一方面,抗癌药物可通过激活细胞自噬,诱导细胞内自噬过量,引起肿瘤细胞发生自噬性死亡。另一方面,自噬可通过对肿瘤细胞内组分的降解和再利用为细胞生存提供必需的物质和能量,使肿瘤细胞获得抗药性,逃避抗癌药物的作用,得以存活[6,7]。有研究表明,As2O3在多种肿瘤细胞中均可通过对细胞自噬的调节影响细胞存活,包括肝癌细胞[8‐10]。本研究建立稳定的慢性 As2O3诱导细胞系,应用平板克隆实验、软琼脂集落形成实验、Transwell 实验、Western blot及免疫荧光实验对肝癌细胞 HepG2和 SMMC7721细胞中细胞自噬相关指标、细胞增殖和迁移能力进行检测分析,以探究自噬在 As2O3影响肝癌细胞增殖、迁移过程中的作用。
材料与方法
1 细胞培养及处理
人肝癌细胞(HepG2和SMMC7721细胞)用含10% 胎牛血清的DMEM 培养基置37℃、5% CO2、饱和湿度的恒温培养箱中培养,每2~3 d传代一次。每次传代,取生长对数期细胞5×105接种于6 cm培养皿中。2 h后,将培养基分别换成含或不含0.1 μmol/L As2O3的DMEM培养基,继续培养。每次传代均重复上述操作。
2 平板克隆实验
取上述处于对数生长期的第20代和40代的HepG2和SMMC7721细胞及其对照细胞,用0.25%胰蛋白酶消化后制成单细胞悬液,以500个细胞的密度均匀接种于6孔板,继续培养 2~3周,期间每隔2 d换一次培养基。出现肉眼可见的克隆时,即终止培养。弃去上清液,用PBS洗2次后,加4%多聚甲醛,15 min后,将多聚甲醛吸出,加入适量GIMSA应用染色液,10~30 min后,流水缓慢洗去染色液,空气干燥,计数克隆数,并拍照。
取对数生长期的0.1 μmol/L As2O3、5 mmol/L 3‐MA单独或联合处理的HepG2和SMMC7721细胞及对照细胞,按同样的实验操作流程检测细胞的克隆形成数目,细胞接种密度为500个/孔。
3 软琼脂集落形成实验
将1.2%的琼脂糖胶与2×DMEM培养基(含20% 胎牛血清)1:1混合均匀,按1.5 mL/孔加入至6孔板中,室温凝固。取上述处于对数生长期的第20代和40代的HepG2和SMMC7721细胞及其对照细胞,分别制备细胞密度为1×105/ mL的单细胞悬液。将0.7%的琼脂糖胶与2×DMEM培养基1:1混合均匀,加入100 μL单细胞悬液,混合均匀后,每孔加入1.5 mL,放入培养箱中继续培养 每隔 3 d补加培养基。2~3周后,计数>50个细胞的克隆,计算集落形成率。倒置显微镜(Olympus公司,TMT2‐21 ECLIPSE TS100)下观察并照相。
4 Transwell实验
取0.1 μmol/LAs2O3慢性诱导处理的第20代和40代处于对数生长期的 HepG2和SMMC7721细胞及其对照细胞,胰酶消化离心后,PBS 洗1~2次, 用无血清培养基重悬至密度为5×105/mL。取Transwell小室放入24孔板内,上室加入细胞悬液100 μL,在下室加600 μL含20%胎牛血清的DMEM 培养基,继续培养细胞 12 h。培养结束后,取出小室,弃孔板内的培养基,无钙PBS洗小室2次,甲醇固定细胞30 min,适当风干小室后加入500 μL 0.1%结晶紫室温染色 2 h,弃上室液,蒸馏水浸泡3次脱色,取出小室,用棉签轻轻擦去小室上层未迁移的细胞后每室加入 200 μL 0.1% SDS放置过夜,吸取下室液,用酶标仪(Thermo公司,Varioskan LUX)在570 nm测OD值。
取对数生长期的HepG2和SMMC7721细胞,按上述相同的实验操作制备细胞悬液并加入至小室中,在接种细胞的上室中分别加入对照溶剂(DM‐SO)、0.1 μmol/L As2O3、5 mmol/L 3‐MA、0.1 μmol/L As2O3+ 5 mmol/L 3‐MA,继续培养 12 h。按上述相同的方法进行细胞固定及结晶紫染色,显微镜(Olym‐pus公司,TMT2‐21 ECLIPSE TS100)下拍照,每组细胞取3~5个视野计数迁移的细胞数目,并取平均值用于统计分析。
5 Western blot检测
分别收集 0.1 μmol/L As2O3孵育不同时间(0 h、6 h、12 h、24 h)的 HepG2和SMMC7721细胞,RIPA蛋白裂解液提取细胞总蛋白,BCA 法测定蛋白浓度。配置12% SDS‐PAGE分离胶和 5%浓缩胶。上样,每孔蛋白总量为 20 μg。电泳(90V,30 min;120V,90 min),半干转(恒流,电流大小为膜面积总和的2.5倍,45 min)。5% 脱脂牛奶室温封闭 1 h后,加入抗β‐actin(Proteintech公司,1:5000)、抗LC3B(Sigma公司,1:1000)和抗p62(Sigma公司,1:1000)一抗工作液,4 ℃ 孵育过夜。PBS洗3次,5 min/次。HRP标记的二抗(Proteintech公司,1:5000)室温孵育1 h,PBS洗3次,5 min/次。ECL显色液(北京康为世纪生物科技有限公司)显色,FluorChem FC3化学发光凝胶成像系统(ProteinSimple公司)成像,Image J软件对蛋白表达进行定量分析,以目的蛋白条带光密度与内参蛋白β‐actin条带光密度比值代表目的蛋白相对水平。
6 细胞免疫荧光
将专用细胞爬片放入24孔板里,可预先在24孔板中滴加少量的培养基使细胞爬片更好地贴附。取上述处于对数生长期的 HepG2和SMMC7721细胞,用0.25% 胰蛋白酶消化后制成单细胞悬液,调整细胞密度为5×104~1×105/ mL,每孔加入1 mL细胞悬液。2 h后,将培养基分别换成含或不含0.1 μmol/L As2O3的DMEM培养基,继续培养 12 h。弃培养基,PBS浸洗2次后加4%多聚甲醛固定15 min,弃多聚甲醛,PBS 浸洗 2 次,0.1% Triton‐100 打孔5 min,PBS 浸洗 2 次,5% BSA室温封闭 1 h,加入 抗LC3B 抗体(Sigma公司,1:1000)4 ℃ 孵育过夜,PBS 浸洗 2 次,Alexa Fluor 549标记的抗小鼠荧光二抗(Sigma公司,1:2000)室温孵育 1 h。1 mg/ml DAPI (北京索莱宝公司)复染细胞核。倒置荧光显微镜(Carl Zeiss公司,Observer A1)观察,拍照。每组照片选取3~5个视野,采用Image J 软件对荧光强度进行定量分析,并取平均值用作后续统计分析。
7 统计学分析
采用SPSS22.0 和 GraphPad Prism 7.0 进行统计分析和绘图,所有数据呈现形式均为平均数±标准差。采用非配对t检验比较两组间的统计学差异。
结 果
1 As2O3 抑制 HepG2 和 SMMC7721 细胞增殖
平板克隆实验分析显示,与对照细胞相比,经0.1 μmol/L As2O3慢性诱导的第20代和第 40代HepG2 细胞形成的克隆数明显减少,在SMMC7721细胞中亦获得相似的结果(图1)。由此表明,0.1 μmol/LAs2O3慢性诱导可显著抑制肝癌细胞增殖。
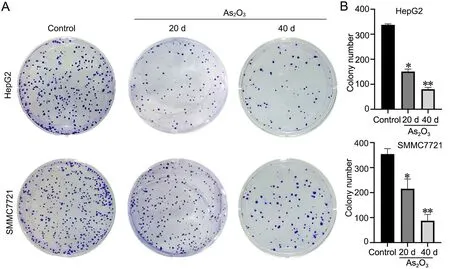
图1 As2O3 (0.1 μmol/L)慢性诱导对肝癌细胞增殖能力影响的平板克隆实验检测。 A,代表性平板克隆实验结果。B,细胞克隆数的统计分析;与对照组相比:*0.01<P<0.05,**P<0.01;n=3Fig.1 Detection of cell proliferation by plate clone formation assay of hepatoma cells. A, representative results of plate clone formation assay; B, statis‐tical analysis of colony numbers in plate clone formation assay; compared with control group: *0.01<P<0.05, **P<0.01; n=3
2 As2O3 降低HepG2 和 SMMC7721 细胞的克隆形成能力
软琼脂集落形成实验显示:与对照组相比,0.1 μmol/L As2O3处理的 HepG2 和 SMMC7721 细胞的克隆形成率均明显降低,且细胞的克隆形成能力与As2O3慢性诱导的时间呈负相关:随着诱导时间的增加,细胞克隆形成能力越弱(图2),表明0.1 μmol/L As2O3慢性诱导可显著抑制肝癌细胞的克隆形成能力。

图2 As2O3慢性诱导对肝癌细胞克隆能力影响的软琼脂集落形成实验检测。A,代表性软琼脂集落形成实验结果;比例尺,100 μm。B,细胞克隆形成率统计分析;与对照组相比:*0.01<P<0.05,**P<0.01;n=3Fig.2 Assay of soft agar colony formation of hepatoma cells. A, representative results of soft agar colony formation assay; scale bar, 100 μm; B, statis‐tical analysis of colony formation rate in soft agar colony formation assay; compared with control group: *0.01<P<0.05, **P<0.01; n=3
3 As2O3 抑制HepG2和SMMC7721细胞的迁移能力
Transwell迁移实验分析显示:经 0.1 μmol/L As2O3慢性诱导的 HepG2 和 SMMC7721 细胞穿过膜的细胞均明显少于对照组,As2O3慢性诱导的时间越长,穿过的细胞越少(图3),表明As2O3慢性诱导可显著抑制肝癌细胞的迁移。

图3 Transwell实验检测As2O3慢性诱导对肝癌细胞迁移的影响。A,代表性Transwell实验结果;比例尺,100 μm。B,细胞迁移能力统计学分析;与对照组相比:*0.01<P<0.05,**P<0.01;n=3Fig. 3 Detection of cell migration of hepatoma cells by transwell migration experiment. A, representative results of transwell migration experiment;scale bar, 100 μm; B, statistical analysis of cell migration numbers; compared with control group: *0.01<P<0.05, **P<0.01; n=3
4 As2O3 上调自噬相关蛋白 LC3B-Ⅱ 和 p62水平
Western blot 检测显示,0.1 μmol/L As2O3处理显著上调肝癌细胞 HepG2 和 SMMC7721 细胞中自噬相关蛋白 p62 和 LC3B‐Ⅱ的表达水平,且LC3B‐Ⅱ与LC3B‐I的比值显著增大,并具有时间依赖性(图4)。免疫荧光染色检测显示,与对照细胞相比,0.1 μmol/L As2O3处理的细胞中LC3B免疫反应性明显增强(图 5),提示As2O3可增强肝癌细胞自噬。
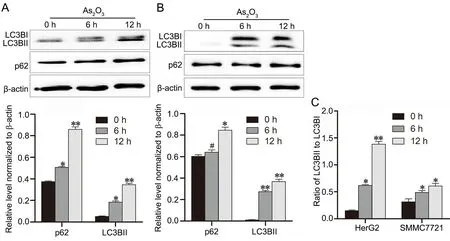
图4 As2O3 对肝癌细胞中 LC3B 和 p62水平的影响。A,HepG2 细胞中LC3BII 和 p62水平代表性Western blot检测结果与统计学分析;B,SMMC7721 细胞中LC3BII和 p62水平代表性Western blot检测结果与统计学分析;C,LC3BII和LC3BI水平比值统计学分析;与对照组相比:*0.01<P<0.05,**P<0.01,#P>0.05;n=3Fig.4 Effect of As2O3 on the level of LC3B and p62 in hepatoma cells. A, representative Western blot results and statistical analysis of the level of LC3B and p62 in HepG2 cells treated with As2O3; B, representative Western blot results and statistical analysis of the level of LC3B and p62 in the SMMC7721 cells treated with As2O3; C, statistical analysis of the LC3BII to LC3BI ratio; compared with control group: *0.01<P<0.05, **P<0.01, #P>0.05; n=3
5 3-MA逆转As2O3 所致的肝癌细胞生物学行为改变
与上述结果一致,0.1 μmol/L As2O3处理后HepG2和SMMC7721细胞的克隆形成数量及穿过膜的细胞数目均明显少于对照组;与As2O3单独处理的细胞相比,As2O3与3‐MA联合处理的细胞的克隆形成数量及穿过膜的细胞数目均有所增加,且在SMMC7721细胞中,单独自噬抑制剂3‐MA 处理明显增加细胞克隆数目,而在HepG2细胞中并未观察到该现象(图6)。以上结果表明自噬抑制剂3‐MA处理可逆转As2O3对肝癌细胞增殖和迁移的抑制作用。

图 5 免疫荧光检测As2O3 处理对肝癌细胞 LC3B 表达的影响。A,代表性免疫荧光检测结果;比例尺,50 μm。B,LC3B免疫反应性(荧光强度)统计分析;与对照组相比,***P<0.001; n=3。Fig.5 Immunofluorescence examination for the effect of As2O3 on the expression of LC3B in hepatoma cells. A, representative immunofluorescent stain‐ing results; scale bar, 50 μm; B, statistical analysis of LC3B immunoreactivity (fluorescent intensity); compared with control group, ***P<0.001; n=3

图6 自噬抑制剂3‐MA对As2O3抑制肝癌细胞增殖和迁移的影响。A,细胞增殖的代表性平板克隆实验检测;B,细胞克隆数的统计分析;C,细胞迁移的代表性Transwell分析检测;D,细胞迁移数目统计分析;比例尺,50 μm;与对照组相比:**0.001<P< 0.01,***P<0.001;与As2O3 组相比,#0.01<P<0.05;n=3Fig.6 Effect of autophagy inhibitor 3‐MA on the As2O3‐induced repression of cell proliferation and migration. A, representative colony formation assay results; B, statistical analysis of colony numbers; C, representative transwell assay results; D, statistical analysis of cell migration numbers; scale bar, 50 μm; compared with control group: **0.001<P<0.01, ***P<0.001; compared with As2O3 group, #0.01<P<0.05; n=3
讨 论
研究表明,As2O3可通过自噬、氧化应激和调节miRNA表达等多种机制抑制肝癌细胞增殖,诱导细胞凋亡,抑制肝细胞癌的生长[5,8,11,12]。本研究在As2O3慢性诱导的肝癌细胞中检测了其对肝癌细胞恶性生物学行为的影响。研究发现,经As2O3慢性诱导的 HepG2和SMMC7721细胞的增殖受抑、克隆形成率降低、细胞迁移能力明显减弱,表明As2O3可抑制肝癌细胞的恶性生物学行为。
自噬参与肝细胞癌的发生、转移、靶向治疗和药物抵抗[6],在肝癌的研究中有着举足轻重的地位。研究显示,As2O3在人骨肉瘤细胞、人头颈鳞癌细胞、人肝细胞、小鼠睾丸间质细胞瘤细胞和巨噬细胞等多种类型的细胞中均可调节细胞自噬[9,13‐16]。 本实验在HepG2和SMMC7721细胞中检测了As2O3处理对细胞自噬相关蛋白LC3B和p62表达的影响。结果发现,经 As2O3处理的两种细胞中自噬小体形成金标准 LC3B‐II与LC3B‐I 比值明显高于未经As2O3处理的对照组细胞,且随着As2O3处理时间的增加,这种差异更加显著。p62是一种分子量为 62 kD的多功能蛋白,是第一个被发现可调节选择性自噬的受体蛋白[17]。在自噬过程中,自噬连接蛋白p62可同时与底物及LC3‐II结合,包裹入自噬体中,并在随后与溶酶体融合形成自噬溶酶体。p62 在溶酶体中被蛋白水解酶降解。故此,p62 蛋白水平通常被认为与自噬活性负相关。然而,在我们的研究中发现,As2O3显著上调肝癌细胞中p62的表达。这可能是由于p62作为一种应激蛋白在细胞应对As2O3的毒性刺激时,As2O3诱使p62的转录活性显著增强,从而产生了大量的p62蛋白,虽然自噬增强消耗了部分蛋白,但细胞内仍有部分p62蛋白堆积。这在实际检测中是一种常见现象,也与Gao等[13]和Liang等[15]的研究结果相符。以上结果表明,As2O3诱导肝癌细胞自噬增加。
为探究As2O3所致的肝癌细胞自噬增加在其诱导细胞增殖、迁移改变中的作用,我们通过3‐MA阻断细胞自噬,在体外实验中检测了3‐MA 对As2O3抑制HepG2和SMMC7721细胞增殖、迁移的影响。3‐MA是一种广泛用于自噬相关研究的自噬阻断剂,可在自噬发生早期阻断自噬体的形成[18]。结果发现,3‐MA可阻碍As2O3对HepG2和 SMMC7721细胞增殖、迁移的抑制作用。这一结果表明As2O3所致的肝癌细胞自噬增加在其抑制细胞增殖、迁移的过程中发挥正向调节作用,As2O3所致自噬增加可能进一步诱导肝癌细胞的自噬性凋亡。
综述所述,As2O3在体外可抑制人肝癌细胞增殖、克隆形成和迁移,并可上调肝癌细胞的自噬水平。自噬水平升高是As2O3抑制肝癌细胞增殖、迁移的可能机制。

