重组鸡CD40L对ND LaSota疫苗免疫效果的影响
刘佳宇 , 温慧之 , 范阔海 , 尹 伟 , 孙耀贵 , 孙盼盼 , 李宏全
(1. 山西农业大学动物医学学院 , 山西 太谷 030801 ; 2. 山西农业大学实验动物管理中心 , 山西 太谷 030801)
CD40L是肿瘤坏死因子受体超家族(Tumor necrosis factor receptor superfamily,TNFRSF)[1]的成员。在体内,CD40L和CD40构成共刺激分子,为抗原呈递细胞、B细胞及T细胞的活化提供第2信号,启动细胞免疫和体液免疫,是特异性免疫应答激活的重要条件[2-3]。研究表明,将CD40L基因与抗原基因串联构建共表达载体,制备DNA疫苗或表达为融合蛋白接种到宿主体内,能够增强抗原的免疫原性[4-5]。另外,重组CD40L与疫苗联合使用也能增强疫苗的免疫效果[6-7]。鉴于此,本试验构建毕赤酵母(Pichiapastoris)表达体系,体外表达重组鸡CD40L,将重组鸡CD40L与新城疫LaSota疫苗联合免疫7日龄SPF鸡,评价重组鸡CD40L与鸡新城疫LaSota疫苗联合免疫的效果。
1 材料与方法
1.1 试验动物、菌株及质粒 7日龄SPF鸡,购自北京生泰尔生物科技有限公司。毕赤酵母(Pichiapastoris)X-33菌株和穿梭质粒pwPICZalpha由本实验室保存。
1.2 主要试剂及仪器 Ni SepharoseTM6 Fast Flow,购自美国GE公司;阳离子交换树脂(Poros 50 HS),购自美国Applied Biosystems公司;新城疫LaSota灭活疫苗和4% 605佐剂,均购自北京生泰尔生物科技有限公司;总超氧化物歧化酶(T-SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒和丙二醇(MDA)测定试剂盒,均购自南京建成生物工程研究所。基因导入仪(SCIENTZ-2C型,宁波新芝生物科技有限公司);层析柱(XK-16型,美国GE公司)。
1.3 试验方法
1.3.1 重组鸡CD40L的表达纯化 根据NCBI登录的鸡CD40L基因序列(Gene ID:395485)和毕赤酵母(Pichiapastoris)的密码子偏好性,将鸡CD40L基因进行优化后合成。合成的鸡CD40L基因序列与穿梭质粒pwPICZalpha连接,利用电转化的方法导入毕赤酵母X33。通过Zeocin抗性筛选阳性菌株,将筛选到的阳性菌株经甲醇诱导表达后收集上清,Ni-NTA Resin柱和强阳离子层析柱(HE)对表达产物进行纯化,BCA法测定重组鸡CD40L蛋白浓度。
1.3.2 分组与处理 将40羽7日龄SPF鸡随机分为3个试验组和空白对照组(空白组),每组10羽。第1组:1.0 μg/羽CD40L+LaSota灭活疫苗+605佐剂;第2组:0.1 μg/羽CD40L+LaSota灭活疫苗+605佐剂;第3组:LaSota灭活疫苗+605佐剂;空白对照组不做处理。试验组颈部皮下注射疫苗。
1.3.3 样品采集和指标的测定 免疫后14、21、28 d和35 d,采集翅下静脉血,分离血清,通过血凝血抑试验(HA-HI)检测鸡新城疫抗体效价,使用试剂盒检测血清中总超氧化物歧化酶(SOD)活性、血清谷胱甘肽过氧化物酶(GSH-Px)活性和血清丙二醛(MDA)含量,具体步骤按照说明书进行操作。
1.4 统计学分析 使用GraphPad Prism 5软件对试验数据进行单因素方差分析(One-way ANOVA),结果均用平均数±标准误(Mean±SEM)表示。
2 结果
2.1 重组鸡CD40L的表达和纯化结果鉴定 毕赤酵母表达上清经Ni-NTA Resin柱和HE纯化后,获得了纯度为90%的重组鸡CD40L,浓度为0.315 mg/mL。
2.2 新城疫抗体效价检测 免疫后14、21、28 d和35 d,3个试验组的抗体效价均显著高于空白组(P<0.05),试验组之间无显著差异(P>0.05)(图1)。结果表明,在本试验所用剂量下,重组鸡CD40L不能增加新城疫LaSota疫苗诱导产生的抗体水平。
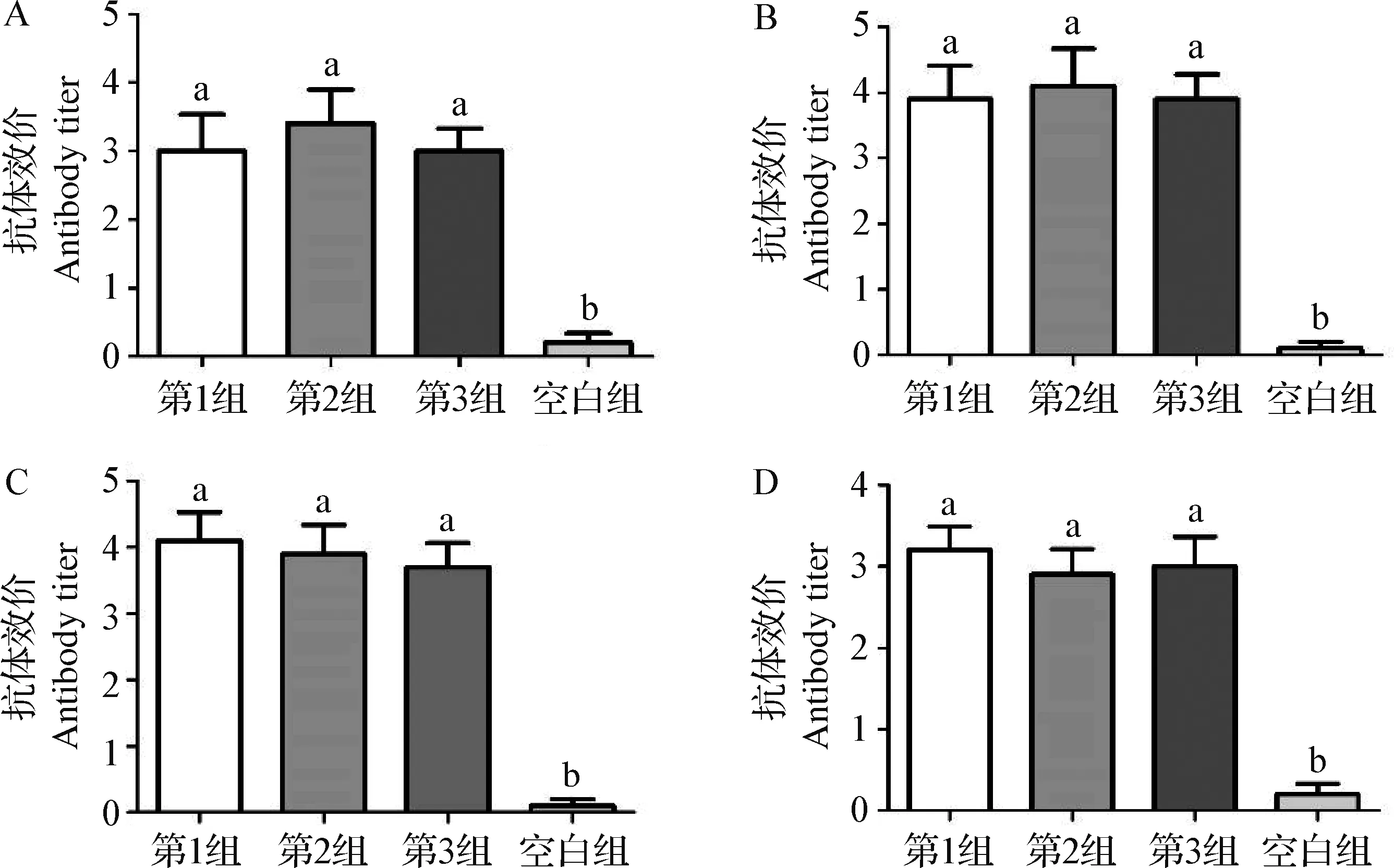
图1 不同时间点CD40L对各组抗体效价的影响Fig.1 Effect of CD40L at different time points on the antibody titer of each groupA:免疫后14 d抗体效价; B:免疫后21 d抗体效价; C:免疫后28 d抗体效价; D:免疫后35 d抗体效价不同字母表示差异显著(P<0.05);下同A:Antibody titer after 14 d of immunization; B:Antibody titer after 21 d of immunization; C:Antibody titer after 28 d of immunization; D:Antibody titer after 35 d of immunizationDifferent letters indicate significant differences (P < 0.05). The same as below
2.3 血清SOD测定 免疫后14 d(图2A),各组血清SOD活力组间差异不显著(P>0.05)。免疫后21 d(图2B),第3组SOD的活力显著高于空白组(P<0.05),第1组、第2组和空白组的SOD活力差异均不显著(P>0.05)。免疫后28 d和35 d,所有组之间SOD活力差异均不显著(P>0.05)(图2C、2D)。结果表明,在本试验所用剂量下,重组鸡CD40L提高了鸡机体内SOD活力。

图2 不同时间点CD40L对血清SOD活力的影响Fig.2 Effect of CD40L on serum SOD activity at different time pointsA:免疫后14 d SOD活力变化; B:免疫后21 d SOD活力变化; C:免疫后28 d SOD活力变化;D:免疫后35 d SOD活力变化A:Changes of SOD activity after 14 d of immunization; B:Changes of SOD activity after 21 d of immunization;C:Changes of SOD activity after 28 d of immunization; D:Changes of SOD activity after 35 d of immunization
2.4 血清GSH-Px测定 免疫后14 d(图3A),第3组和第1组GSH-Px活力均显著高于第2组和空白组(P<0.05),第3组显著高于第1组(P<0.05),第2组和空白组差异不显著(P>0.05)。免疫后21 d和28 d(图3B、3C),第1组与第3组差异不显著(P>0.05),第2组和空白组差异不显著(P>0.05),第1组和第3组GSH-Px活力均显著高于第2组和空白组(P<0.05)。在免疫后35 d(图3D),第1组和空白组GSH-Px活力均显著高于第2组和第3组(P<0.05),第1组和空白组差异不显著(P>0.05),第2组和第3组差异不显著(P>0.05)。结果表明,在1.0 μg/羽使用剂量下,重组鸡CD40L能够提高鸡机体内的GSH-Px活力。

图3 不同时间点CD40L对血清GSH-Px含量的影响Fig.3 Effect of CD40L on serum GSH-Px content at different time pointsA:免疫后14 d GSH-Px活力变化; B:免疫后21 d GSH-Px活力变化; C:免疫后28 d GSH-Px活力变化;D:免疫后35 d GSH-Px活力变化A:Changes of GSH-Px activity after 14 d of immunization; B:Changes of GSH-Px activity after 21 d of immunization;C:Changes of GSH-Px activity after 28 d of immunization; D:Changes of GSH-Px activity after 35 d of immunization
2.5 血清MDA测定 免疫后14 d(图4A),第1组MDA含量显著高于第2组和第3组(P<0.05),空白组MDA含量显著高于第2组(P<0.05),第1组和空白组差异不显著(P>0.05),第2组和第3组差异不显著(P>0.05)。免疫后21 d(图4B),试验组和空白组间差异不显著(P>0.05)。免疫后28 d和35 d(图4C、4D),在第1组与空白组具有显著性差异(P<0.05),其余试验组间差异不显著(P>0.05)。结果表明,在1.0 μg/羽使用剂量下,重组鸡CD40L能够降低鸡机体内MDA含量。
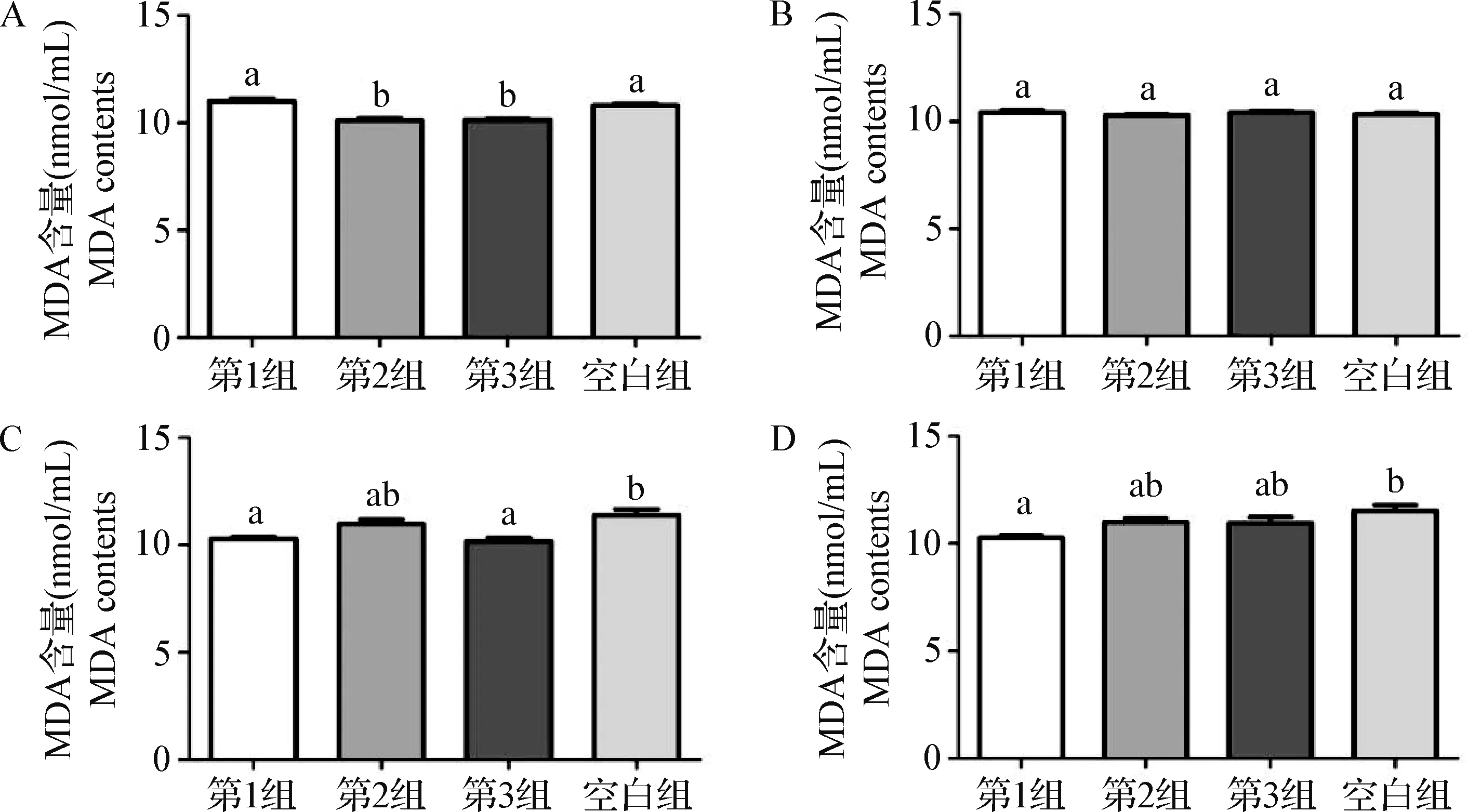
图4 不同时间点CD40L对血清MDA含量的影响Fig.4 Effect of CD40L on serum MDA content at different time pointsA:免疫后14 d MDA含量变化; B:免疫后21 d MDA含量变化; C:免疫后28 d MDA含量变化; D:免疫后35 d MDA含量变化A:Changes of MDA content after 14 d of immunization; B:Changes of MDA content after 21 d of immunization;C:Changes of MDA content after 28 d of immunization; D:Changes of MDA content after 35 d of immunization
3 讨论
研究表明,CD40L与疫苗有协同作用,可以增强疫苗的免疫效果。潘悦[8]将重组CD40L作为免疫增效剂与河豚毒素人工抗原一起接种小鼠,发现使用10 μg/只 CD40L具有显著免疫增强效果。本试验运用毕赤酵母表达系统,在体外表达获得重组鸡CD40L。将1 μg/羽和0.1 μg/羽的重组鸡CD40L分别与新城疫LaSota疫苗联合免疫后,重组鸡CD40L对疫苗诱导产生抗体的作用无明显增强作用。
自由基是细胞代谢产物,通常由活性氧和活性氮组成[9],自由基与抗氧化分子之间存在氧化还原平衡,当平衡受到干扰就会导致氧化应激损伤细胞和组织[10-11]。自由基与机体的健康状况息息相关[12-14],在体内许多生理过程中起重要的作用,包括免疫调节、细胞因子调节、神经调节和凋亡[15-16]。自由基的强弱显著影响着机体免疫力的强弱。Kitas等[17]将鼠的B细胞与单核细胞或H2O2共孵育,发现无论H2O2还是单核细胞产生的自由基,对于B细胞的克隆形成、克隆反应性都有抑制作用。郭亚娇[18]的研究表明,当哮喘模型小鼠体内自由基减少,小鼠体内的炎症会得到缓解,并且机体免疫力也会提高。潘朝旺等[19]的研究表明,氧自由基过多会导致患关节炎大鼠免疫功能紊乱,加剧局部炎症反应。SOD和GSH-Px属于抗氧化物酶,在体内具有清除自由基的作用,构成机体的抗氧化防御系统[20],而MDA含量代表膜脂过氧化程度,间接反映组织细胞中自由基水平。本试验中,1.0 μg/羽的重组鸡CD40L与新城疫LaSota疫苗联合免疫后,重组鸡CD40L虽然不能提高鸡机体内的SOD活性,但能够提高鸡机体内的GSH-Px活性,并降低鸡机体内的MDA含量。
综上所述,本试验通过毕赤酵母表达系统成功获得了重组鸡CD40L,在所设剂量(1.0 μg/羽和0.1 μg/羽)下,重组鸡CD40L对疫苗无明显的免疫增效作用,但能够增强鸡机体的抗氧化能力。

