生长分化因子-15在白细胞介素-1β诱导软骨细胞凋亡与炎症中的作用及潜在机制
梁小弟,梁小菊,李芙蓉,石茂才
(1.定西市人民医院骨科,甘肃 定西 743000;2.西安交通大学附属红会医院小儿骨科,陕西 西安 710054;3.定西市人民医院麻醉科,甘肃 定西 743000)
骨性关节炎(Osteoarthritis,OA)是一种以年龄为主要诱因的退行性疾病,病理特点以关节软骨的退变为主,同时滑膜和软骨下骨发生病变[1-3]。近年来人们发现骨性关节炎也是一种炎症性疾病[4-5]。许多炎症因子在疾病进展中发挥着重要作用,其中白介素-1β(Interleukin-1β,IL-1β)促进产生和释放多种炎症介质和代谢因子,如一氧化氮合酶(iNOS)、环氧化酶2(COX-2)、前列腺素E2(PGE2)、肿瘤坏死因子-α(TNF-α),进而影响软骨细胞功能。因此,抑制IL-1β及其诱导的炎症反应可能是有效治疗OA的策略[6-7]。生长分化因子-15(Growth differentiation factor-15,GDF-15)是转化生长因子β(Transforming growth factor-β,TGF-β)超家族中的应激反应成员之一,已被证实参与细胞凋亡、炎症反应及分化等各种生物学进程[8]。研究[9]发现类风湿关节炎患者血清中GDF-15水平可以作为侵蚀破坏的潜在标志。另外,GDF-15可以作为脊椎关节炎的鉴别标志物[10]。有研究[11]发现GDF-15在骨关节炎患者软骨中的表达水平低于正常软骨,然而GDF-15在OA发展中的具体作用仍是未知的。本研究探讨GDF-15对IL-1β诱导的人膝骨性关节炎软骨细胞凋亡和炎症反应的影响,以期为膝骨性关节炎的治疗提供一定的理论依据。
1 材料与方法
1.1 细胞培养 正常人膝关节软骨细胞(Knee normal human articular chondrocytes,NHAC-kn)(CC-2550;美国LONZA公司)培养于含10%胎牛血清的DEME培养基中,置于含5% CO2培养箱中培养,培养箱温度为37 ℃。
1.2 细胞活性检测 NHAC-kn细胞接种于96孔板,密度为5×103细胞/孔。待细胞长至80%融合后,采用不同浓度的IL-1β(HEILP-0102;赛业生物)(1、5、10、15 ng/ml)处理软骨细胞24 h,参照CCK-8试剂盒(南京凯基生物科技公司)说明书对细胞活性进行检测。
1.3 细胞转染 采用转染试剂盒Lipofectamine 2000将GDF-15过表达质粒(pcDNA3.1-GDF-15;GDF-15)和空载体质粒(pcDNA3.1-NC;Vector)分别转染到NHAC-kn细胞。24 h后,收集转染的NHAC-kn细胞进行下一步实验。GDF-15过表达质粒构建于武汉转导生物实验室。
1.4 定量逆转录-聚合酶链反应(RT-PCR)检测 使用上述的TRIzol试剂从软骨细胞中提取总RNA。使用RNA逆转录试剂盒和cDNA合成试剂盒合成cDNA。RT-PCR采用qPCR定量试剂盒在ABI 7500 Real-time PCR仪上进行。GAPDH作为内参基因。采用2-△△CT法计算基因的相对表达量。
1.5 Western blot检测 利用RIPA缓冲液提取总蛋白,然后使用BCA(美国Thermo Scientific公司)对蛋白进行定量检测。取40 ng蛋白于10% SDS-PAGE凝胶电泳上进行分离后转移至PVDF膜上。在室温下用5%脱脂奶粉封闭3 h后,用iNOS、COX-2、磷酸化蛋白激酶B(p-AKT)、蛋白激酶B(AKT)和p-p65、p65、NADPH的一抗4 ℃孵育过夜。随后,在室温下用HRP结合的二抗(南京钟鼎生物公司)和ECL检测系统进行检测。
1.6 ELISA检测 处理或未处理的软骨细胞均匀接种于24孔板,密度为1×105细胞/孔,37 ℃条件下培养24 h。分别使用半胱氨酸-天冬氨酸蛋白酶-3(Caspase-3)活性测定试剂盒及NO、PGE2、IL-6和TNF-α ELISA试剂盒对相关指标进行检测。
1.7 流式细胞术检测 处理或未处理的软骨细胞均匀接种于24孔板,密度为1×105细胞/孔,37 ℃条件下培养24 h。使用Annexin V-FITC/PI双染试剂盒检测各组细胞的凋亡情况。

2 结 果
2.1 IL-1β对GDF-15 mRNA表达水平和NHAC-kn细胞活性的影响 不同浓度IL-1β(1、5、10、15 ng/ml)处理NHAC-kn细胞24 h以模拟OA的细胞模型。结果发现,与对照组(未处理)相比,IL-1β处理软骨细胞后GDF-15 mRNA表达水平显著下调(P<0.05),且IL-1β浓度越高,GDF-15 mRNA表达水平越低,见图1A。另外,IL-1β处理软骨细胞后,细胞活性显著下降(P<0.05),见图1B。

注:与对照组(Control)比较,*P<0.05
2.2 GDF-15过表达对IL-1β诱导的NHAC-kn细胞凋亡率和Caspase-3活性的影响 为了探究GDF-15在IL-1β处理的软骨细胞中的作用,我们将GDF-15过表达质粒和空载质粒分别转染至NHAC-kn细胞。将NHAC-kn细胞分为未处理组、IL-1β组(10 ng/ml)、IL-1β(10 ng/ml)+Vector(pcDNA3.1-NC)组、IL-1β(10 ng/ml)+GDF-15(pcDNA3.1-GDF-15)组,培养24 h。结果显示,与IL-1β+Vector组相比,IL-1β+GDF-15组GDF-15 mRNA表达水平显著升高(P<0.05),见图2A。另外,IL-1β处理显著提高了软骨细胞凋亡率和Caspase-3活性,而GDF-15过表达缓解了IL-1β诱导的细胞凋亡和Caspase-3活性升高(均P<0.05),见图2B、C。
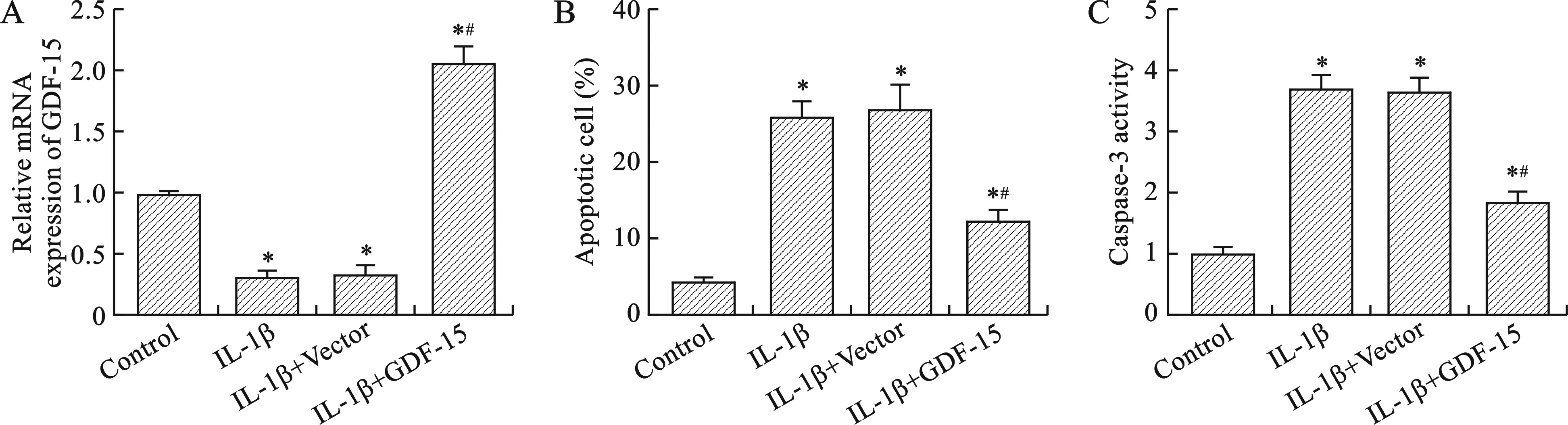
注:与对照组(Control)比较,*P<0.05;与IL-1β+Vector组比较,#P<0.05
2.3 GDF-15过表达对NHAC-kn细胞NO、PGE2以及i-NOS和COX-2蛋白的影响 将NHAC-kn细胞分为未处理组、IL-1β组(10 ng/ml)、IL-1β(10 ng/ml)+Vector(pcDNA3.1-NC)组、IL-1β(10 ng/ml)+GDF-15(pcDNA3.1-GDF-15),培养24 h。ELISA实验结果显示,与IL-1β+Vector组相比,IL-1β+GDF-15组细胞培养液中NO和PGE2含量均显著降低(均P<0.05),见图3A、B。同样,过表达GDF-15抑制了IL-1β诱导的软骨细胞中iNOS和COX-2蛋白表达的上调(P<0.05),见图3C、D。

注:与对照组(Control)比较,*P<0.05;与IL-1β+Vector组比较,#P<0.05
2.4 GDF-15过表达对NHAC-kn细胞中及上清液中IL-6和TNF-α的影响 见图4。IL-1β处理后显著提高了软骨细胞中IL-6和TNF-α转录水平以及上清液中IL-6和TNF-α含量,而过表达GDF-15缓解了由IL-1β引起的细胞促炎因子水平上调(均P<0.05)。
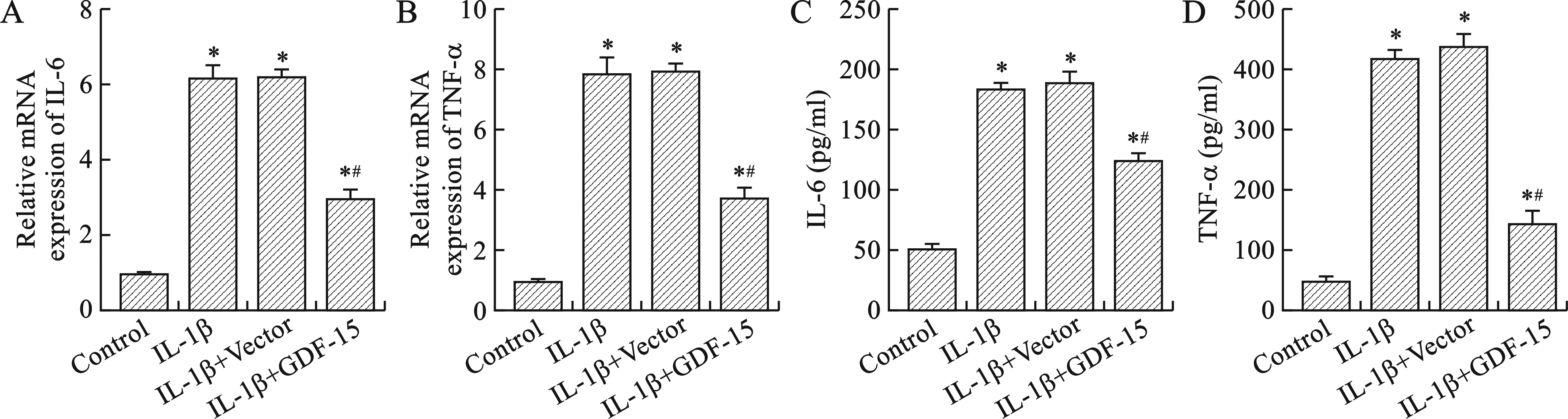
注:与对照组(Control)比较,*P<0.05;与IL-1β+Vector组比较,#P<0.05
2.5 GDF-15过表达通过PI3K/AKT/NF-κB通路抑制IL-1β诱导的软骨细胞凋亡和炎症反应 Western blot结果显示,IL-1β抑制AKT磷酸化水平,促进p65磷酸化,而过表达GDF-15逆转这种影响(P<0.05),见图5A-C。随后,我们检测了PI3K/AKT/NF-κB信号通路和GDF-15在IL-1β诱导细胞损伤中的关系,结果显示MK-2206(PI3K/AKT信号通路特异性抑制剂)显著抑制了GDF-15过表达对IL-1β诱导细胞凋亡和炎症反应的保护作用(P<0.05),见图5D-F。

注:与IL-1β+Vector组比较,*P<0.05;与IL-1β+GDF-15组比较,#P<0.05
3 讨 论
软骨细胞是软骨中唯一的细胞类型,一旦细胞凋亡被触发,软骨细胞很少能恢复[12]。软骨细胞凋亡是OA发生、发展的重要机制。研究[13]表明,GDF-15具有抗凋亡作用。Heger等[14]研究发现,GDF-15在心力衰竭发展过程中被诱导,以减少心室心肌细胞凋亡,促进肥厚性生长。另外,血清中GDF-15的增加降低了口腔鳞状细胞癌细胞系中Caspase-3、7的活性。本研究探究了GDF-15在IL-1β诱导的软骨细胞损伤中的作用和机制,发现IL-1β诱导的软骨细胞可显著下调GDF-15转录水平,而GDF-15过表达明显抑制IL-1β的促凋亡作用,减少IL-1β诱导的Caspase-3活性。这些结果在一定程度上说明GDF-15可以通过抑制凋亡来减弱IL-1β造成的软骨损伤。
已有研究表明,炎症细胞因子参与了OA的病理进展。作为一个关键炎症因子,IL-1β被广泛用于模拟OA微环境的体外研究[15]。本研究发现IL-1β刺激软骨细胞增加了软骨细胞上清液中NO和PGE2含量以及软骨细胞中iNOS和COX-2表达,说明IL-1β可以在体外模拟OA微环境。作为一氧化氮合酶(NOS)家族中的一员,iNOS能够合成炎症介质NO。同样,COX-2作为OA疼痛和炎症的重要介质,可以产生另一种炎症介质——PGE2[16]。研究[17]发现,在大多数OA患者中,NO和PGE2水平明显升高,抑制其表达可以显著延缓OA的病理过程。研究[18]表明,在急性肺损伤的小鼠中,过表达GDF-15可以抑制肝组织和血清中IL-6和TNF-α的含量以及iNOS的表达。本研究中,GDF-15过表达显著抑制了IL-1β诱导的NO和PGE2含量及iNOS和COX-2蛋白表达,以及细胞炎症因子IL-6和TNF-α表达水平,说明GDF-15可以通过减轻炎症对OA起到治疗作用。
研究[19]证明,IL-1β的促炎和促凋亡作用是由于激活了多个信号通路,包括p38、JNK、Wnt/β-catenin及NF-κB等,其中最重要的是NF-κB信号通路。已有文献表明,NF-κB信号通路在OA中被激活,且在OA的发病机制中扮演着至关重要的角色。NF-κB信号通路的激活会诱发一些炎症介质如NO、COX-2趋化因子的表达。因此,NF-κB信号通路被认为是治疗OA的一个潜在的治疗靶标[20]。实际上,在OA的动物和细胞模型中已经证明一些NF-κB药理抑制剂具有保护特性[21]。PI3K/AKT信号是NF-κB信号通路上游的一个主要元素,通过抑制其活动,NF-κB磷酸化可以明显减少[22]。还有研究[18,23]发现,GDF-15可激活PI3K/AKT信号通路,抑制NF-κB活性。本研究发现,过表达GDF-15促进IL-1β诱导的AKT磷酸化且抑制软骨细胞凋亡以及炎症因子、p-p65表达。另外,MK-2206(PI3K/AKT信号通路的特异性抑制剂)减少了过表达GDF-15在IL-1β诱导的软骨细胞损伤中的修复作用。这些结果均表明GDF-15可能通过激活PI3K/AKT/NF-κB信号通路,进而缓解IL-1β诱导的软骨细胞凋亡和炎症反应。
综上所述,GDF-15作用于PI3K/AKT/NF-κB信号通路,可抑制IL-1β诱导的软骨细胞凋亡和炎症反应,减少OA软骨损伤。因此,GDF-15可能是治疗OA的重要靶标。

