ADAMTS5基因在口腔鳞状细胞癌中的表达及其临床意义
张丽慧,郑建云,翟莎菲,张耀超
(1西安医学院口腔医学系口腔组织病理教研室,西安 710075;2西安医学院第一附属医院病理科;*通讯作者,E-mail:zhanglihui222@163.com)
口腔癌是头颈部较常见的恶性肿瘤,大约占恶性肿瘤的7%,每年呈递增趋势,已经成为公共卫生领域的重大问题。口腔癌中约90%为鳞状细胞癌,而口腔鳞状细胞癌的总体生存率却在50%左右[1,2],口腔鳞状细胞癌患者术后原发灶复发及局部淋巴结转移是其预后差及生存率低的主要原因[3,4],所以进一步研究口腔鳞状细胞癌的发生发展机制,寻找口腔鳞状细胞癌发生发展的关键靶点,对提高口腔鳞状细胞癌早期诊断及开发新的治疗方法具有重要意义。含凝血酶敏感素基序的去整合素金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs,ADAMTS)广泛存在于哺乳动物和无脊椎动物中,属于Zn2+依赖的金属蛋白酶家族,该家族中已有19个成员被发现,都是蛋白水解酶,并且蛋白水解功能可能与肿瘤的发生、发展、转移有关[5]。根据目前国内外的研究显示,ADAMTS5的异常表达参与了包括肿瘤在内的多种疾病的发生发展过程[6]。但其在口腔鳞状细胞癌中的表达、生物学功能和临床意义鲜见报道。本研究拟检测ADAMTS5蛋白在口腔鳞状细胞癌中的表达情况,并结合病例资料,初步探讨ADAMTS5在口腔鳞状细胞癌发生发展中的作用,为辅助临床上口腔鳞状细胞癌的早期诊断提供实验依据,以期寻找新的潜在口腔鳞状细胞癌诊断及判断预后的分子标志物。
1 材料和方法
1.1 材料
收集西安医学院第一附属医院2017年6月至2019年6月间的50例口腔鳞状细胞癌手术患者的标本及相应的癌旁正常组织标本,所有标本均经过HE染色病理证实。其中男性35例,女性15例,年龄<50岁的16例,≥50岁34例;发生在舌部的27例,颊部的14例,其他部位9例;肿瘤直径<4 cm的32例,≥4 cm的18例;高分化22例,中分化20例,低分化8例;淋巴结转移13例,无淋巴结转移37例。
1.2 方法
1.2.1 主要试剂 兔抗人ADAMTS5多克隆抗体(北京博奥森生物技术有限公司);免疫组化试剂盒(北京中杉金桥生物技术开发公司);EDTA修复液(北京博奥森生物技术有限公司);DAB显色液(北京中杉金桥生物技术开发公司)。
1.2.2 免疫组织化学染色 石蜡标本常规连续切片,常规二甲苯脱蜡、水化后,3%过氧化氢灭活内源性过氧化物酶,EDTA缓冲液高压热抗原修复。加一抗(兔抗人ADAMTS5多克隆抗体1 ∶400稀释),然后加生物素标记的羊抗兔IgG,4 ℃冰箱过夜后,加霉素康生物素蛋白-过氧化酶,DAB显色,苏木素复染,行常规脱水、透明、中性树胶封片。PBS代替一抗作阴性对照。
免疫组化染色根据半定量评分系统[7]判定,通过染色密度和阳性染色细胞数来对ADAMTS5染色结果进行综合评分。①染色密度评分:0分,无染色;1分,弱染色;2分,中染色;3分,强染色;②阳性染色细胞百分比评分:0分,0%;1分,<33%;2分,33%-67%;3分,>67%;总分=①×②。总分≥2和<2被认定为高表达(+)和低表达(-)。染色结果由两个有经验的病理科医师以双盲法进行诊断,一张切片至少选择5个高倍镜视野进行观察。
1.3 统计学方法
采用SPSS 16.0统计学软件进行统计学分析。计数资料采用χ2检验进行比较。检验水准α=0.05。
2 结果
本实验研究显示ADAMTS5蛋白在口腔鳞状细胞癌中高表达,主要定位于细胞质中。ADAMTS5蛋白阳性表达呈黄色或棕黄色颗粒,阴性表达为无或少表达(见图1)。在口腔50例鳞状细胞癌组织中,ADAMTS5的阳性表达率为64%(32/50),癌旁组织为30%(15/50),口腔鳞状细胞癌组织中ADAMTS5蛋白的阳性表达率高于癌旁组织,差异有统计学意义(P<0.01);ADAMTS5表达与口腔鳞状细胞癌患者的年龄、有无淋巴结转移、病理分化程度等有关(P<0.05,见表1)。ADAMTS5在小于50岁患者中的表达高于大于50岁患者;低分化口腔鳞状细胞癌ADAMTS5表达高于高中分化口腔鳞状细胞癌;有淋巴结转移者ADAMTS5表达高于无淋巴结转移者,上述差异均有统计学意义(P<0.05)。口腔鳞状细胞癌中ADAMTS5的表达与性别、发病部位、肿瘤大小等无关(P>0.05,见表1)。
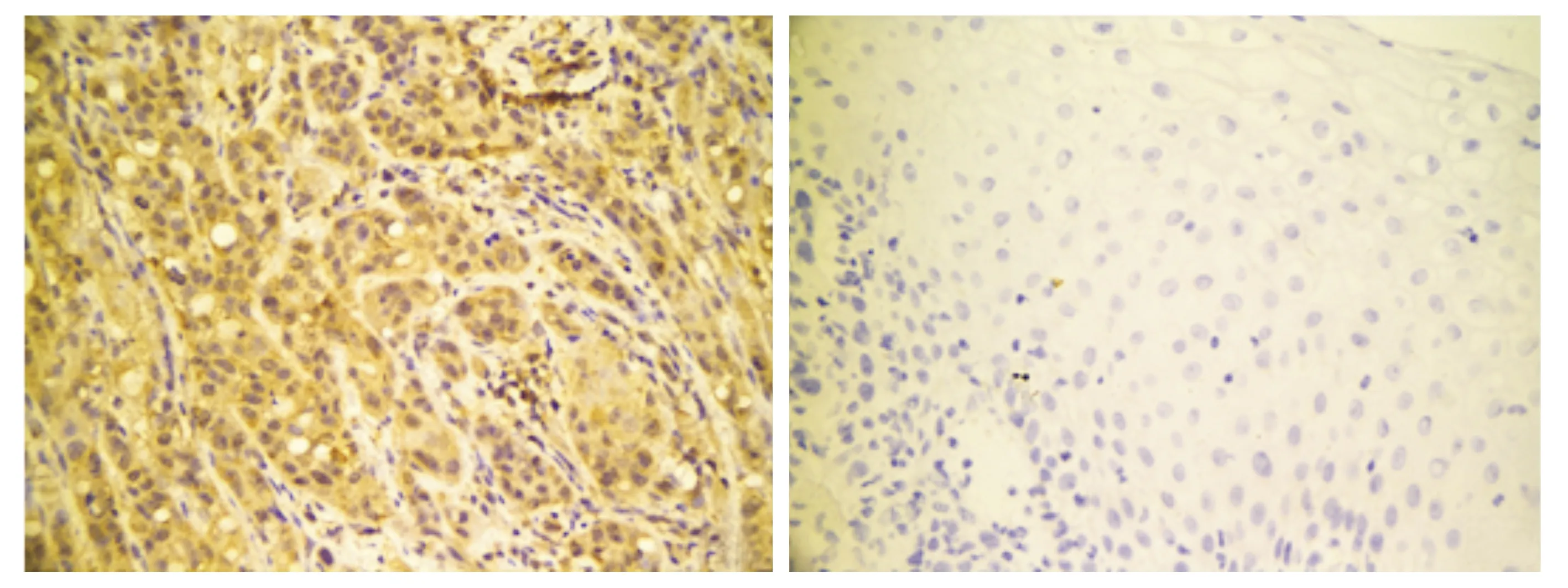
A.ADAMTS5的阳性表达 B.ADAMTS5的阴性表达
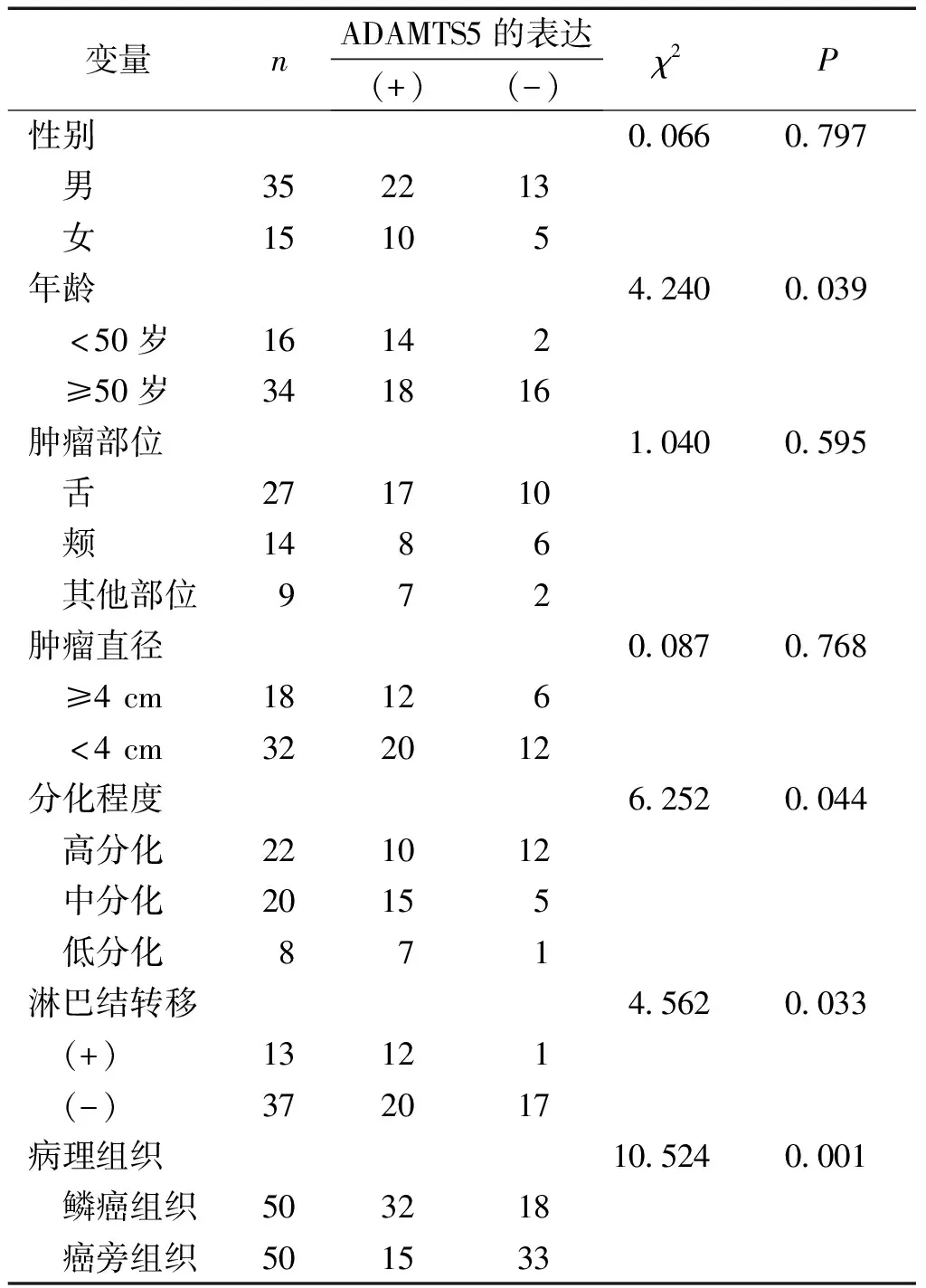
表1 ADAMTS5表达与口腔鳞状细胞癌临床病理特征的关系
3 讨论
口腔鳞状细胞癌是口腔癌中较为常见的恶性肿瘤,其总体生存率在50%左右,近年来,随着外科手术方法、化疗、放射疗法及综合疗法的不断进步,口腔癌患者的生存率略有提升,但提升幅度太小,几乎可以忽略不计[8]。因此我们需要进一步了解口腔鳞状细胞癌发生发展过程中的分子生物学机制,探寻预测口腔鳞状细胞癌早期诊断和靶向治疗的新策略,以达到提高口腔鳞状细胞癌的治疗目的。
ADMATS5是进化上保守的蛋白聚糖酶ADAMTS大家族的成员之一,1999年被发现,由Adamts5基因编码,定位于人21q21.3,编码930个氨基酸的多结构域的功能蛋白,是降解蛋白多糖活性最高的酶[9,10]。ADAMTS5的异常表达参与了包括肿瘤在内的多种疾病的发生发展过程[6]。其中以ADAMTS5在关节炎发生中的研究最为典型,它是在关节炎发生中发挥重要作用的酶[11,12]。在肿瘤组织中,ADAMTS5的异常表达也具有重要意义。ADAMTS5既可以对肿瘤产生促进作用,又可以抑制其发展。在人脑胶质瘤中,ADAMTS5蛋白酶呈现高表达,而在瘤周脑组织中不表达或极低表达,其蛋白表达量随着肿瘤级别的升高而升高[13]。在胃癌、结直肠癌组织中,ADAMTS5表达下调[14-16]。在本实验中对ADAMTS5蛋白的表达情况进行检测,发现ADAMTS5蛋白在口腔鳞状细胞癌中的表达显著上升。这提示ADAMTS5对肿瘤的作用复杂,在不同来源的肿瘤发生中有不同的作用,且存在组织特异性。
在众多肿瘤研究中,ADAMTS5可能都参与了肿瘤的发生发展。在非小细胞肺癌中,ADAMTS5高表达与肿瘤淋巴结转移、临床分期和组织病理分化呈正相关,高表达的患者预后比低表达患者预后差[17];在胃癌组织中,ADAMTS5表达下调与患者性别、病理学类型、肿瘤分化程度、远处转移、TNM分期、脉管浸润相关[14];食管鳞癌组织中,ADAMTS5蛋白的表达与分化程度、淋巴结转移、临床分期和浸润深度有关,ADAMTS5蛋白过表达可以促进食管鳞癌细胞株TE10细胞的增殖、迁移,ADAMTS5蛋白过表达与食管鳞癌的预后较差、存活率低相关[18]。而在本组实验中ADAMTS5的表达与口腔鳞状细胞癌患者的年龄、淋巴结转移及病理分化程度相关,提示ADAMTS5可能参与了口腔鳞状细胞癌的发生发展。在本实验中,随着口腔鳞状细胞癌的分化程度越差,ADAMTS5蛋白的表达就越高;有淋巴结转移的患者,ADAMTS5蛋白的表达也是上调。这可能作为口腔鳞状细胞癌的一个潜在治疗靶点,为口腔鳞状细胞癌患者的个体化治疗提供了一定的借鉴性作用。
有关ADAMTS5的机制研究,在肝癌患者中,可能是通过调控血管内皮生长因子受体VEGF表达,进而调控肝癌血管新生,影响肝癌的发生发展[19]。在非小细胞肺癌中,ADAMTS5可能通过降解细胞外基质、细胞外黏附蛋白等来参与非小细胞肺癌的侵袭转移[17]。在胃癌中,通过抑制ETS1介导的MVD的变化来抑制肿瘤的转移和血管生成[14]。ADAMTS5蛋白异常表达与口腔鳞状细胞癌的发生发展相关,但其调控口腔鳞状细胞癌的具体分子机制及其参与的信号通路等有待我们进一步研究,以期为临床提供新的治疗思路。

