喜树碱对宫颈癌SiHa细胞的抑制作用及其机制探讨
梁小婷,康慧琳
(1山西医科大学汾阳学院医学检验系,汾阳 032200;2孝义市人民医院检验科;*通讯作者,E-mail:l568375113@163.com)
宫颈癌是威胁全球女性健康的常见恶性肿瘤之一,全球每年都有约二十几万的女性死于宫颈癌。近年来宫颈癌患者的年龄分布有明显的走低趋势[1],对女性的身心健康造成很大的影响,也为家庭带来很重的经济负担[2]。常规传统的宫颈癌临床治疗方案包括手术切除、放射疗法、化学疗法或采取综合性的系统治疗手段[3]。随着医学技术水平的发展,运用而生多种宫颈癌的新型治疗手段,比如分子靶向治疗、免疫治疗等多种治疗手段[4]。早期的宫颈癌患者的治疗效果较好,生存率较高。对于晚期以及持续性和复发性患者来说治疗效果较差[5]。其中化学疗法目前主要用于新辅助化疗、增敏化疗、术后或放化疗后的辅助治疗、姑息性化疗等[6]。近年来随着新型化疗药物的不断出现,给药途径和方法的不断改进,化学疗法在治疗宫颈癌中取得了很好的疗效[7]。因此研究和开发新型化疗药物,对于维持女性的宫颈健康有着非常重要的意义。
喜树碱(camptothecin,CPT)来源于珙桐科植物喜树,是一种从喜树中提取出的五环吲哚生物碱[8]。CPT是一种传统的化疗药物,广泛地应用于多种癌症,例如白血病、肝癌、胃癌、结直肠癌、肺癌等[9]。CPT主要通过抑制拓扑异构酶Ⅰ(Topo Ⅰ)影响DNA的复制,进而促进细胞凋亡。虽然CPT可以作用于多种癌症,但是关于CPT作用于宫颈癌的报道较少,尤其是对于人子宫颈鳞癌细胞SiHa鲜有报道,对其作用机制也尚未阐明。因此本研究为了明确CPT对SiHa细胞的促凋亡作用,并初步探讨CPT作用于SiHa细胞的分子机制,为临床上进一步研究CPT的抗癌机制和应用提供一定的理论基础。
1 材料与方法
1.1 药品与试剂
喜树碱(CAS号:7689-03-4)购于上海阿拉丁公司;二甲基亚砜(DMSO)、MTT粉剂、Annexin Ⅴ-FITC/PI凋亡检测试剂盒均购于北京索莱宝公司;DAPI染液购于武汉博士德公司;Trizol试剂盒、反转录试剂盒、SYBR Green Ⅰ试剂盒购于北京全式金公司。
1.2 仪器
多功能自动酶标仪购于美国伯腾公司;流式细胞仪购于美国BD公司;荧光显微镜购于日本尼康公司;核酸定量仪购于北京普析通用公司;荧光定量PCR仪购于美国赛默飞公司。
1.3 细胞株
人子宫颈鳞癌SiHa细胞系山西医科大学第一医院馈赠。胎牛血清、胰酶、青-链霉素和细胞培养基DMEM(武汉博士德生物工程有限公司)。
1.4 细胞培养与分组
细胞培养采用DMEM高糖培养基,其中加入10%的胎牛血清,1%的青-链霉素。在37 ℃、5% CO2的细胞培养箱中培养。倒置显微镜观察细胞生长至80%融合左右,进行细胞传代与实验。设置对照组(常规培养组)和不同浓度喜树碱(CPT)处理组,不同浓度喜树碱处理组在常规培养基中加入1,5,10,50 μmol/L的喜树碱。
1.5 MTT法检测细胞增殖活性
取对数生长期的SiHa细胞制备成1×104个/ml单细胞悬液,以每孔100 μl接种在96孔板中,边缘孔中加入无菌PBS,防止实验操作孔中水分蒸发影响实验结果,同时设置空白孔,空白孔中不添加任何液体。将培养板放入细胞培养箱,待细胞贴壁后弃去上清。对照组每孔中加入100 μl DMEM细胞培养基,实验组中加入100 μl含喜树碱的DMEM培养基,使得喜树碱的终浓度为1,5,10,50 μmol/L。将96孔板放入细胞培养箱中,干预24 h或48 h取出,每孔加入10 μl MTT,4 h后弃去上清,加入150 μl DMSO,用酶标仪测定培养板在570 nm处的吸光度值。计算公式:细胞存活率=[(A实验孔-A空白孔)/(A对照孔-A空白孔)]×100%;细胞抑制率=[(A对照孔-A实验孔)/(A对照孔-A空白孔)]×100%。以上实验重复3次。
1.6 荧光染色法观察细胞核形态学变化
取对数生长期的SiHa细胞制备成1×105个/ml单细胞悬液,以每孔2 ml接种于6孔板中,将6孔板放入细胞培养箱中预培养24 h后弃去上清。对照组加入2 ml细胞培养基,实验组分别加入终浓度为5,10,50 μmol/L的喜树碱细胞培养液。加药干预24 h,取出6孔板,弃去上清,用PBS缓慢冲洗细胞表面2次,用4 ℃的多聚甲醛固定15 min。固定后用PBS轻轻洗涤3次,每次5 min,注意不要冲洗掉细胞。避光的条件下加入浓度为0.1 μg/ml的DAPI染液15 min,染色后剧烈洗涤3次,每次5 min。荧光显微镜波长340 nm下观察SiHa细胞的形态学变化。
1.7 流式细胞术检测细胞凋亡
与1.6同样的方法处理细胞。加药干预24 h,取出6孔板,弃去上清,用PBS缓慢冲洗细胞表面2次。使用Binding buffer将细胞重悬成1×105个/ml的细胞悬液。在细胞悬液中加入Annexin Ⅴ-FITC染液,室温、避光10 min后加入PI染液,避光孵育后加入Binding buffer,上机检测。
1.8 real-time PCR检测凋亡相关基因mRNA表达水平变化
与1.6同样的方法处理细胞。加药干预24 h,采用TransZol Up法提取各组细胞内的总RNA。将RNA反转录为cDNA,使用核酸定量仪定量,调整合适的反应温度及时间(94 ℃先预变性30 s;94 ℃再变性5 s;50-60 ℃退火15 s,72 ℃延伸10 s,共40-45个循环),然后上机。通过实时荧光定量PCR法比较各组间细胞内GADPH、Bax、Bcl-2基因的表达含量。引物序列见表1。

表1 扩增引物序列表
1.9 统计学处理

2 结果
2.1 喜树碱对SiHa细胞的生长抑制作用
MTT结果显示,CPT作用于SiHa细胞24,48 h,可以明显地抑制SiHa细胞的生长,与对照组相比,CPT组细胞存活率明显下降,差异均有统计学意义(P<0.01)。且各浓度组之间的差异有统计学意义(均P<0.05,见图1,2),呈剂量依赖性。
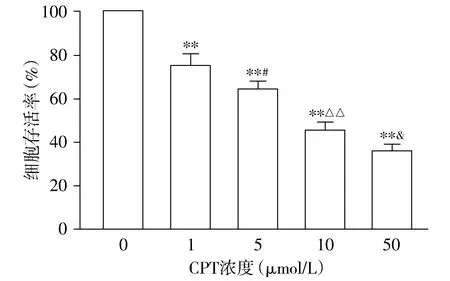
与对照组相比较,**P<0.01;与1 μmol/L CPT组相比,#P<0.05;与5 μmol/L CPT组相比,△△P<0.01;与10 μmol/L CPT组相比,&P<0.05
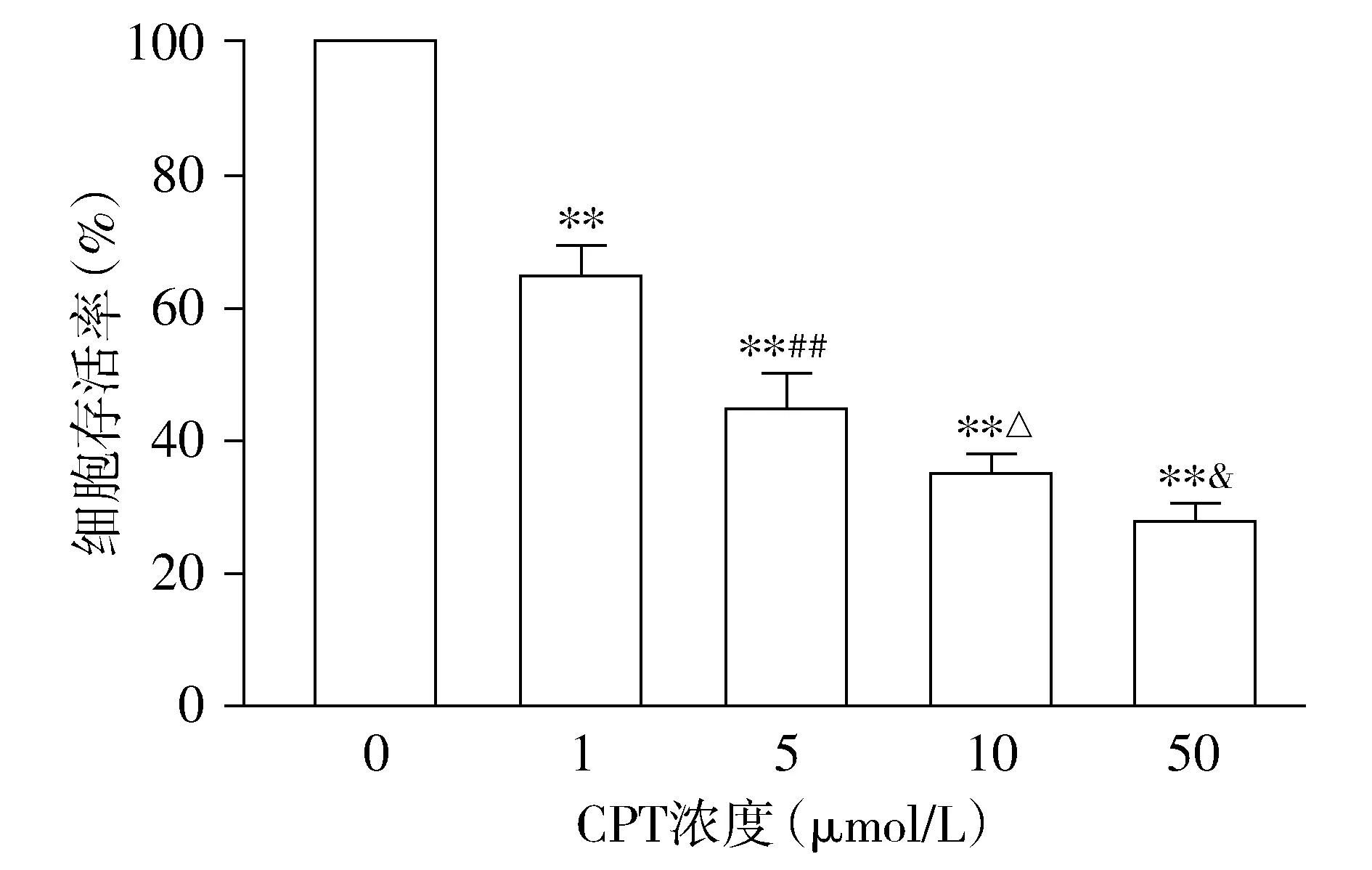
与对照组相比较,**P<0.01;与1 μmol/L CPT组相比,##P<0.01;与5 μmol/L CPT组相比,△P<0.05;与10 μmol/L CPT组相比,&P<0.05
2.2 喜树碱对SiHa细胞核形态学影响的检测
SiHa细胞经不同浓度的CPT(5,10,50 μmol/L)处理后,采用荧光显微镜检测细胞核的形态变化。经CPT处理后,SiHa细胞的细胞核出现浓染,细胞核开始固缩,随着CPT浓度的不断加大,核固缩较明显,50 μmol/L的CPT作用于SiHa细胞后,细胞核进一步浓缩,颜色发白呈亮蓝色,部分细胞核出现核碎裂,显示出典型凋亡细胞的核特征(见图3)。表明CPT可以导致SiHa细胞出现明显的细胞凋亡的形态学特征。
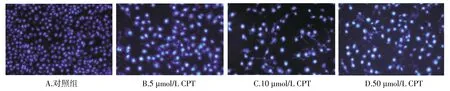
图3 不同浓度的CPT对SiHa细胞核形态学的影响
2.3 喜树碱对SiHa细胞凋亡率影响的检测
为了进一步量化凋亡作用,采用流式细胞术检测经Annexin Ⅴ-FITC/PI双染的细胞。结果显示,与对照组相比,CPT组凋亡率明显高于对照组,差异均有统计学意义(P<0.01)。在0-50 μmol/L的浓度范围内随着浓度的增大细胞凋亡率也在不断增高,各浓度组之间的差异有统计学意义(均P<0.01,见图4,表2),呈剂量依赖性。
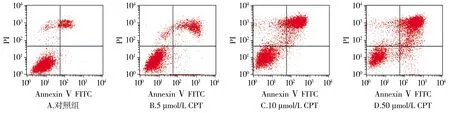
图4 不同浓度的CPT对SiHa细胞凋亡率的影响

表2 CPT作用于SiHa细胞24 h后细胞的凋亡率
2.4 喜树碱对SiHa细胞凋亡基因mRNA表达水平的影响
不同浓度的CPT(1,5,10,50 μmol/L)作用于SiHa细胞后,Bax基因的表达呈增长趋势,与对照组相比较,差异均有统计学意义(P<0.05,见图5)。在0-50 μmol/L的浓度范围内随着浓度的增大细胞内Bax基因的表达也在不断增高,各浓度组之间的差异有统计学意义(均P<0.05,见图5),呈剂量依赖性。
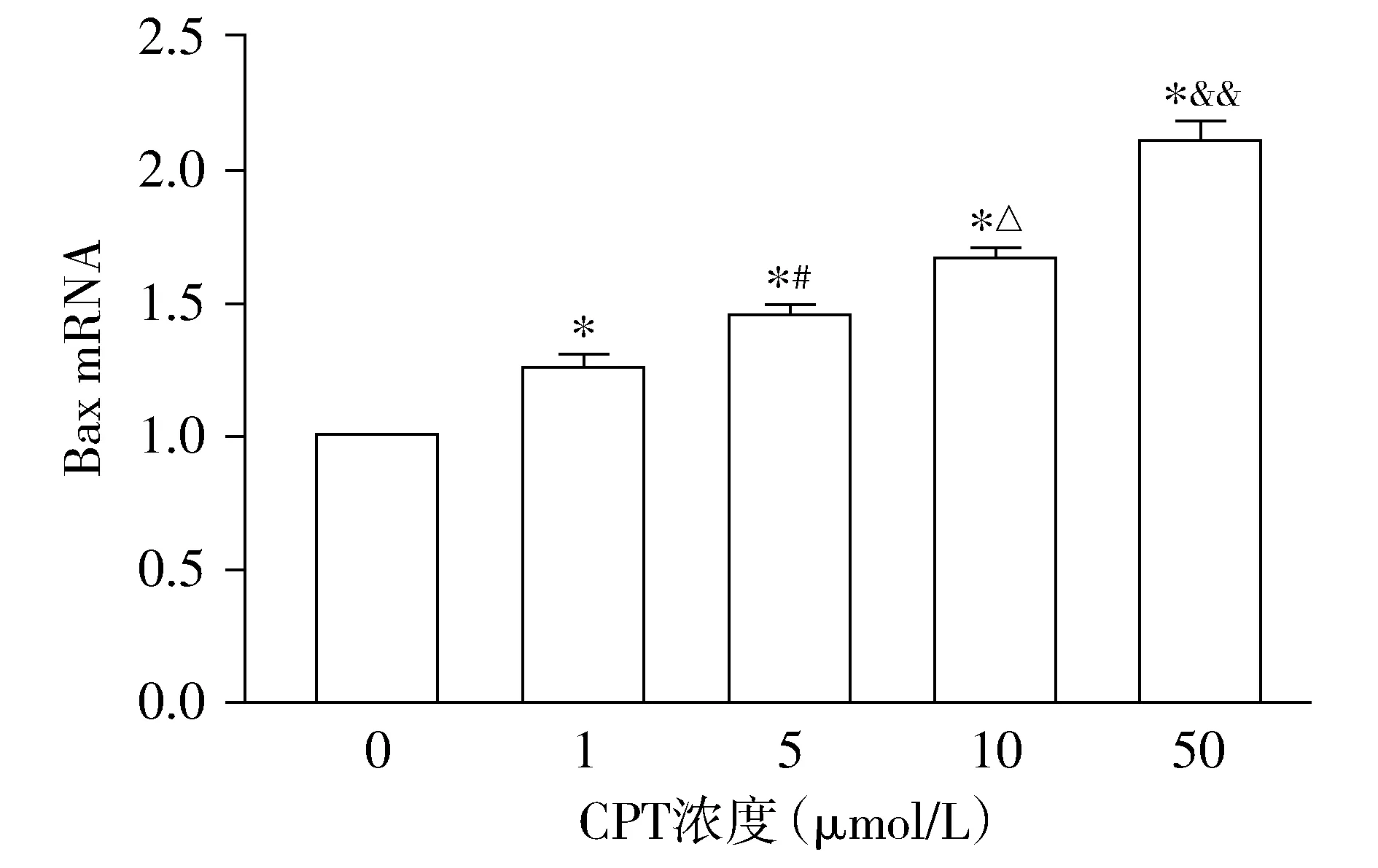
与对照组相比,*P<0.05;与1 μmol/L CPT组相比,#P<0.05;与5 μmol/L CPT组相比,△P<0.05;与10 μmol/L CPT组相比,&&P<0.01
相反,与对照组相比,Bcl-2基因的表达呈下降趋势,不同浓度CPT组差异均有统计学意义(P<0.05,见图6)。在0-50 μmol/L的浓度范围内随着浓度的增大细胞内Bcl-2基因的表达也在不断降低,各浓度组之间的差异有统计学意义(均P<0.05,见图6),呈剂量依赖性。
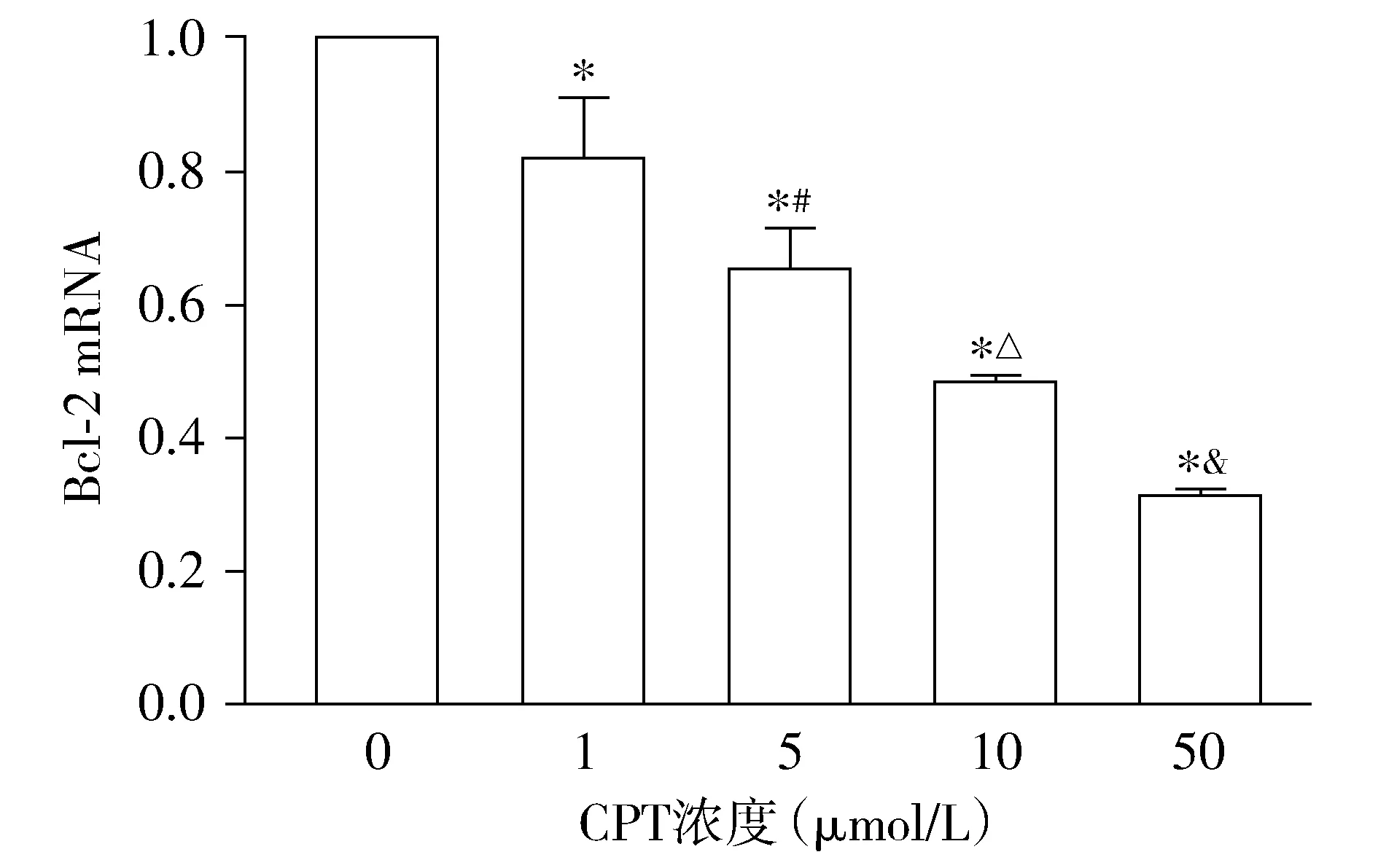
与对照组相比,*P<0.05;与1 μmol/L CPT组相比,#P<0.05;与5 μmol/L CPT组相比,△P<0.05;与10 μmol/L CPT组相比,&P<0.05
3 讨论
宫颈癌是威胁全球女性健康的一类重大疾病。根据美国癌症协会报道,2020年美国宫颈癌患者将会新增加13 800例,预计死亡人数达到4 290例[10]。宫颈癌的治疗方法主要有手术、放疗和化疗。近年来抗癌化学药物的迅猛发展,过去认为对宫颈癌无效的化疗现在已经被认为是非常重要的一种治疗方式,尤其是宫颈癌晚期或者复发者效果显著[11]。
细胞凋亡是指由基因决定的细胞自动结束生命的过程,主动而有序,整个过程受到严格的遗传机制的调控[12]。凋亡产生的损伤作用是癌症治疗的较为有效的重要思路。喜树碱是一种植物抗癌药物,对多种肿瘤细胞均有抑制生长的作用[13]。研究表明,喜树碱可以诱导多种细胞发生凋亡,例如胃肠道癌症和头颈部癌症。也有研究报道,喜树碱对宫颈癌细胞有明显的抑制生长的作用,但多为研究喜树碱或羟基喜树碱对HeLa细胞的作用[14,15]。目前喜树碱对宫颈鳞癌SiHa细胞的研究报道较少[16],探究其作用机制的文章更少。为了研究喜树碱对宫颈鳞癌SiHa细胞的影响,采用MTT法将不同浓度的喜树碱作用于SiHa细胞并观察其生长状况。实验结果表明,不同浓度的喜树碱对SiHa细胞有明显的抑制作用,并且呈现一定的剂量依赖性。进一步研究喜树碱对SiHa细胞的抑制作用是否通过抑制细胞凋亡来产生,进而进行了形态学实验。研究表明,喜树碱作用与SiHa细胞后,出现典型的凋亡特征,核分裂的染色质凝聚,并逐渐出现凋亡小体。为了进一步量化细胞凋亡率,Annexin Ⅴ/PI双染后采用流式细胞术检测细胞凋亡率。不同浓度的喜树碱作用于SiHa细胞后,细胞凋亡率明显升高,与对照组相比较差异具有统计学意义。
Bcl-2家族蛋白包含抗凋亡蛋白(主要包括Bcl-2、Bcl-xL等)和促凋亡蛋白(主要包括Bax、Bak等)[17]。Bax和Bcl-2是线粒体通路中的关键调节蛋白。当细胞受到凋亡信号刺激时,Bax转移到线粒体上,并使线粒体发生变化进而促使细胞凋亡。整个过程中Bcl-2必须与Bax结合才能发挥作用。研究表明,Bcl-2表达升高,Bax表达下降,两者形成异二聚体抑制细胞凋亡。反之,两者形成同二聚体促进细胞凋亡[18]。本实验中,不同浓度的喜树碱作用于SiHa细胞后,Bcl-2的表达降低,Bax的表达升高,说明喜树碱可能通过线粒体通路促进SiHa细胞凋亡,进而抑制SiHa细胞的生长。但是实验没有进一步从蛋白水平验证,有待于进一步的完善。
总之,本研究证明,喜树碱作用于宫颈鳞癌SiHa细胞,可以显著地抑制SiHa细胞的生长。其作用机制可能通过线粒体通路促进SiHa细胞发生凋亡,为临床中宫颈癌的治疗提供了一定的基础实验依据。

