pH值对罗非鱼蛋白-大豆蛋白混合热凝胶特性及体外消化性的影响
陈艾霖,刘曼曼,周春霞,洪鹏志
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研究中心,广东省现代农业科技创新中心,广东湛江524088)
中国罗非鱼养殖规模大,2018 年产量高达162.45万吨,养殖总产量居世界首位[1]。鱼分离蛋白(fish protein isolate,FPI)营养价值高,易消化[2],是优质动物蛋白的主要来源。酸碱提取法蛋白质提取率高,分离到的鱼分离蛋白除了含有大部分肌原纤维蛋白外,还含有水溶性肌浆蛋白[3]。与传统鱼糜相比,鱼分离蛋白具有脱脂、脱臭、脱色的优势[4],可作为高档鱼糜制品的蛋白配料。但水产蛋白凝胶在食品应用过程中因其凝胶强度低,难凝胶化而受到限制[5]。大豆分离蛋白(soy protein isolate,SPI)理化及功能特性突出[6],是一种具有可持续性、高营养价值、优良风味的食品添加材料。近年来含有优质的动植物双蛋白食品成为人们关注的焦点,这种食品优化国民的膳食结构,被列入“健康中国2030”规划纲要及最新颁布的国民营养计划(2017 年~2030 年)中[7]。有研究表明,混合蛋白尤其是动植物蛋白混合可避免单一蛋白的营养不足,提高产品的安全性和营养价值,降低动物蛋白的成本[8]。
蛋白质混合方式主要有化学混合和物理混合。化学混合是指将蛋白原料进行一定比例混合后,重新提取出一种新混合蛋白[9]。物理混合是指两种或两种以上蛋白直接混合,这种混合在食品加工方面具有方便快捷的优势。混合蛋白之间相互作用形成网状结构或交联结构,可改善食品的感官和功能特性[10]。有研究表明,添加1%黑豆和绿豆分离蛋白,可以抑制沙丁鱼鱼糜中内源性蛋白酶水解肌原纤维蛋白,增强凝胶强度[11];添加花生分离蛋白能够提高肌原纤维蛋白凝胶的持水性、凝胶强度和弹性,使凝胶结构更紧凑[12]。pH值会影响氨基酸侧链电荷的数量及分布情况,改变蛋白质的分子结构及蛋白质间的疏水相互作用,进而改变蛋白质功能特性。为此,本研究利用动植物蛋白功能互补的优势,探讨不同pH 值条件对罗非鱼蛋白-大豆蛋白(FPI∶SPI=1∶1,质量比)混合体系热诱导凝胶特性的影响,旨在改善食品加工过程中鱼蛋白的凝胶特性,为新型双蛋白凝胶制品在食品加工中的应用提供理论指导。
1 材料与方法
1.1 材料与仪器
罗非鱼:湛江水产市场;大豆低温脱脂豆粕[粗蛋白含量为(43.75±0.06)%]:湖北荆州三菱湖小渔村;胃蛋白酶(15 000 U/g)、胰蛋白酶(350 000 U/g):阿拉丁试剂公司;戊二醛、三氯甲烷(均为分析纯):西陇科学股份有限公司。
Avanti J-26sxp 落地高速冷冻离心机:美国Beckman 公司;VAP-450 自动凯氏定氮仪:德国Gerhardf公司;NAI-CCQ-150s 索氏抽提器:上海那艾精密仪器有限公司;NS810 分光测色仪:深圳市三恩时科技有限公司;TMS-PRO 物性分析质构仪:美国FTC 公司;MARSIII 模块化高级流变仪:德国HAKKE 公司;JEM-7610-F 扫描电子显微镜:日本JEOL 公司。
1.2 方法
1.2.1 FPI 的制备
取鲜活罗非鱼背部白肉绞碎,按照料液比1∶9(g/mL)与冰蒸馏水混合均质3 min,调节pH 值至11.0,搅拌提取15 min 后离心(10 000 r/min,20 min,4 ℃),上清液pH 值调至5.5,再离心(10 000 r/min,20 min,4 ℃)。冰蒸馏水分散沉淀,pH 值调至7.0,透析后冷冻干燥备用。FPI 的蛋白质含量为(90.02±1.07)%。
1.2.2 SPI 的制备
豆粕经粉碎后过筛(100 目),按照料液比1∶10(g/mL)与冰蒸馏水混合均质3 min,调节pH 值至11.0,搅拌提取2 h 后离心(10 000 r/min,20 min,4 ℃),上清液pH值调至4.5 后,再离心(10 000 r/min,20 min,4 ℃),冰蒸馏水分散沉淀,pH 值调至7.0,透析后冷冻干燥备用。SPI 的蛋白质含量为(80.85±0.65)%。
1.2.3 动态黏弹性的测定
参考Buamard 等[13]的方法并作修改。将一定量的冰蒸馏水分别加入FPI、SPI、FPI∶SPI=1∶1(质量比)中分散,固定蛋白浓度12%,调节不同pH 值为6.0、6.5、7.0、7.5,使用模块化高级流变仪,取上述样品约3 mL于平板上,平板四周加入液体石蜡密封防止该过程中水分蒸发,主要参数为:平板夹具直径35 mm,探头型号P35 TIL,狭缝间隙1 mm,升温范围25 ℃~95 ℃,降温范围95 ℃~25 ℃,扫描速率2 ℃/min,频率0.1 Hz。
1.2.4 凝胶的制备
将一定量的冰蒸馏水分别加入FPI、SPI、FPI∶SPI=1∶1(质量比)中分散,固定蛋白浓度为12%,调节pH 值为6.0、6.5、7.0、7.5,采用二段式加热法(40 ℃热处理1 h,90 ℃热处理40 min),冰水浴冷却30 min,4 ℃放置过夜备用。
1.2.5 凝胶质构的测定
参考Zhou 等[14]方法并略作改动。质构仪参数设定:圆柱形探头直径为5 mm,量程为1 000 N,形变量为75%,起始力为0.5 N,以60 mm/min 的速度连续两次压缩样品,间隔为5 s,测定凝胶强度、硬度、弹性值。凝胶强度按如下公式计算。

1.2.6 凝胶持水性的测定
按1.2.4 制备凝胶,参考Wu 等[15]的方法并略作改动。称总质量记W1(g),经离心(5 000 r/min,15 min)除去水分,再称质量记W2(g),持水性根据下面公式计算。
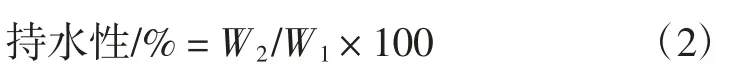
1.2.7 凝胶白度的测定
参照Niu 等[16]的方法并略作修改。用色差仪测定凝胶,分别记录L*(亮度),a*(红色/绿色),b*(黄色/蓝色),凝胶白度值按如下公式计算[17]。
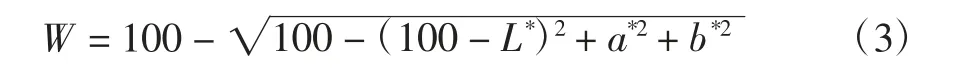
1.2.8 扫描电镜观察
参考林端权[18]的方法并略作修改。扫描电镜凝胶切片厚度为5 mm,用2.5%pH 6.8 的戊二醛固定12 h,磷酸盐缓冲液(0.1 mol/L,pH 6.8)浸泡洗涤15 min,重复3次。接着分别用50%、70%、80%、90%乙醇各浸泡10 min,无水乙醇浸泡15 min,重复3 次。三氯甲烷脱脂1 h,乙醇∶叔丁醇1∶1(体积比)混合液浸泡15 min,100%叔丁醇溶液置换15 min,真空冷冻干燥。样品采用离子溅射镀膜法对样品喷金后进行电镜扫描,观察其微观结构。
1.2.9 体外消化特性
参考Menezes 等[19]的方法并略作修改,体外消化的测定模拟人体胃液和肠液的消化过程。按1.2.4 制备凝胶,称适量搅碎的凝胶放入100 mL HCl 溶液(0.1 mmol/L,pH 2.0),使得溶液中的蛋白质含量为3 mg/mL,添加0.33 g 胃蛋白酶,37 ℃条件下水浴振荡1.5 h。用1.0 mol/L NaOH 中和至pH 7.0。加入等体积10 mg/mL 胰蛋白酶-磷酸盐缓冲溶液,37 ℃水浴振荡反应3 h,加入碳酸钠中止反应,利用考马斯亮蓝法测定消化后蛋白含量。总蛋白含量是通过凯氏定氮法测定凝胶的蛋白含量。体外消化率的计算公式如下。
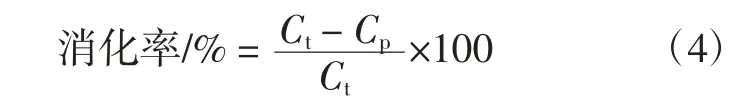
式中:Ct为消化前的总蛋白含量,mg/mL;Cp为消化后的蛋白含量,mg/mL。
1.3 数据统计分析
数据采用Origin 9.0 软件进行绘图,数据间的显著性采用SPSS Statistics 24.0 软件进行统计分析。
2 结果与分析
2.1 pH 值对混合蛋白凝胶流变特性的影响
pH 值对罗非鱼蛋白-大豆蛋白混合体系热诱导储能模量的影响见图1。
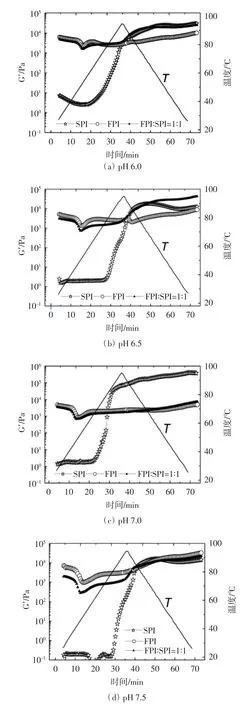
图1 pH 值对罗非鱼蛋白-大豆蛋白混合体系热诱导凝胶储能模量的影响Fig.1 Effect of pH on heat-induced dynamic elastic modulus of tilapia protein-soy protein mixtures
如图1 所示,FPI 初始的储能模量值较大,SPI 溶解性好,在起始阶段加热温度低,变性程度低,初始储能模量值小[20],混合蛋白体系的初始储能模量值介于FPI 与SPI 之间。随着温度的上升,蛋白质发生变性,水产蛋白凝胶的网络结构受到破坏,分子间的流动性增大[21],FPI 的储能模量G′值下降,之后缓慢上升,分子结构展开后聚集,当温度高于48 ℃,G′值开始明显增加,鱼糜凝胶有序的网络结构被固定,凝胶强度和弹性增强;SPI 的7S 和11S 的变性温度分别在75 ℃和90 ℃[16],当温度从95 ℃开始下降,7S 和11S 充分变性后,弱酸条件下混合蛋白质亚基之间的连接和相互作用增强,G′值快速增大,明显高于FPI,凝胶特性增强。混合蛋白体系在41 ℃之前,凝胶形成松散的网络结构;41 ℃~46 ℃,蛋白质开始变性,部分肽链解螺旋,增加了蛋白的黏性,同时不同程度上破坏了蛋白凝胶网络结构导致凝胶劣化[22];46 ℃~95 ℃时两种蛋白内部结构展开,分子间作用增强,形成强凝胶。混合蛋白凝胶在pH 6.5 时的G′值大于在pH 6.0 时的G′值。有研究表明,pH 5.5~6.0,大豆蛋白11S 往往不能发生变性和结构变化,蛋白质之间的相互作用有限[23]。弱酸条件能增强混合蛋白质的凝胶特性,且pH 6.5 时混合蛋白的凝胶特性最好。
2.2 pH 值对混合蛋白凝胶质构特性的影响
pH 值对罗非鱼蛋白-大豆蛋白混合热诱导凝胶质构特性的影响见图2。
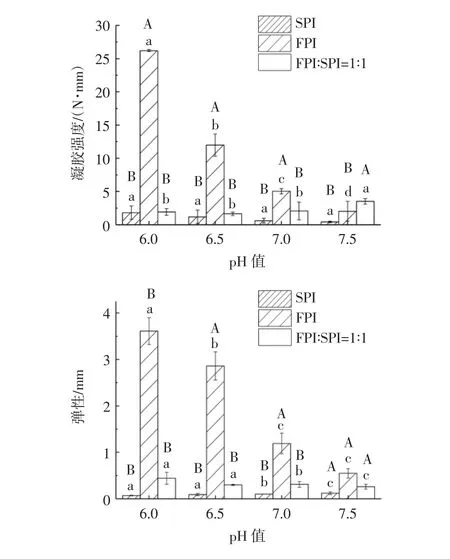
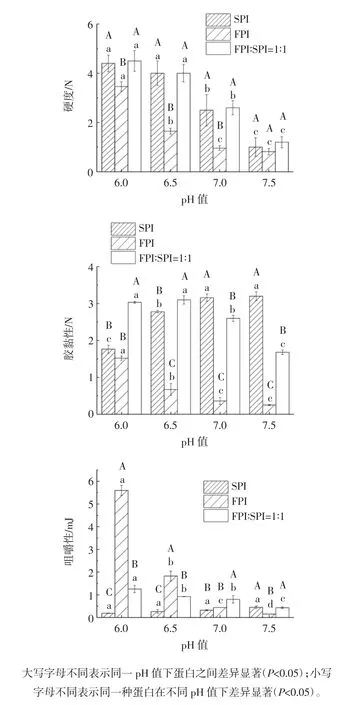
图2 pH 值对罗非鱼蛋白-大豆蛋白混合热诱导凝胶质构特性的影响Fig.2 Effect of pH on the texture properties of heat-induced gel from tilapia protein-soy protein mixtures
如图2 所示,在试验范围内,FPI 凝胶的凝胶强度、弹性、硬度、胶黏性和咀嚼性均随pH 值的增大而减小;SPI 凝胶的硬度随pH 值的增大而减小,且SPI凝胶的凝胶强度、弹性均小于FPI;对于混合蛋白热凝胶,pH 值对凝胶强度和弹性的影响不大(P>0.05),而pH值偏酸性时混合蛋白热凝胶的弹性、胶黏性、咀嚼性和硬度整体上都显著高于中性和弱碱性条件(P<0.05),这个结果与流变特性的结果一致,弱酸条件下混合蛋白热凝胶的G′值较高,对应的质构特性得到了改善。当pH 6.5 时,混合蛋白热凝胶的硬度和胶黏性相比FPI,都得到提升。说明pH 6.5 的条件下,添加同浓度的大豆蛋白能显著提高FPI 的硬度和胶黏性(P<0.05)。
2.3 pH 值对混合蛋白凝胶持水性的影响
pH 值对罗非鱼蛋白-大豆蛋白混合热诱导凝胶持水性的影响见图3。

图3 pH 值对罗非鱼蛋白-大豆蛋白混合热诱导凝胶持水性的影响Fig.3 Effect of pH on water holding capacity of heat-induced gel from tilapia protein-soy protein mixtures
持水性反映凝胶中蛋白质与水分的结合程度[24]。如图3 所示,FPI 凝胶的持水性比SPI 凝胶持水性弱(P<0.05),凝胶水分和蛋白质之间结合程度较低。随着pH 值上升,FPI 凝胶的持水性逐渐增强(P<0.05)。FPI 和SPI 混合后,pH6.0 ~7.0 时,体系的凝胶持水性明显高于FPI 凝胶的持水性(P<0.05)。可能是SPI的侧链反应基团促进肌原纤维蛋白和SPI 之间的相互作用,氢键增加,水分与蛋白质结合程度增强,形成一个连续的三维网络结构[25]。pH 6.5 时,罗非鱼-大豆混合蛋白热凝胶持水性相比其它pH 值条件下混合蛋白热凝胶持水能力强,达到最大值为84.02%。可能是pH 值会使蛋白质分子的离子化作用和净电荷值发生改变,从而影响蛋白质与水分子的结合能力[26]。
2.4 pH 值对混合蛋白凝胶白度的影响
pH 值对罗非鱼蛋白-大豆蛋白混合热诱导凝胶白度的影响见图4。
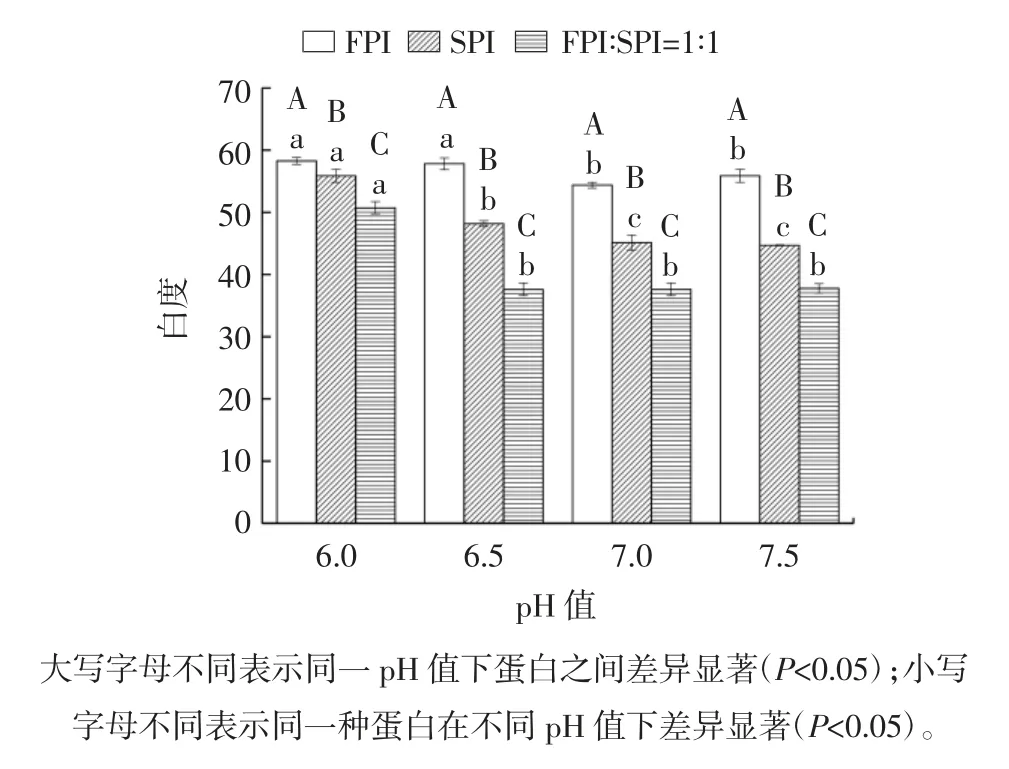
图4 pH 值对罗非鱼蛋白-大豆蛋白混合热诱导凝胶白度的影响Fig.4 Effect of pH on the whiteness of heat-induced gel from tilapia protein-soy protein mixtures
如图4 所示,SPI 及FPI-SPI 混合蛋白热凝胶的白度值均低于FPI 凝胶的白度,这可能与大豆分离蛋白本身的颜色有关。大豆分离蛋白颜色偏黄,将SPI 添加到FPI 中制成凝胶,其白度下降,这个结果与王博等[27]的结果一致,SPI 的添加会降低肌原纤维蛋白凝胶的白度值。对于混合体系的热凝胶,pH 6.0 时白度值显著高于其它pH 值条件下的白度值。有研究表明,pH 值会影响蛋白质分子间作用力[28],从而影响蛋白质的变性,而凝胶的白度与蛋白质的变性息息相关,蛋白质的变性程度越大,白度值越高。凝胶的动态黏弹性、质构特性的结果是pH 6.5 时蛋白质变性程度最大,形成的凝胶性能最好,而白度值的结果是pH 6.0 时白度值最大,这是由于白度不仅取决于蛋白质变性、聚合程度,还取决于表面的光学特性[29],致密的蛋白质凝胶基质可能导致更多的光从凝胶表面反射,从而导致颜色略显明亮,这可能与混合蛋白的微观结构有关。
2.5 pH 值对混合蛋白凝胶微观结构的影响
pH 值对罗非鱼蛋白-大豆蛋白混合热诱导凝胶微观结构的影响见图5。
FPI 凝胶网状结构松散,凝胶微观孔隙较大。而SPI 溶解性较好,较强的分子间相互作用促进热处理过程中分子间的缔合作用,形成凝胶的网络结构更为连续且孔洞小[30],因此,SPI 凝胶孔径比FPI 凝胶小,分布均匀。FPI 和SPI 混合凝胶与FPI 凝胶相比,孔隙减小,致密均匀,更加平整。可能是热处理使大豆球蛋白肽链裂解,反应基团暴露[31],肌原纤维蛋白通过疏水作用力和二硫键与大豆分离蛋白分子聚集更加紧密,凝胶网络结构呈现孔洞小,均匀对称。这种结构使蛋白和水之间的作用力更强,形成凝胶的网络结构更稳定。相比其它pH 值条件下,混合蛋白热凝胶在pH 值为6.0 时其凝胶结构为多孔的致密网状,凝胶基质中水分更多释放到凝胶表面,持水能力差,促进光散射作用,进而会增加凝胶白度[32],这个结果进一步验证了pH 6.0 时白度值最大的结论。其它pH 值条件下混合蛋白热凝胶表面呈片状少孔,其中pH 6.5 条件下混合蛋白凝胶光滑平整,致密的网络结构更好锁住凝胶内部水分。

图5 pH 值对罗非鱼蛋白-大豆蛋白混合热诱导凝胶扫描电镜图(×10 000)的影响Fig.5 Effect of pH on scanning electron micrograph(×10 000)of heat-induced gel from tilapia protein-soy protein mixtures
2.6 pH 值对混合蛋白凝胶体外消化性的影响
pH 值对罗非鱼蛋白-大豆蛋白混合蛋白凝胶体外消化性的影响见图6。
食物的微观和宏观结构以及聚集体的形态,都会对其消化程度产生影响[33]。如图6 所示,FPI 热凝胶的消化率明显高于SPI 热凝胶的消化率(P<0.05),这可能与凝胶的结构有关,从扫描电镜的结果可以看出SPI 凝胶结构比FPI 凝胶的结构更加致密,降低与消化酶的反应,从而降低了SPI 凝胶的消化率,有研究显示SPI 为氨基酸间相联结形成的具有特定空间结构的生物大分子,紧密的分子结构能够对酶解作用产生较强的抵抗力[34]。pH 值为6.0、6.5 时,FPI 和SPI 两种蛋白混合后凝胶的消化率明显比SPI 热凝胶的消化率高(P<0.05)。当pH 值为6.5 时,罗非鱼-大豆混合蛋白热凝胶的消化率达91.57%,高于其它pH 值下的消化率,这可能是由于FPI 和SPI 混合蛋白在该pH 值下蛋白质分子中的非共价相互作用(氢、离子和疏水键),从而影响二级和三级结构[35]。二级结构发生显著的变化,热诱导凝胶的蛋白质β-折叠含量会降低,无规则卷曲的含量会提高[36],蛋白质的无规则卷曲的含量与体外消化率成正相关,随着无规则卷曲含量的升高,体外消化率也有所提高。
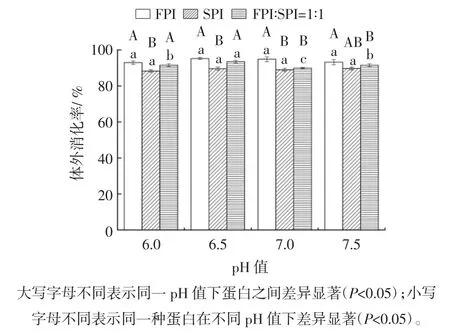
图6 pH 值对罗非鱼蛋白-大豆蛋白混合热诱导凝胶体外消化性的影响Fig.6 Effect of pH on in vitro digestibility of heat-induced gel from tilapia protein-soy protein mixtures
3 结论
本研究探讨不同pH 值(6.0、6.5、7.0、7.5)对罗非鱼-大豆混合蛋白热凝胶特性和体外消化特性的影响。结果表明添加SPI 使得混合蛋白形成的凝胶网络结构更加致密,持水性增强,在弱酸条件混合体系的凝胶特性、胶黏性和硬度整体上都显著高于中性和弱碱性条件(P<0.05),体外消化率明显优于SPI 的消化率(P<0.05)。pH 值为6.5 时,混合蛋白的凝胶质构最好;持水性比SPI 高14.8%~39.6%;体外消化性优于其它pH 值条件下的混合蛋白凝胶。综上,罗非鱼分离蛋白和大豆分离蛋白混合制备的热凝胶特性以及体外消化特性得到明显的改善,且pH 6.5 时凝胶质构、持水性、微观结构、体外消化特性最好。总之,双蛋白凝胶特性及消化性的相关研究还需要进一步探讨两种蛋白混合比例,可通过调节pH 值提高混合蛋白凝胶的加工品质和营养价值,为新型双蛋白凝胶制品在食品加工应用提供借鉴与指导。

