高密度脂蛋白胆固醇对行根治性治疗的酒精相关性肝细胞癌患者预后的影响
张 蕊, 常秀娟, 程家敏, 赵志芹, 李茵茵, 陆荫英, 曾 珍,
1 北京大学三〇二临床医学院 肝脏肿瘤诊疗与研究中心, 北京 100039;2 解放军总医院第五医学中心 肝脏肿瘤诊疗与研究中心, 北京 100039
肝细胞癌(HCC)是全球癌症相关死亡的第四大原因,占原发性肝癌的80%以上[1],其发病原因包括HBV及HCV感染、酗酒、肥胖、黄曲霉素感染等,随着乙型肝炎及丙型肝炎抗病毒疗效的提高,大量饮酒导致的酒精相关性HCC的比例逐渐增高。在HCC的发生发展过程中,由于肝细胞膜或线粒体损伤、细胞能量供应缺乏等因素,使得HCC患者在临床中出现血清HDL-C水平下降[2]。已有许多研究表明, HDL-C水平降低是HCC发生的独立危险因素[3];而依据血清TC和HDL-C水平建立的系统性肝损伤指数可提示乙型肝炎相关性HCC术后预后情况[4],但尚缺乏研究明确HDL-C水平与酒精相关性HCC的关系。本文旨在通过对行初始根治性治疗的酒精相关性HCC患者临床病例回顾性分析,初步探讨HDL-C在酒精相关性HCC患者中异常情况及其与酒精相关性HCC患者根治性治疗预后的相关性。
1 资料与方法
1.1 研究对象 回顾性分析2008年1月—2015年7月于解放军总医院第五医学中心行根治性治疗(定义为术后6个月复查肿瘤未复发)的43例酒精相关性HCC患者的临床资料。根据HDL-C水平分为HDL-C正常组和HDL-C异常组。入选标准:(1)有长期饮酒史,一般超过5年,酒精摄入量:男性40 g/d,女性20 g/d; 或2周内有大量饮酒史(>80 g/d)[5];(2)符合《原发性肝癌诊疗规范(2019年版)》[6]诊断标准;(3)在本院住院的初诊酒精性HCC患者,术后6个月内未进行其他治疗;(4)无降脂药服用史。排除标准:胆管细胞癌,混合细胞癌,存在HBV或HCV感染(HBeAg阳性或丙型肝炎抗体阳性),或由其他因素导致的肝脏疾病如免疫、药物、寄生虫、遗传代谢等,伴有其他基础代谢疾病的患者。
1.2 资料收集 收集患者基本信息,如性别、年龄、BMI;入院后首次影像学检查结果,如腹部超声、CT、MRI等;生化指标,如入院后首次血脂检查指标HDL-C、凝血功能指标、肝功能指标、肿瘤标志物相关指标等。随访开始时间为2008年4月1日,每3个月电话、门诊或住院复查,截止时间为2017年9月31日。研究起始时间为接受主要治疗的时间,结束时间为患者死亡、最后1次随访时间。
1.3 伦理学审查 本研究方案经由解放军总医院第五医学中心伦理委员会审批,批号:2019002D,所有患者均知情同意。

2 结果
2.1 一般资料 43例患者中11例为消融治疗,32例为外科手术治疗。中位随访时间5.25年。全为男性,年龄44~79岁,平均(62.23±9.57)岁。平均饮酒时间为27.53年,中位饮酒时间为30年,范围为5~60年。酒精摄入量40~80 g/d的患者有12例(27.9%),>80 g/d的患者有31例(72.1%)。37例(86.0%)合并有肝硬化背景,20例(46.5%)患者伴有少量腹水,1例(2.3%)伴有中度腹水,22例(51.2%)无腹水。37例肝硬化患者中肝功能Child-Pugh分级A级21例(56.8%),B级15例(40.5%),C级1例(2.7%)。肿瘤标志物检测中,血清AFP正常的患者28例(65.1%),异常升高者15例(34.9%)。最大肿瘤直径1~15 cm,其中<5 cm的患者有25例(58.1%)。5例门静脉侵犯患者的门静脉癌栓分级均为 Ⅰ 级或 Ⅱ 级,无其他血管侵犯;3例淋巴结转移患者均是肝门部淋巴结转移,经整体评估后,选择手术切除是其最佳的治疗方案。BCLC分期中,A期27例(62.8%),B期8例(18.6%),C期7例(16.3%),D期1例(2.3%,进行消融治疗,肿瘤单发、无血管侵犯、肝外转移、淋巴结转移,Child-Pugh评分11分,分级C级, PST指数1~2分,其中Alb 24 g/L、TBil 63.4 μmol/L、腹水分级中度,无肝性脑病、凝血酶原时间正常。经14 d保肝、退黄,补充人血Alb、利尿以及营养支持治疗,患者胆红素下降至33 μmol/L,Alb 31 g/L,腹水基本消退,PST指数1分,Child-Pugh评分7分,分级B级)。
2.2 HDL-C与临床相关指标的关系 43例患者中HDL-C正常组(>0.91 mmol/L)、HDL-C异常组(≤0.91 mmol/L)的患者分别有26例(60.5%)、17例(39.5%)。前白蛋白(PAB)水平2组间差异有统计学意义(P<0.05)(表1)。
2.3 预后影响因素分析 Cox单因素分析发现,HDL-C、肿瘤数目、肿瘤大小为患者整体生存的危险因素(P值均<0.05),进一步多因素Cox进行逐步回归分析发现,与患者生存相关的独立危险因素有HDL-C水平、肿瘤数目、肿瘤大小(P值均<0.05)(表2)。
HDL-C正常组的1、3、5年累积生存率分别为88.5%、72.4%、55.7%,HDL-C异常组分别为70.6%、43.7%、17.5%,两组累积生存率差异有统计学意义(χ2=5.881,P=0.015)(图1)。

图1 2组患者生存曲线
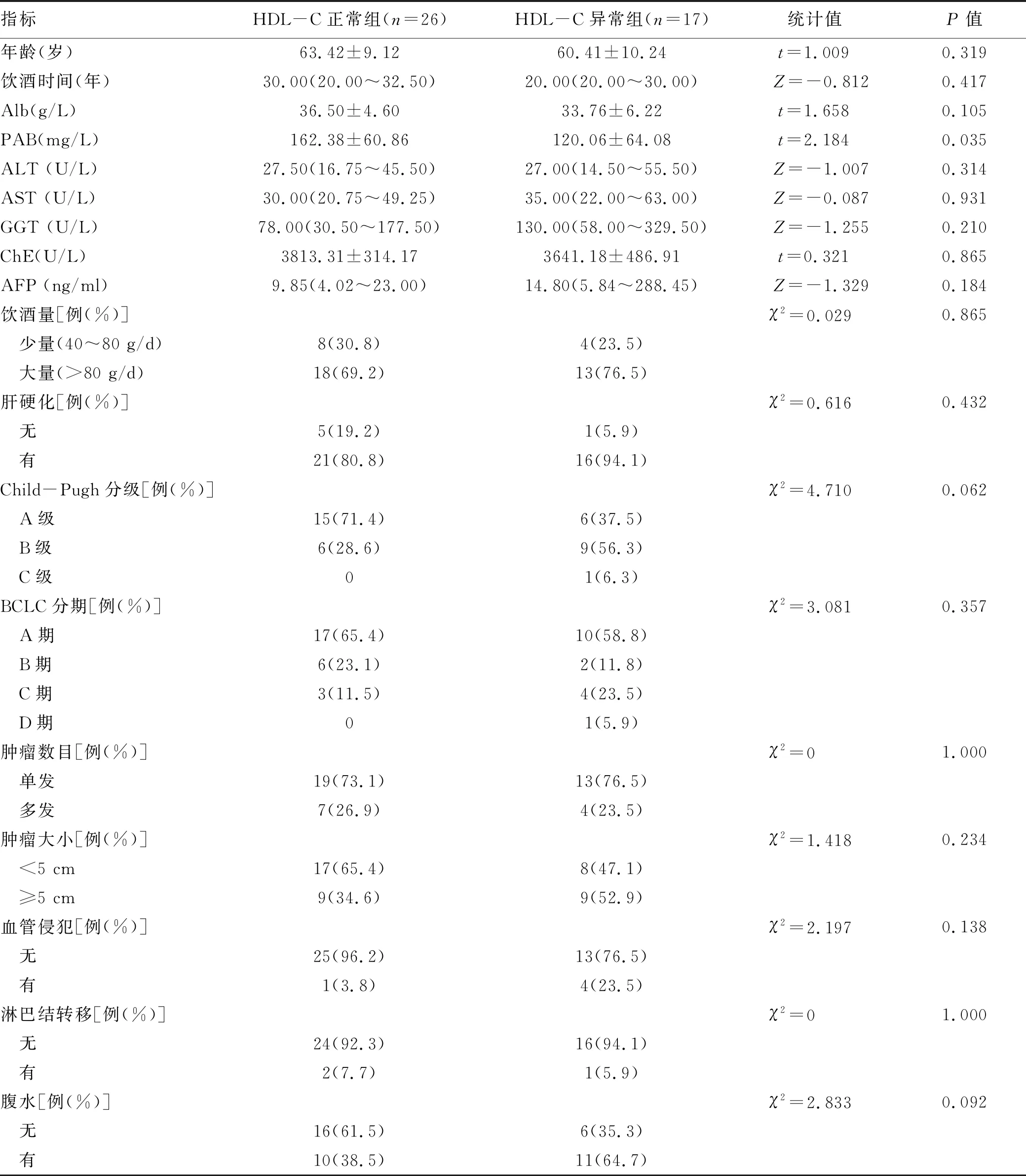
表1 2组临床相关指标的比较
3 讨论
肝脏是脂类及脂蛋白代谢的枢纽, 肝功能正常时可以通过代谢维持体内血脂和ChE代谢的相对平衡,同时肝脏也是合成代谢胆固醇的重要器官。胆固醇不仅是生物膜的重要成分,还可在体内合成各种类固醇激素,进而在机体的激素调节过程中发挥重要作用。胆固醇可分为总胆固醇、HDL-C和LDL-C三种。HDL-C主要在肝脏合成,是一种抗动脉粥样硬化的脂蛋白,可将胆固醇从肝外组织转运到肝脏进行代谢,由胆汁排出体外。肝脏发生癌变时,HDL-C合成减少,与肝脏实质细胞减少有关。但是HDL-C在HCC中的作用,尤其是酒精相关性HCC预后中的作用及机制,目前尚未报道。

表2 Cox单因素和多因素分析
本研究数据表明:酒精相关性HCC患者的平均年龄为62.23岁,高发年龄在50~70岁,而据医学统计发现,不分原因的HCC患者的高发年龄段在40~50岁[7],提示酒精相关性HCC的好发年龄相对较晚。并且与非酒精性HCC患者相比,酒精性HCC患者的总生存期更短,主要是因为患者在诊断时肝功能基础和肿瘤特征较差,但酒精诱导HCC发生、发展的机制仍需进一步研究[8]。
已有研究证实,HDL-C可以通过ABCG1提高癌细胞中胆固醇的清除水平,从而降低氧化应激和炎症反映,抑制肿瘤进展。同时,Apo-A1作为HDL-C的主要载脂蛋白,也可以通过胆固醇转运、抗炎和免疫调节等途径,抑制肿瘤的发生和发展[9],比如Apo-A1可以通过抑制脱脂转化酶诱导的血管内皮生长因子产生,来抑制肿瘤的进展[10]。ApoAM作为HDL-C的另一载脂蛋白,可与 1-磷酸鞘氨醇结合,降低HDL-C促进内皮细胞迁移和血管生成的作用,抑制肿瘤的发生与发展[11]。这些研究提示HDL-C降低导致肿瘤进展,不仅与HDL-C本身相关,还可能与其载脂蛋白具有密切关系。但具体在酒精相关HCC患者中HDL-C抑制肿瘤进展的详细分子机制仍需研究明确。
已有研究[12]表明,HCC患者肝细胞损害会导致血脂代谢异常,血脂水平可反映出肝脏脂类的代谢状况,对肝病的诊断、治疗以及预后具有一定的应用价值。一项前瞻性队列以及验证队列研究[13]发现,HDL-C水平的降低与肝衰竭的严重程度、疾病进展及短期生存预后密切相关。有研究[14-16]报道HCC患者血清LDL-C水平的降低与肝脏疾病加重密切相关,血清TC和Apo-A1水平降低可能提示HCC预后不良。有研究[17]发现,血清HDL-C的具体水平可以反映肝病患者的肝脏合成功能, 其水平越低,表示肝损伤越严重。本研究发现,HDL-C异常组患者PAB水平降低,证实在酒精相关性HCC患者中,HDL-C下降与更差的肝功能基础以及肝脏合成功能相关,该类患者伴有更严重的肝损伤,可能与预后不良相关。
大量研究表明,低水平的HDL-C和恶性肿瘤的发生发展及预后相关。有研究[18-20]发现低水平的HDL-C增加乳腺癌的患病风险,并且有研究[21]发现乳腺癌患者接受新辅助化疗前,高HDL-C水平与雌激素受体阳性乳腺癌患者较好治疗反应相关。然而,Ganjali等[22]表明,HDL-C水平与癌症风险之间的关系为非线性模式,性别、癌症类型和疾病分期也有影响。一项纳入1580例恶性肿瘤患者的病例对照研究[23]发现,肝癌、消化道恶性肿瘤、乳腺癌、妇科恶性肿瘤患者,HDL-C 水平随疾病严重程度的升高而降低。另有研究[24]发现,较低的HDL-C水平与神经内分泌免疫表型胃癌较高的分期或较大的肿瘤相关。回顾性分析结肠癌患者的术后无复发生存率发现,高水平的HDL-C增加结肠癌患者的无复发生存率[25]。一项回顾性分析[26]研究胆囊癌病例发现,低水平HDL-C患者的总体生存率降低,并且与肿瘤分期和远处转移呈正相关。一项日本的大型队列研究[27]表明,低HDL-C水平与HCC病死率升高正相关。一项Meta分析[28]表明,与HDL-C低水平患者相比,治疗前高水平HDL-C恶性肿瘤患者的总生存期及无病生存期均延长。已有研究[29]表明, HDL-C水平下降与接受手术治疗的HCC患者的总生存期和无病生存期的下降呈显著相关,因此低HDL-C水平的根治性切除HCC患者的预后较差;而另一项回顾性分析[30]却得到了相反的结论:HDL-C水平的降低能提高HCC患者的生存率。同时,另一项共纳入37项研究,涉及3 524 505例参与者的前瞻性队列研究[31]表明,较高和较低水平的HDL-C均与癌症的高病死率相关。因此,HDL-C对于肿瘤预后的影响仍有争议。考虑到研究纳入的HCC病例均主要以病毒相关性HCC为主,以及基础代谢疾病相关病死率的影响,HDL-C对于HCC的具体预后影响还有待进一步明确。本研究发现,在酒精相关性HCC人群中,更低的HDL-C水平往往提示更短的总生存期和更低的累计生存率,这可能与该类患者肝脏合成和代谢功能下降,以及肿瘤特性较差相关。
本研究经过初步探索分析表明,HDL-C水平是影响酒精相关性HCC根治术后患者生存的独立因素,可作为判断酒精相关性HCC患者预后的简易指标。但本研究样本量较少,要得出较为准确的结果,还需进一步扩大样本量或大数据进行补充,从而纳入更多的影响因素,证明本研究初步探索结果的可靠性。本研究虽首次具体探索性分析HDL-C对酒精相关性HCC患者预后的影响,其潜在的具体分子机制仍需进一步探索。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:张蕊负责课题设计,资料分析,撰写论文;赵志芹参与收集数据;常秀娟、程家敏、李茵茵、曾珍参与修改论文;陆荫英、曾珍负责拟定写作思路,指导撰写文章并最后定稿。

