原发性肝癌二级预防共识(2021年版)
中华医学会肝病学分会
为了规范原发性肝癌危险人群的有效预防、早期筛查及诊断,中华医学会肝病学分会组织国内有关专家,依据国内外原发性肝癌的病因学、发病机制、诊断技术、预防及治疗研究进展,尤其是适应中国国情的研究成果,制定《原发性肝癌二级预防共识(2021年版)》。本共识主要包括我国慢性肝病人群原发性肝癌的危险因素、监测与筛查、早期诊断及预防等。
原发性肝癌是目前我国常见恶性肿瘤及肿瘤致死病因,主要包括肝细胞癌(hepatocellular carcinoma,HCC)、肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)和HCC-ICC混合型3种不同病理学类型。三者在发病机制、生物学行为、组织学形态、治疗方法以及预后等方面差异较大,其中HCC占85%~ 90%。本共识中“原发性肝癌”仅指HCC。
HCC预防的目的是识别和消除促进慢性肝病发生发展的危险因素。本共识采用如下分级概念:一级预防是防止可导致HCC发生的危险因素对普通人群初始危害的措施;二级预防是针对患有慢性肝病人群,控制相关病因和危险因素并根据危险分层筛查及监测,以减少或延缓HCC发生的措施;三级预防是对已发生HCC的患者行根治性治疗后,进一步采取减少HCC复发、降低病死率和提高总体生存率的措施(图1)。

图1 HCC的三级预防目标人群及措施
中华预防医学会肿瘤预防与控制专业委员会、慢病预防与控制分会、健康传播分会联合制定了《中国肝癌一级预防专家共识(2018)》[1];国家卫生健康委员会颁布了《原发性肝癌诊疗规范(2019年版)》[2];中国临床肿瘤学会制定了《CSCO原发性肝癌诊疗指南(2018.V1)》[3];中华预防医学会肝胆胰疾病预防与控制专业委员会、中国研究型医院学会肝病专业委员会、中华医学会肝病学分会等发布了《原发性肝癌的分层筛查与监测指南(2020版)》[4]。随着基础及临床研究的进步,诊断技术的不断发展,原发性肝癌二级预防共识的制定将填补我国空白,为肝癌的防控提供重要依据。
本共识旨在帮助医师在HCC的预防、筛查及早期诊断中做出合理决策,但不是强制性标准,也不可能包括或解决慢性肝病人群HCC筛查和诊治中的所有问题。因此,临床医师在面对具体患者时,应根据最新的循证医学证据、自己的专业知识、临床经验及可利用的医疗资源,制订全面合理的慢性肝病管理与HCC监测方案。我们将根据国内外有关进展情况,继续对本共识进行不断修订和完善。本共识中的证据等级依据GRADE分级分为A、B、C 3个级别,推荐等级分为1级和2级(表1)。

表1 推荐意见的证据等级和推荐强度等级
1 术语
原发性肝癌:简称肝癌,指原发于肝细胞或肝内胆管上皮细胞的恶性肿瘤,主要包括HCC、ICC和HCC-ICC混合型3种不同病理学类型。本共识主要指HCC,其发病与肝炎病毒、肝硬化及饮食中黄曲霉毒素等有关。
危险因素:引起疾病发生或促使其发生概率增加的因素,包括病毒感染、个人行为、生活方式、环境和遗传等多方面因素,包括HBV感染、HCV感染、酒精摄入、非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)/代谢相关性脂肪性肝病(metabolic associated fatty liver disease,MAFLD)、自身免疫性肝病及遗传代谢性肝病、或伴发2型糖尿病(type 2 diabetes mellitus,T2DM)及黄曲霉毒素暴露等。
癌前病变:指具有癌变潜能的良性病变。HCC的癌前病变是指在慢性肝病背景下,因肝内组织结构和细胞形态的异型性,形成具有潜在恶变风险的异型增生结节(dysplastic nodules,DN),包括低度异型增生结节(low-grade dysplastic nodules,LGDN)和高度异型增生结节(high-grade dysplastic nodules,HGDN),两者的恶变风险依次增加。
早期HCC:单个癌结节直径≤5 cm或2~3个癌结节最大结节直径≤3 cm的HCC,无血管侵犯及肝外转移,可以获得根治性治疗。巴塞罗那肝癌临床分期(Barcelona clinic liver cancer staging system,BCLC)0~A期;中国肝癌临床分期(China liver cancer staging,CNLC)1a~1b期。
肝胆特异性MRI对比剂:可被肝细胞快速摄取及转运至细胞外,通过缩短组织氢原子的纵向弛豫时间(T1),在相对较短时间窗内进行肝脏血管成像、胆管成像,检出与定性诊断肝脏局灶性病变、评价肝功能。新型肝胆特异性MRI对比剂包括钆塞酸二钠(gadolinium-ethoxybenzyl-diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)和钆钡葡胺(Gadobenate dimeglumin,Gd-BOPTA)。
HCC常规筛查:根据慢性肝病HCC危险分层,采用常规腹部超声及血清甲胎蛋白(alpha-fetoprotein,AFP)或联合AFP异质体3(lens culinaris agglutinin-reactive fraction of AFP,AFP-L3)、异常凝血酶原(des-gamma-carboxy prothrombin,DCP / protein induced by vitamin K absence or antagonist Ⅱ,PIVKA-Ⅱ)等筛查与监测HCC发生的方法。
HCC加强筛查:根据慢性肝病HCC危险分层及常规筛查发现,采用肝CT及MRI平扫和多期相动态增强成像筛查与监测HCC发生的方法。
2 流行病学
世界卫生组织国际癌症研究署2020年12月发布了全球最新癌症负担数据(Globocan 2020)[5],原发性肝癌发病率居恶性肿瘤第6位,新增90.6万例;死亡率居第3位,共计83万例,年龄标化后发病率(age-standardized incidence rate,ASIR)分别为男性14.1/10万、女性5.2/10万,总体死亡率为8.7/10万。亚洲新增65.7万例,死亡60.9万例,分别占全球72.5%和73.3%。我国2020年原发性肝癌发病率居恶性肿瘤第5位,新增41万例,其中男性30.3万例,ASIR分别为男性27.6/10万、女性9.0/10万;死亡率居第2位,死亡39.1万例,死亡率为17.2/10万。近5年全球原发性肝癌平均年发病例数为99.5万例,亚洲73.2万例,占全球73.6%,中国42.3万例,占全球42.5%。
全球HCC发病平均年龄存在地区差异,亚洲和非洲国家发病年龄多为30~60岁,HCC- BRIDGE研究[6]分析14个国家18 031例HCC患者中日本、欧洲和北美平均发病年龄分别为69、65和62岁,中国、韩国平均发病年龄为52和59岁。我国一项纳入2016年—2018年14 891例HCC的研究[7],≤39岁、40~49岁、50~59岁、60~69岁和≥70岁患者比例依次为2.89%、14.59%、29.47%、35.26%和17.79%;男女患病比例为76.01%和23.99%。尽管近年我国HCC人口标准化发病率和死亡率呈现下降趋势,但由于人口基数大、老龄化等因素,HCC疾病负担仍较为严重。
HCC的二级预防旨在早期发现、早期诊断,提高根治率及长期生存率。日本及中国台湾实施乙型肝炎、丙型肝炎人群肝癌筛查计划,在确诊的HCC患者中早期(BCLC分期0~A期)分别为60%~73%和70%,中晚期(BCLC分期C~D期)分别为13%和18%[6,8]。中国大陆地区,BCLC分期为0期、A期、B期、C期和D期的HCC诊断构成比依次为3%、30%、9%、55%和2%,总体生存期23个月,5年生存率仅为11.7%~14.1%[6,9],亟需实施规范化二级预防措施。
3 HCC的病因及危险因素
各种原因导致的肝硬化是HCC发生的主要危险因素。我国HCC病因构成以慢性HBV感染为主,约占86%[10];其他病因包括慢性HCV感染,长期过量饮酒所致酒精性肝病(alcohol-related liver disease,ALD)、NAFLD及伴发T2DM、长期食用黄曲霉毒素污染的食品等。
3.1 肝硬化 我国约有700万人(0.51%)患有肝硬化[11],其HCC的年发病率为1%~8%。不同病因肝硬化HCC 5年累积发病率依次为HCV感染30%、HBV感染15%~17%、酒精性肝硬化8%、原发性胆汁淤积性肝硬化为4%[12]。据世界卫生组织[13]估计,2015年全球有39.9万人死于HCV感染引起的肝硬化或HCC。我国肝硬化和HCC患者中,由HBV所致者分别为77%和86%[10]。接受抗病毒药物治疗的HBV相关肝硬化患者HCC年发病率仍达1.5%~2.5%[14]。HBV/HCV合并感染所致肝硬化HCC发生风险为HBV相关肝硬化的1.92~2.04倍。欧洲酒精性肝硬化HCC年发病率达2.9%[15],高龄、男性、高基线AFP和胆红素水平为酒精性肝硬化患者HCC发生的独立危险因素[16]。非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)相关肝硬化7年HCC累积发病率为2.4%[17]。自身免疫性肝炎肝硬化8年HCC累积发病率为0.5%[18]、Wilson病肝硬化HCC年发病率为0.14%[19]。一项2079例多病因肝硬化队列[20]随访10年,NASH相关肝硬化和自身免疫性肝硬化患者10年累积HCC发病率分别为16.3%和4.6%。
3.2 慢性HBV感染 据世界卫生组织[21]报道,全球约有2.57亿慢性HBV感染者。目前我国普通人群血清HBsAg阳性率为5%~6%,慢性HBV感染者约7000万例,其中慢性乙型肝炎(chronic hepatitis B,CHB)患者约2000万~3000万例,HBV感染者发生HCC风险为非感染者的15~20倍。HBV DNA高水平复制[22]、HBV基因型(C>B)与HCC发生有关[23]。年龄>40岁、男性、亚裔、有HCC家族史等为HCC发生的高危因素,对比40岁以下人群,40~49岁风险增加3.6倍,50~59岁增加5.1倍,≥60岁增加8.3倍,男女风险比约为3∶1,有2个以上家族成员发生HCC者风险增加5.6倍[8,24-25]。亚洲不同地区HBV感染者发生HCC风险为无感染者10~65倍[26]。15%~40%CHB会进展为肝硬化和HCC[27]。东亚地区成人HBV免疫耐受期、CHB、乙型肝炎肝硬化患者HCC的5年累积发病率依次为1%、3%和17%[28]。
3.3 慢性HCV感染 HCV感染呈世界性流行,全球慢性HCV感染者7100万人,我国约有1000万人(0.72%)[29]。慢性HCV感染者HCC发生风险为非感染者5~20倍[20,30],HCC发病率随着HCV相关肝纤维化的进展呈递增趋势,肝纤维化1~4期HCC年发病率依次为0.5%、2.0%、5.3%和7.9%[31]。基因1b型HCV感染者HCC发病风险为其他基因型HCV感染者的1.78倍[32]。
3.4 ALD 我国ALD患病率中位数为4.5%(2.3%~6.1%),约6200万例[33]。大量饮酒者HCC发生风险为非饮酒者的2.07倍,少量饮酒者HCC发生风险亦较非饮酒者增加[15,34]。戒酒可使HCC发生风险每年降低6%~7%,酒精所致HCC风险需经约23年清除期才能达到与非饮酒者相同[35]。每天饮酒含乙醇量25 g、50 g、100 g者较不饮酒者HCC风险依次增加1.19、1.40、1.81倍[36]。HBV或HCV感染者饮酒含乙醇量超过80 g/d,HCC风险增加53.9倍;饮酒含乙醇量超过80 g/d的糖尿病患者HCC风险增加9.9倍[37]。
3.5 NAFLD、代谢综合征及肥胖 NAFLD已成为全球流行率最高的慢性肝病,鉴于其与超重或肥胖、糖脂代谢紊乱关系密切,国际专家小组建议更名为MAFLD,亚太肝病学会已制定相关临床实践指南[38]。我国普通人群患病率为15% (6.3%~27.0%),即1.73亿~3.38亿例[29]。NAFLD相关HCC发病率为0.44/1000人年[39]。合并肥胖、T2DM、高血压病、血脂异常时,HCC发生风险增加8.1倍[40]。慢性丙型肝炎(chronic hepatitis C,CHC)伴肥胖者(身体质量指数≥30 kg/m2)HCC风险为非肥胖者的4.13倍,伴T2DM者风险增加3.52倍;CHB伴T2DM者HCC风险为非糖尿病患者的2.27倍,HBV/HCV合并感染伴有肥胖及T2DM,HCC发生风险上升100倍以上[41]。
3.6 致癌物暴露 黄曲霉和寄生曲霉产生的次代谢产物黄曲霉毒素B1有强致癌作用。黄曲霉毒素高暴露地区通常也为HBV流行区域,HBV和黄曲霉毒素同时暴露人群HCC风险增加73倍[42]。
3.7 癌前病变 HCC的癌前病变常发生在慢性肝病基础上,多见于肝硬化患者。日本学者[43]报告,肝硬化增生结节、LGDN及HGDN(称为癌前病变)1、3、5年HCC累积发病率分别为3.3%、9.7%和12.4%,2.6%、30.2%和36.6%及46.2%、61.5%和80.8%,LGND、HGND患者HCC的年发病率分别约为10%、20%。
推荐意见1:任何病因所致肝硬化都有发生HCC的风险,乙型肝炎肝硬化是我国HCC的主要病因,是筛查的重点监测人群(A1)。
推荐意见2:多种病因或危险因素叠加(如慢性HBV或HCV感染合并ALD、NAFLD,合并T2DM或代谢综合症等)可显著增加HCC发生风险,此类人群应密切监测HCC的发生(B1)。
推荐意见3:经影像学证实的癌前病变[LGND及HGND,LI-RADS(肝脏影像报告和数据管理系统)4级]为HCC发生的极高风险人群,应严密监测结节增长及性质变化(B1)。
4 HCC的危险人群
HCC的发生发展与持续肝脏炎症、修复与纤维组织增生以及肝细胞异常增生有关。目前欧美各国关于肝癌诊治指南中,对HCC高危人群的定义存在差异,本共识结合我国HCC发病原因、流行病学特征及循证医学证据,按HCC发生的风险等级,将危险人群进行了分层,据此建立相应的监测方案。
(1)低危人群:年龄<30岁,各种原因所致慢性肝病的早期及稳定期,无明显肝脏炎症和纤维化,包括慢性非活动性HBsAg携带者、乙型肝炎免疫控制期、单纯性脂肪肝,及Gilbert综合征、Dubin-Johnson综合征、良性复发性肝内胆汁淤积等良性遗传代谢性肝病患者。
(2)中危人群:年龄>30岁的CHB患者(无肝癌家族史,无长期酗酒、吸烟、明确接触致癌毒物史、无合并糖尿病或肥胖者),CHC、ALD、NASH、自身免疫性肝病或Wilson病等慢性肝病活动期的患者。
(3)高危人群:具有下列任何1项。①各种原因所致的肝硬化,包括HBV感染、HCV感染、ALD、NAFLD、药物性肝损伤、自身免疫性肝病、Wilson病等疾病导致的肝硬化患者;②年龄≥30岁的CHB患者有肝癌家族史,或长期酗酒、吸烟、明确接触致癌毒物史、合并糖尿病或肥胖。
(4)极高危人群:高危人群伴有下列1项或多项。①超声等影像学检查发现肝内疑似癌前病变或非典型占位性病变;②血清AFP≥20 ng/ml,伴或不伴DCP≥40 mAU/ml及/或AFP-L3≥15%;③影像学或肝组织病理学证实的肝脏异型增生结节。
除此之外,为准确预测慢性肝病患者HCC发生风险,已有多种多参数模型建立及应用研究,包括预测不同病因肝硬化HCC发生风险的THRI(多伦多HCC风险指数,Toronto HCC risk index)[20]、HBV相关AGED、REACH-B及抗病毒治疗后风险预测的PAGE-B、SAGE-B、CAMD模型,预测HCV、ALD或NAFLD相关肝硬化HCC风险模型(计算网址:www.hccrisk.com)[44-48],适于多病因HCC风险分析aMAP模型等,可进一步依据患者人群进行分层管理,以提高HCC早期筛查及诊断率,建议参照《原发性肝癌的分层筛查与监测指南(2020)》[4]。
5 原发性肝癌的二级预防措施
5.1 早期筛查与诊断 根据HCC血清标志物水平、影像学检查综合评估与监测HCC发生及分期,必要时肝穿刺活组织学检查确定结节性质、分化程度、基因表达情况等。
5.1.1 血清标志物
5.1.1.1 AFP AFP 于1964年在肝癌血清中被检出,常规应用于HCC筛查和临床诊断,诊断各期HCC灵敏度58.6%~77.5%,特异度80%~97.4%,诊断早期HCC的灵敏度为45.3%~62%,特异度为87%~93%[49-51]。但随着医学影像学的快速发展,小肝癌诊断比例不断增加,AFP的灵敏度逐步下降,30%~40%HCC患者AFP持续在正常或较低水平。2011年美国肝病学会HCC诊疗指南[52]不再将AFP作为HCC的筛查指标。由于我国HCC病因多为乙型肝炎,AFP作为HCC早期筛查手段仍有重要意义。对血清AFP正常或轻度升高的HCC高危人群,需动态观察并结合肝生化学、影像学及肝穿刺活组织学检查结果综合评估。
5.1.1.2 DCP/PIVKA-Ⅱ DCP/PIVKA-Ⅱ是肝脏合成的无凝血活性的异常凝血酶原。1984年Liebman等首先发现HCC患者血清DCP明显升高,提出其可能是诊断HCC的新型肿瘤标志物。近年研究[49]报道,PIVKA-Ⅱ≥40 mAU/ml诊断早期HCC的灵敏度和特异度分别为64%和89%,准确度为86.3%。
5.1.1.3 AFP-L3 AFP-L3是主要来源于肝癌细胞的一种糖蛋白,不受AFP水平影响。2005年,美国食品药品监督管理局批准AFP-L3作为HCC筛查指标,AFP-L3≥10%为诊断HCC界值。研究[53-54]报道,34.3% AFP正常HCC患者确诊1年前即可出现AFP-L3异常。荟萃分析[55]显示,AFP-L3诊断HCC的灵敏度和特异度分别为48.3%(45.9%~50.7%)和92.9%(91.6%~94.0%)。联合检测AFP及AFP-L3可提高早期HCC的诊断率。
5.1.1.4 其他标志物 糖类抗原199与AFP、癌胚抗原联合检测可提高HCC诊断率[56]。此外,有多种处于探索阶段的新型血清学分子标志物,如磷脂酰肌醇蛋白聚糖-3、高尔基体蛋白73、α-L-岩藻糖苷酶、骨桥蛋白、微小 RNA、循环肿瘤细胞、循环肿瘤DNA、外泌体及循环肿瘤DNA甲基化等,在诊断HCC上有其特定的优势,但也存在一定的局限性,单独检测上述一种标志物尚不能达到理想的诊断目标,不同标志物的联合检测可能是提高HCC早期检出率的有效措施,但尚需进一步研究。
推荐意见4:AFP仍为筛查早期HCC的首选血清学指标(A1),与PIVKA-Ⅱ和AFP-L3联合检测,可提高早期HCC的诊断率(B2)。
推荐意见5:血清AFP阴性或轻度升高者,在动态观察的基础上联合检测PIVKA-Ⅱ和AFP-L3等可以提高HCC早期诊断率(B2)。
5.1.2 影像学检查
影像学检查是HCC筛查和诊断的重要手段。常用影像学检查方法包括腹部常规超声、超声造影(contrast-enhanced ultrasonography,CEUS)、CT、MRI、数字减影血管造影(digital subtraction angiography,DSA)、正电子发射计算机断层显像(positron emission tomography,PET)及PET/CT等。不同影像学方法对于评估肝脏局灶性病变具有各自的优劣势(图2)。CT和MRI常用于超声初筛异常时的确诊检查。
5.1.2.1 腹部常规超声 腹部超声检查易于开展、操作简便、无创、可反复多次使用,是最常用的HCC筛查和检测手段,对直径>2 cm的肝脏占位性病变灵敏度较高,其灵敏度随肿瘤体积增大而增加。超声对临床各期HCC的诊断总体灵敏度约为84%,但对早期 HCC 的灵敏度为32%~63%,特异度为91%~95%,联合AFP后灵敏度可增至70%[57-60]。
5.1.2.2 肝脏CEUS CEUS典型表现为“快进快出”,动脉相均匀或不均匀增强,门脉相和延迟相为低回声甚至无回声。Gaiani等[61]报道,CEUS 的HCC诊断率约为 91.3%。另有学者[62]报道,CEUS诊断HCC的灵敏度、特异度和准确度分别为95.3%、100%和98.1%,诊断早期HCC的灵敏度为80%~94%,特异度为82%~98%,诊断小肝癌(≤2 cm)灵敏度为63%~70%,特异度为89%~93%[63-64]。
5.1.2.3 肝脏CT CT平扫可发现直径>1 cm实性肿瘤。HCC典型CT 征象:平扫较正常肝脏密度低,动脉期明显强化呈高密度,随造影剂流出密度快速降低,门静脉期和/或平衡期肿瘤强化低于肝实质,即“快速流入、快速洗出”特征[65-66]。增强CT诊断HCC灵敏度为66%~79%,特异度90%~94%[67-68]。

图2 肝脏再生结节、异型增生结节及HCC的影像学特征示意图
5.1.2.4 肝脏MRI MRI软组织对比分辨率高,多参数、多方位、多序列成像,对肝脏结节诊断和鉴别诊断的灵敏度和准确度均高于CT。常规细胞外液造影剂增强MRI诊断早期HCC的灵敏度为84%~90%,特异度为83%~94%[67-69]。HCCMRI典型表现:长Tl长T2信号,动态增强扫描可见动脉期明显强化或不均匀强化,门脉期和/或延迟期造影剂迅速廓清呈等信号或低信号,部分患者可见肿瘤周边假包膜影像,扩散加权成像(diffusion-weighted imaging,DWI)序列为高信号病灶[70-71]。肝细胞特异性对比剂增强MRI可提高HCC早期诊断率,Gd-EOB-DTPA和Gd-BOPTA肝细胞摄取率分别为50%和5%,肝胆特异期因肿瘤不摄取对比剂呈现低信号肿块,显影时间分别为20~40 min和40~120 min,Gd-EOB-DTPA应用比较广泛[72-73]。
Gd-EOB-DTPA增强MRI 诊断小肝癌(≤2 cm)的灵敏度和特异度分别为90%~96%和87%~96.6%[67,74],并可发现直径≤1.0 cm肝癌,灵敏度69%~83%,特异度46%~93%[75-76],结合DWI可鉴别肝硬化结节、LGDN、HGDN和早期HCC。当肝脏CT 发现动脉期富血供病灶,而门脉期及延迟期廓清不显著、非典型HCC 时,Gd-EOB-DTPA 增强MRI 能够帮助进行定性诊断[76]。Renzulli等[75]报道,Gd-EOB-DTPA增强MRI诊断早期HCC的灵敏度、特异度和准确度分别为96%、91.8%和93.9%,诊断HGDN的灵敏度、特异度和准确度分别为94.7%、99.3%和97%。
5.1.2.5 PET及PET/CT PET/CT同时获得PET功能代谢图像和CT解剖图像,优势互补,能更准确地对病灶定位与定性。但由于肝脏本身代谢活跃,PET/CT诊断肝癌灵敏度仅55%[77],不推荐作为HCC筛查及早期诊断的方法,可用于评估淋巴结转移及远处器官转移的情况。
5.1.2.6 DSA DSA对肝内小肿瘤的诊断与鉴别诊断有意义,可显示肝肿瘤染色及血管情况,明确肿瘤数目、大小及血供情况,为肝肿瘤与重要血管解剖关系、血管解剖变异、门静脉浸润提供准确而客观的信息[78]。
5.1.3 肝穿刺活组织学检查 肝穿刺活组织学检查适用于缺乏典型影像学特征的肝内结节,有助于明确病灶性质、鉴别局灶增生性结节等良性增生性病变与早期HCC,并可明确其分子表型[79],指导治疗和判断预后。
5.2 肝硬度及储备功能评估 HCC风险因素评估是早期发现和预测疾病发生发展的重要措施,疾病进展程度、肝储备功能、有无合并其他疾病、免疫状态等均与HCC的发生有关,每3~6个月监测血常规、肝生化指标、血脂及血糖水平、凝血功能及肝纤维化进展情况。肝储备功能反映肝损伤程度,MELD≥10分的患者超声诊断早期肝癌的灵敏度为60%,低积分者仅为18.8%[58]。肝瞬时弹性成像所检测肝硬度值(liver stiffness measurement,LSM)、FIB-4指数有助于预测HCC发生风险。韩国研究[80]报道,慢性HBV感染者LSM介于8.1~13 kPa、13.1~18 kPa、18.1~23 kPa和>23 kPa发生HCC风险依次增加3.07、4.68、5.55和6.60倍。中国台湾HCV感染者中,LSM<12.0 kPa、12.0~24.0 kPa及>24.0 kPa患者HCC的5年累积发病率依次为0.9%、9.5%和45.1%[81]。NAFLD患者FIB-4为1.30~2.67(中度肝纤维化)和>2.67(重度肝纤维化/肝硬化)较FIB-4<1.3(无明显纤维化)患者发生HCC风险依次增加3.74和25.2倍[82]。因此,准确评价肝纤维化程度对预测HCC发生风险有一定临床价值。
推荐意见6:常规腹部超声检查是HCC危险人群监测的主要影像学手段,可发现>2 cm的肿瘤及结节;CEUS可辅助鉴别肿瘤性质(A1)。
推荐意见7:肝脏CT平扫及增强为早期发现、早期诊断HCC的重要影像学方法之一,可用于直径>1 cm结节的鉴别诊断及监测(A1)。
推荐意见8:多模式MRI(平扫、DWI及增强)是诊断HCC最敏感的影像学方法,可发现直径≤1 cm肿瘤,用于结节性肝硬化的HCC筛查、鉴别超声发现的可疑结节性质。肝细胞特异性对比剂Gd-EOB-DTPA增强MRI可提高直径≤1 cm HCC的检出率,对于鉴别良性增生结节、癌前病变和早期HCC具有重要临床应用价值(A1)。
推荐意见9:肝储备功能及肝硬度准确评估对预测慢性肝病HCC发生风险有一定参考价值(C2)。
5.3 肝癌筛查与监测 随着慢性肝病患者年龄增长,HCC发生风险逐渐增大,2007年—2017年全球肿瘤年报显示,中国大陆为增幅最大地区之一,年均增长超过2%。规范筛查与监测是早期发现、早期诊断及根治HCC的关键。我国学者[83]早在1997年报道,慢性HBV感染等慢性肝病8109例,每6个月采用腹部超声及血清AFP筛查,所发现的HCC中76.8%为早期,其中70.6%行根治性手术,1、2年生存率分别为88.1%和77.5%;非筛查组所诊断HCC均为晚期,生存期均≤1年。上海复旦大学中山医院肝癌研究中心[84]的18 816例CHB患者采用上述方法筛查,每6个月1次,随访5年,研究结束时仅60%患者完成筛查方案,筛查组87例HCC患者1、2和5年生存率依次为65.9%、52.6%和46.4%,对照组分别为31.2%、7.2%和无生存;肝癌相关死亡率分别为83.2/10万和131.5/10万,死亡风险为 0.63∶1。日本慢性肝病高危人群(肝硬化)每3~4个月采用超声、AFP、AFP-L3及PIVKA-Ⅱ联合筛查173 378例,极高危人群每6~12个月采用Gd-EOB-DTPA增强MRI或多层螺旋CT 加强筛查,早期HCC诊断率达62%,5年生存率42.7%[85]。
美国放射学院2018年提出一个规范肝脏影像图像采集、解释、报告及数据收集的综合管理系统——LI-RADS[86],适用于成年人CHB及肝硬化患者的HCC筛查、监测及诊断,LR-1为肯定的良性结节,LR-2为直径<20 mm实性结节且无HCC征象,LR-3中度可能为恶性肿瘤,LR-4可能为HCC,LR-5确诊HCC,LR-M可能或肯定为恶性肿瘤或非典型HCC。监测2年肝脏结节分级稳定者多为良性病变。
依据慢性肝病患者HCC危险分层,建议常规筛查采用腹部超声及血清AFP,低危人群每年1次,中危人群每6个月1次;高危人群常规筛查每3~6个月1次,多模式MRI或CT加强筛查每6~12个月1次;极高危人群常规筛查每3个月1次,加强筛查每6个月1次。腹部超声发现肝内≤1 cm结节,每3个月复查1次,结节增长>1 cm或伴AFP>20 ng/ml,应启动肝癌加强筛查流程,优选Gd-EOB-DTPA增强MRI。如影像学检查难以确定结节性质,考虑诊断性肝穿刺活组织学检查(图3)。
推荐意见10:腹部超声联合AFP为慢性肝病患者HCC常规筛查方法,多模式肝脏MRI和/或CT为加强筛查方法。低危人群每年1次常规筛查,中危人群每6个月1次常规筛查(C1);高危人群每3~6个月1次常规筛查(A1),每6~12个月1次加强筛查(B2);极高危人群每3个月常规筛查1次,每6个月加强筛查1次(B1)。
推荐意见11:监测过程中腹部超声发现<1 cm 结节,3个月复查1次,结节增长或结节>1 cm且AFP > 20 ng/ml应启动肝癌加强筛查流程。影像学检查不能确定结节性质者,可考虑在影像引导下行诊断性肝穿刺活组织学检查(C1)。
5.4 肝癌相关疾病治疗与干预
5.4.1 病因治疗
5.4.1.1 慢性HBV、HCV感染的抗病毒治疗 核苷(酸)类似物(NAs)和聚乙二醇干扰素-α(PEG-IFNα)是慢性HBV感染抗病毒治疗的两大类药物。慢性HBV感染患者接受IFNα治疗后HCC发生风险显著降低(相对风险比=0.66),在肝硬化患者中效果更为显著(相对风险比=0.53)[87]。台湾临床队列研究[88]结果提示,NAs治疗可以降低慢性HBV感染者HCC发生风险(风险比=0.37)。经抗病毒治疗后即使HBsAg消失,年龄>50岁、男性和肝硬化仍是发生HCC的高危因素[89]。慢性HBV感染的抗病毒治疗参照中华医学会感染病学分会及肝病学分会《慢性乙型肝炎防治指南(2019年版)》[90]。
CHC抗病毒治疗已进入以索磷布韦、维帕他韦为代表的泛基因型直接作用抗病毒药物(direct-acting antiviral,DAA)时代。DAA治疗可以降低慢性HCV感染者HCC发生风险(校正风险比=0.66)[91]。丙型肝炎肝硬化患者经过DAA治疗获得持续病毒学应答(sustained virological response,SVR),HCC发生率仍显著高于获得SVR的非肝硬化患者(风险比=4.73),DAA治疗获得SVR的肝硬化人群HCC年发病率仍>1.5%[92-94]。因此,丙型肝炎肝硬化患者DAA治疗获得SVR后仍需监测HCC发生。慢性HCV感染的抗病毒治疗参照中华医学会肝病学分会及感染病学分会《丙型肝炎防治指南(2019年版)》[95]。
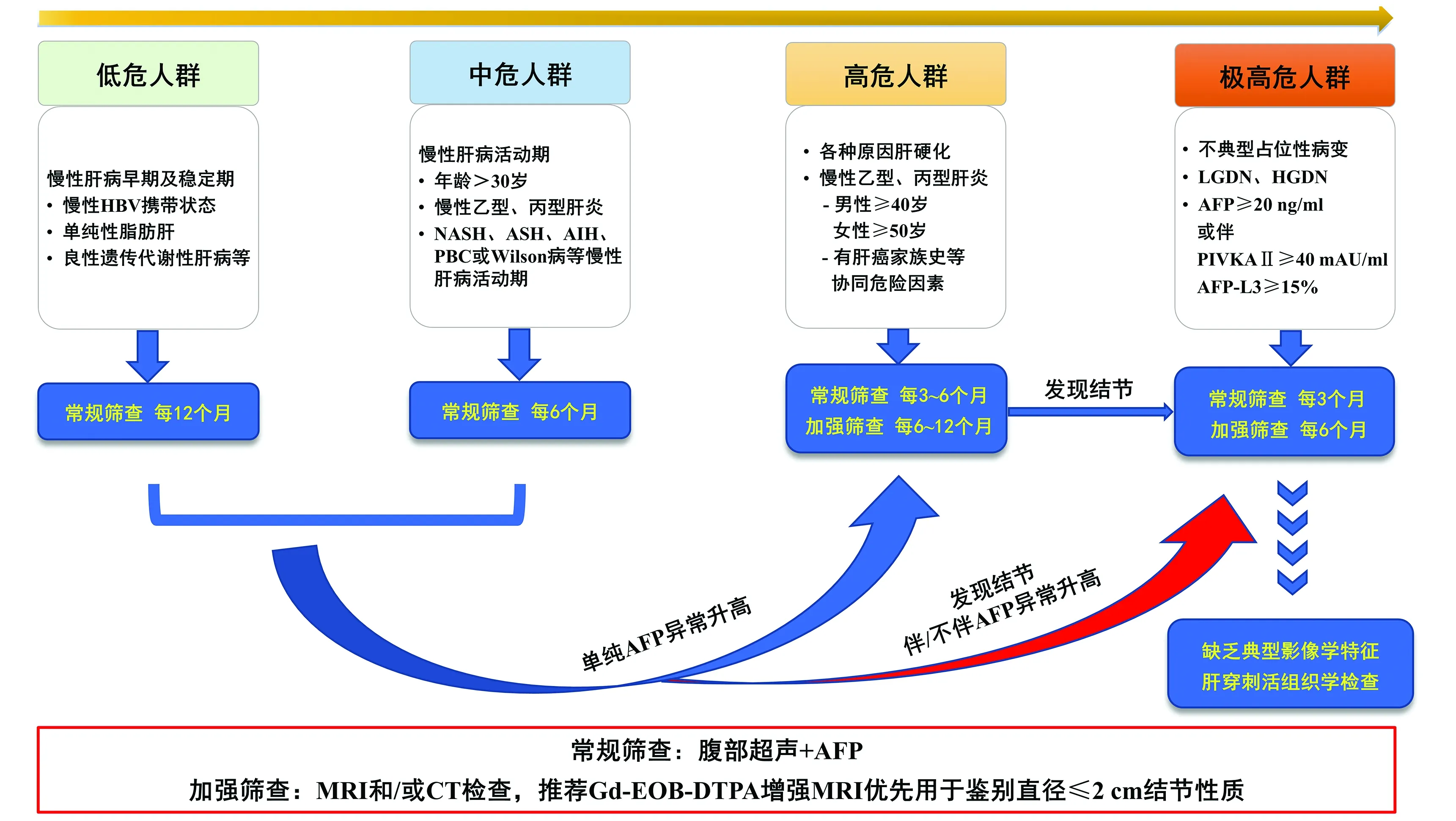
注:ASH,酒精性肝炎;AIH,自身免疫性肝炎;PBC,原发性胆汁性胆管炎。
5.4.1.2 ALD 戒酒是ALD最主要和最基本的治疗措施[96]。戒酒可减轻肝组织学损伤、延缓纤维化进程、提高ALD患者生存率。ALD患者戒酒后HCC风险每年下降6%~7%[35]。 ALD治疗参照中华医学会肝病学分会《酒精性肝病防治指南(2018更新版)》[97]。
5.4.1.3 NAFLD 至今尚无有效药物可推荐用于NAFLD患者HCC的预防。依据中华医学会肝病学分会《非酒精性脂肪性肝病防治指南(2018年版)》, NAFLD患者通过改变不良生活方式、增加有氧运动等措施控制体质量、减少腰围,纠正脂质代谢紊乱,减轻肝脏炎症及纤维化,可降低HCC发生风险[98-100]。
5.4.1.4 糖尿病 慢性肝病合并T2DM患者,采取个体化生活方式干预及降糖药物治疗,严格控制血糖水平。T2DM治疗参考《中国2型糖尿病防治指南(2017年版)》[101]。研究[102]表明,二甲双胍可显著降低慢性肝病合并糖尿病患者HCC的发病风险(比值比=0.16)。
5.4.1.5 改善生活环境 降低居民黄曲霉毒素的暴露水平可显著降低全人口HCC发病率和死亡率。黄曲霉毒素已暴露人群,吡噻硫酮和叶绿酸都具有保护作用[103-104]。
5.4.2 抗炎和抗纤维化治疗 根据不同病因肝脏炎症的特点和药物功能选择抗炎保肝药物,可减少疾病进展[105]。复方861冲剂、益气活血方、扶正化瘀胶囊、安络化纤丸、复方鳖甲软肝片等中药复方在临床应用中具有一定的抗肝纤维化作用[106-110],但在减少HCC风险方面尚需开展更多临床研究。
推荐意见12:CHB患者采用NAs或PEG-IFNα抗病毒治疗,CHC患者采用DAA治疗并获得SVR,可降低HCC风险,但不能完全消除,尤其对于已进入肝硬化阶段患者,获得病毒学应答后仍需按筛查流程监测HCC的发生(A1)。
推荐意见13:戒酒可降低ALD患者HCC风险(A1)。
推荐意见14:NAFLD患者应通过改变不良生活方式、增加有氧运动等措施控制体质量和防治代谢紊乱以降低HCC风险(B1)。
推荐意见15:慢性肝病合并T2DM增加HCC风险,应严格监测及控制血糖水平(B1)。
6 尚待研究和解决的临床问题
(1)筛查与诊断早期HCC的高灵敏度和特异度血清学标志物;
(2)丙型肝炎肝硬化患者DAA治疗后HCC发生风险;
(3)抗病毒联合中/西药抗纤维化治疗慢性病毒性肝炎预防HCC的多中心临床研究;
(4)复方中药治疗非病毒性肝病相关肝硬化降低HCC风险的临床研究;
(5)抗病毒与免疫调节药物联合治疗降低乙型和丙型肝炎相关HCC风险研究;
(6)CHB、CHC合并NAFLD、ALD的HCC累积发病率;
(7)消除代谢相关脂肪性肝病病因对HCC发生率的影响;
(8)实施肝癌筛查计划的卫生经济学评价。
执笔专家(按撰写内容排序):
南月敏 高沿航 王荣琦 李文刚 赵素贤 杨 明
编写与讨论专家(按姓氏拼音排序):
丁惠国 段钟平 范建高 房勤茂 高沿航 胡 鹏 贾继东
李文刚 刘景丰 南月敏 牛俊奇 尚 佳 王荣琦 魏 来
谢传淼 谢 雯 徐小元 杨 明 于岩岩 张玉果 赵素贤
赵卫峰 周 俭 庄 辉
利益冲突:所有作者均声明不存在利益冲突。
志谢:中华医学会肝病学分会及肝癌学组全体专家对本共识的支持与建议。

