下瘀血汤抑制胶质细胞源性神经营养因子抗肝纤维化的作用机制
张 玮, 杨广越, 沈东晓, 马文婷, 陶 乐, 吴 柳, 严 萍, 刘 成
上海中医药大学附属普陀医院 a.实验中心肝病实验室, b.感染科, 上海 200062
肝纤维化是机体对多种慢性损伤的一种修复应答,以细胞外基质过度沉积为特征[1],可发展为肝硬化导致严重并发症[2],包括门静脉高压、肝衰竭和肝细胞癌[3]。胶质细胞源性神经营养因子(glial cell-derived neurotrophic factor,GDNF)是TGFβ超家族成员[4],课题组前期发现GDNF通过ALK5/Smad信号促进肝星状细胞(HSC)活化和肝纤维化[5],因此抑制GDNF可能是抗肝纤维化的新靶点。
下瘀血汤出自汉·张仲景《金匮要略》,由大黄、桃仁、土鳖虫3味中药组成,三药合用共奏活血化瘀之功,课题组前期用其治疗肝纤维化取得了良好的临床疗效[6],并发现下瘀血汤抗肝纤维化主要通过抑制NF-κB和TGFβ1/Smad信号通路[7];减少肠上皮细胞凋亡,减轻紧密连接的破坏而抑制肝纤维化进展等[8]。但下瘀血汤是否能通过调控GDNF来抗肝纤维化还需要进一步探究。本文采用CCl4诱导的小鼠肝纤维化模型,以肝纤维化过程中GDNF表达及功能为切入点,观察下瘀血汤通过抑制GDNF来抗肝纤维化的效应机制。
1 材料与方法
1.1 材料
1.1.1 动物 雄性C57BL/6小鼠,清洁级,18~20 g,购自上海斯莱克实验动物公司,生产许可证号:SYXK(沪)2017-0005。小鼠饲养于上海中医药大学附属普陀医院实验动物中心,使用许可证号:SYXK(沪)2018-0032。饲养室环境温度为(22±1)℃,相对湿度为30%~60%,12 h光照/12 h黑暗,自由进食和饮水。
1.1.2 细胞 GFP-Col-HSC细胞由美国加州大学圣地亚哥分校Ekihiro Seki教授馈赠,人原代HSC细胞购自Sciencell公司(货号:5300)。GFP-Col-HSC细胞培养于2%FBS+1%青霉素和链霉素的DMEM中,人原代HSC细胞培养于10%FBS+1%青霉素和链霉素的DMEM中。
1.1.3 药物 下瘀血汤所含的大黄、桃仁、地鳖虫购自上海华宇药业。下瘀血汤由上海中医药大学附属曙光医院制备,其制备过程如下:大黄2.0 kg、桃仁2.0 kg和地鳖虫1.2 kg,分别加入8倍量20%乙醇浸泡1 h,回流提取2次,过滤收集药汁;药渣再加6倍量20%乙醇回流提取1 h,过滤收集药汁。合并两次所收集的药汁、真空干燥,每克所含生药量为8.889 g,临用前配制成浓度为0.63 g/ml的药液[8]。
1.1.4 试剂及耗材 CCl4和橄榄油购自上海凌峰化学试剂有限公司;ALT(货号:C009-2-1)、AST(货号:C010-2-1)试剂盒购自南京建成生物工程研究所;天狼星红染色液由上海中医药大学刘平教授馈赠;SABC免疫组化试剂盒购自Vector公司;FBS购自TPCS公司;青霉素和链霉素及胰酶均购自美国Gibco公司;DMEM购自以色列BI公司;GDNF因子购自R&D公司;PVDF膜购自Millipore公司;BSA购自Amresco公司;ECL购自上海碧云天生物技术有限公司;平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)兔单克隆抗体和GDNF兔多克隆抗体均购自Abcam公司;Trizol、High-Capacity cDNA反转录试剂盒及SYBR均购自日本TaKaRa公司;DAB购自北京中杉金桥公司;96孔板、6孔板均购自美国Corning公司;10 cm细胞培养皿购自NEST公司;引物购自生工生物工程公司(表1)。
1.1.5 主要仪器 超声波细胞粉碎机、多功能酶标仪、超微量分光光度计、实时荧光定量PCR仪、脱水机、包埋机、轮转式切片机、染色机、封片机等病理设备均购自德国Leica公司,荧光显微镜为日本Olympus公司(BX52);蛋白电泳仪及湿转仪均购自Bio-RAD公司,显影仪购自美国GE公司。

表1 引物序列表
1.2 分组与造模处理 24只小鼠随机分为对照组、模型组和下瘀血汤组,每组各8只,参考课题组前期文献[7],模型组和下瘀血汤组小鼠腹腔注射10% CCl4,每周3次,连续6周;对照组小鼠相同时间腹腔注射等体积橄榄油。造模第4周起,下瘀血汤组小鼠给予0.467 8 g/kg(相当于临床等70 kg成人体质量的10倍量)灌胃,对照组和模型组给予等体积蒸馏水,1次/d,连续3周。实验结束2%的戊巴比妥钠麻醉后下腔静脉取血,留取肝组织。选取肝右侧最厚一叶于10%中性福尔马林固定后用于组织学观察,其余肝组织用液氮处理后保存于-80 ℃冰箱。
1.3 研究方法
1.3.1 肝功能检测 血液样本于室温静置3 h,3000 r/min离心10 min,取血清,检测小鼠血清ALT和AST水平。
1.3.2 肝组织病理学苏木素-伊红(HE)染色 选取肝右侧最厚一叶,取0.5 cm×0.4 cm×0.3 cm大小肝组织,固定于10%中性福尔马林溶液,自动脱水机逐级乙醇脱水、二甲苯透明,石蜡包埋,4 μm切片,HE染色。采用OlympusBX43显微镜和CellSenStandard 9.0软件和Olympus DP72拍照,随机选取4个视野,进行图片采集。
1.3.3 免疫组化 将制备的肝组织样本脱蜡至水后,PBS洗3次,每次3 min;柠檬酸钠溶液微波修复抗原(100%火力,10 min;转换50%火力,5 min),恢复至室温,PBS洗3次;样本上滴加3%过氧化氢,37 ℃孵育15 min;PBS洗;滴加5%BSA,37 ℃封闭30 min;滴加α-SMA(1∶500)、GDNF(1∶100),4 ℃过夜;PBS洗;二抗37 ℃孵育30 min;PBS洗;滴加A+B试剂,37 ℃孵育30 min;PBS洗;滴DAB镜验;苏木素复染20 s,水洗;脱水;透明;封片;显微镜下观察。采用Image-pro plus 6.0软件对α-SMA和GDNF阳性表达分析。
1.3.4 Western Blot与PCR检测 取50 mg肝组织加入预冷的RIPA中匀浆,4 ℃ 12000 r/min离心15 min,取上清进行蛋白定量。取20 μg样品,12% SDS-PAGE电泳,100 V转移1 h至PVDF膜,5% BSA 封闭 1 h,一抗 4 ℃过夜,二抗室温60 min,ECL显影,采用 Image J分析Western Blot蛋白表达灰度值。(1)总RNA的提取:Trizol法提取小鼠肝脏RNA,总RNA溶解于DEPC水,采用超微量分光光度计测定A260/280 nm吸光度值,检测RNA浓度;(2)逆转录:按TaKaRa逆转录试剂盒(RR037A)说明书操作,PCR反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 15 min。(3) PCR扩增:cDNA 3 μl加SYBR Green 5 μl,引物0.8 μl,,ddH2O 1.2 μl,总体积10 μl,ABI(VIIA 7 DX)PCR系统扩增。PCR扩增条件为:预变性95 ℃ 30 min;变性95 ℃ 5 s,退火60 ℃ 30 s,40个循环,延伸60 ℃ 1 min。2ΔΔCt法分析结果。
1.4 伦理学审查 所有的研究规程均符合上海中医药大学动物伦理委员会当前的伦理考虑和《中国动物保护法》的程序和伦理指导方针,该法符合国家研究委员会的规定。所有动物实验和程序均经上海中医药大学动物保护与利用委员会(IACUC)审查和批准,并按照有关指导方针和规章执行,伦理审查批号:PTEC-A-2016-4(G)-1。

2 结果
2.1 下瘀血汤对CCl4肝纤维化小鼠肝功能有显著改善作用 与对照组小鼠相比,模型组ALT和AST水平显著升高(P值均<0.001);与模型组相比,下瘀血汤组小鼠血清ALT、AST水平显著降低(P值均<0.01),提示下瘀血汤对CCl4诱导的肝功能损伤具有保护作用(表2)。

表2 各组小鼠血清转氨酶水平
2.2 下瘀血汤对CCl4肝纤维化的抑制作用 HE染色结果显示,对照组肝细胞索从中央静脉呈放射状排列,CCl4造模6周后小叶间炎性细胞浸润明显,下瘀血汤可显著抑制炎性浸润(图1a~c,表3)。天狼星红染色结果显示,CCl4造模6周,胶原纤维沉积显著增多,正常结构遭到破坏,增生的胶原从汇管区向小叶延伸,形成肝纤维化,下瘀血汤显著抑制胶原沉积(图1d~f,表3)。

表3 各组小鼠炎性浸润半定量及天狼星红阳性半定量结果
2.3 下瘀血汤显著抑制CCl4肝纤维化模型中HSC活化和GDNF表达 正常肝组织α-SMA 表达较低,主要表达在中央静脉血管壁,造模6周,α-SMA呈强阳性表达,主要分布在纤维间隔和肝窦;下瘀血汤处理组α-SMA表达显著下调。GDNF在正常小鼠肝组织表达较低,呈弱阳性表达;模型组小鼠肝组织GDNF主要表达肝小叶周围,呈强阳性表达,位置与α-SMA表达位置类似(图2,表4)。

表4 各组小鼠肝脏组织中α-SMA及GDNF含量半定量分析
免疫印迹结果显示,对照小鼠肝组织GDNF表达比较低,CCl4造模6周肝纤维化形成,GDNF表达上调10倍左右,下瘀血汤显著抑制GDNF蛋白表达。α-SMA和Col1表达在肝纤维化中显著上调,下瘀血汤处理后α-SMA与Col1显著下降(图3,表5)。
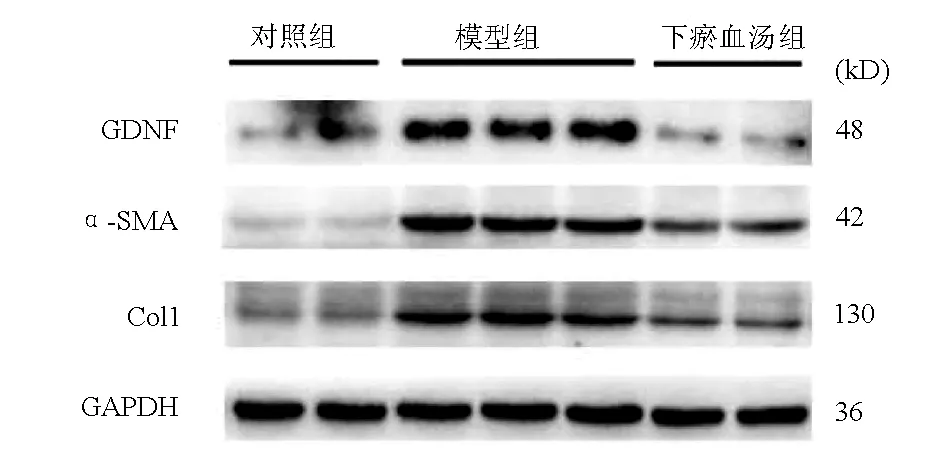
图3 α-SMA及GDNF在CCl4诱导肝纤维化中的免疫印迹(n=4)

表5 各组小鼠肝脏组织中α-SMA及GDNF含量灰度值半定量分析
2.4 下瘀血汤对GDNF诱导的HSC活化有抑制作用 用GDNF处理人原代HSC细胞2 h,发现磷酸化(p)NF-κB水平显著升高,提示GDNF可诱导NF-κB活化,下瘀血汤处理后p-NF-κB水平显著下调,提示下瘀血汤对GDNF诱导的NF-κB活化有显著抑制作用;同样GDNF可诱导TNFα表达显著上调,而下瘀血汤可显著抑制GDNF诱导的TNFα表达(图4a,表6)。
GFP-Col-HSC细胞是小鼠源性的HSC株,当其活化时表达胶原Col和GFP。GFP-Col-HSC细胞培养48 h,不处理组GFP-Col-HSC细胞荧光强度相对较弱,而GDNF 10 ng/ml处理48 h,GFP-Col-HSC细胞荧光显著增强,提示GDNF可诱导HSC活化;下瘀血汤处理后,GFP-Col-HSC荧光强度显著下降,提示下瘀血汤对GDNF诱导的HSC活化有显著的抑制作用(图4c)。
进一步采用人原代HSC细胞,培养48 h,免疫印迹结果发现α-SMA和Col1表达上调2.7倍和4.8倍,提示GDNF可诱导人HSC活化,下瘀血汤处理后α-SMA和Col1表达显著下调,提示下瘀血汤对GDNF诱导的人HSC活化有显著抑制作用(图4b,表6)。实时定量PCR结果与免疫印迹结果类似,Col4 A2和Col5 A1在GDNF刺激后显著上调,而下瘀血汤显著抑制GDNF诱导的Col4 A2和Col5 A1表达(表7)。

表6 体外实验中炎症因子及纤维化指标灰度值半定量分析

表7 体外实验中纤维化相关因子mRNA相对表达量比较

注:a,人原代HSC细胞在GDNF(10 ng/ml)浓度下处理2 h; b, 免疫印迹检测α-SMA和Col1表达及半定量结果;c,GDNF处理GFP-Col-HSC细胞48 h,检测荧光。
3 讨论
在我国慢性乙型肝炎是肝纤维化主要病因,近年乙型肝炎疫苗的广泛应用,乙型肝炎肝纤维化显著减少[9],然而,生活节奏改变诱发的非酒精性脂肪性肝病[10]、酒精性脂肪性肝病[11]、药物性肝损伤、自身免疫性肝炎等慢性肝病不断增多,这些慢性肝病均可诱发肝纤维化,进而诱发门静脉高压和肝癌[3]。肝纤维化的细胞学基础是HSC,在持续的慢性肝损伤情况下,HSC及Kuffer细胞及肝细胞分泌TGFβ,通过自分泌或旁分泌途径刺激HSC活化,进而分泌胶原致细胞外基质增多和肝纤维化[12]。肝纤维化的细胞学基础明确,然而仍然缺乏有效的生物或化学药物干预,提示肝纤维化的病因研究有待进一步深入。目前明确了肝纤维化发生的中心环节是HSC激活,激活的 HSC 是肝纤维化过程中细胞基质外主要来源,TGFβ是致 HSC激活的最强因子,但由于 TGFβ细胞分布的广泛性,靶向 TGFβ分子的生物制剂很难走向临床应用。因此,这就要求从新的视角,进一步阐明 HSC 激活机制,以便为其有效防治提供新靶点。
下瘀血汤是抗肝纤维化经典方剂,已故名医姜春华教授用下瘀血汤治疗血吸虫性肝纤维化取得较好的临床疗效[13]。本课题组发现下瘀血汤对胆总管结扎诱导肝纤维化[14]及蛋氨酸-胆碱缺乏饮食诱导的脂肪变及纤维化有显著抑制作用[15],并对肝纤维化过程中的其他脏器损伤也有显著的保护作用[16]。本研究肝功能、天狼星红染色等结果验证了下瘀血汤抗肝纤维化作用,与前期结果一致[14-15]。基础研究结果为下瘀血汤临床应用提供了依据,并且下瘀血汤仅有三味中药组成,较容易阐明药物的有效成分,有巨大的开发潜力,因此,进一步阐明下瘀血汤的作用机制具有重要意义。
GDNF是TGFβ超家族成员[4],TGFβ是最强致纤维化因子,但是TGFβ分布组织广泛,缺乏组织和细胞特异性,针对TGFβ靶向的试剂很难走向临床,需要寻找细胞特异性较好的致纤维化新靶点。本研究显示GDNF主要分布在小叶间,与α-SMA分布相似,体外GDNF处理GFP-Col-HSC及人原代HSC 48 h,胶原表达上调,提示GDNF可诱导HSC细胞活化,具有致纤维化作用,与文献报道GDNF可促进纤维化反应作用一致[5,17-18]。GDNF相对TGFβ有致纤维化作用并具特异性,本课题组发现了HSC活化的这个新靶点,为中医药抗肝纤维化提供了新的靶标。
本研究创新之处是发现GDNF处理HSC 2 h后,NF-κB磷酸化水平和TNFα表达显著增高,提示GDNF可经过NF-κB通路诱导HSC活化,下瘀血汤可显著抑制GDNF诱导的NF-κB通路从而抗肝纤维化,因此,在一定程度上阐明了下瘀血汤抗肝纤维化的作用机制。据报道GDNF在炎性疼痛中发挥重要作用[19],前期本组报道下瘀血汤可显著改善慢性乙型肝炎患者肝区不适、胁痛等临床症状[6],因此,GDNF也可能是胁痛的病理基础之一,也是下瘀血汤取效的靶点之一。总之,本研究发现GDNF在肝纤维化过程中上调并可经过NF-κB诱导HSC活化,下瘀血汤抑制GDNF的表达从而实现抗肝纤维化效应,为未来临床应用下瘀血汤抗肝纤维化提供了基础依据,但下瘀血汤抗纤维化机制及有效成分的作用需要进一步深入研究。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:张玮负责课题设计,资料分析,撰写论文;杨广越、沈东晓、严萍负责分子生物学相关实验及动物实验;马文婷、陶乐、吴柳参与收集数据,修改论文;刘成负责拟定写作思路,指导撰写文章并最后定稿。

