慢性乙型肝炎合并非酒精性脂肪性肝病患者血清反应性氧化物和脂联素水平变化*
王松姣,张宇晨,龚国富,王宇学
乙型肝炎病毒(hepatitis B virus, HBV)是慢性乙型肝炎(chronic hepatitis B,CHB)的病原体,人群普遍易感。病毒主要通过母婴传播、血传播和性传播等方式传播。随着病情发展可进展为肝纤维化,继而发展为肝硬化或肝癌[1]。非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)或代谢相关性脂肪性肝病(MAFLD)是一种与肥胖和糖脂代谢紊乱等有关的代谢性疾病,以肝细胞内脂肪贮积和细胞变性为病理学特征[2]。根据NAFLD患者病情是否伴有炎症反应和肝纤维化,可以将其分为单纯性脂肪肝(nonalcoholic simple fatty liver,NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和NASH相关性肝硬化[3]。近年来研究显示[4],HBV感染与NAFLD常合并发生,两者可相互影响,共同促进病情进展,引起肝纤维化病变[5]。目前,HBV感染与NAFLD相互作用的具体机制尚不清楚,可能与糖脂代谢紊乱、脂质过氧化和大量的炎症介质作用等有关[6]。反应性氧化物(reactive oxygen species,ROS)是反映机体氧化应激水平的最主要的指标之一,可引起脂质过氧化,与NASH及肝纤维化的发生密切相关[7]。脂联素(adiponectin,ADPN)是由脂肪细胞分泌的一种蛋白质,与机体的糖脂代谢、氧化应激、炎症反应和肝纤维化等病理生理过程均密切相关[8]。本研究检测了CHB合并NAFLD患者血清ROS和ADPN水平,分析了它们水平的变化及其临床意义,现报道如下。
1 资料与方法
1.1 一般资料 2018年1月~2020年1月我院收治的CHB合并NAFLD患者97例,男性57例,女性40例;年龄35~60岁,平均年龄为(44.2±9.7)岁;体质指数(body mass index,BMI)为23~30 kg/m2,平均为(27.2±3.4)kg/m2;合并糖尿病4例,高血压16例,高脂血症34例。诊断依据中华医学会于2010年制订的《慢性乙型肝炎防治指南》[9]和《非酒精性脂肪性肝病诊疗指南》[10]的标准。排除标准:合并酒精性肝病、其它类型的病毒性肝炎、药物性肝损伤等其他因素引起的肝损伤;合并恶性肿瘤。患者给出知情同意书,本研究经我院医学伦理委员会审核通过。另选CHB患者97例,男性62例,女性35例;年龄35~60岁,平均年龄为(43.5±9.2)岁;BMI为20~25 kg/m2,平均为(23.9±3.2)kg/m2。
1.2 指标检测 使用7060型全自动生化分析仪检测血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、谷氨酰转肽酶(gamma-glutamyl transpeptidase,GGT)、空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low density lipoprotein,LDL-C)和高密度脂蛋白(high-density lipoprotein,HDL-C,日本日立公司);采用ELISA法检测血清ROS、ADPN和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)水平(上海蓝基生物科技有限公司);采用NAFLD肝纤维化评分(hepatic fibrosis score of NAFLD,NFS)系统[11]评估肝纤维化程度,NFS=-1.675+0.037×年龄+0.094×BMI kg/m2+1.13×空腹血糖受损或糖尿病(是=1,否=0)+0.99×AST(U/L)/ALT(U/L)-0.013×血小板计数(×109/L)-0.66×白蛋白(g/L)。
1.3 FibroScan检查 使用FibroScan-502型瞬时弹性扫描仪(法国Echosens公司)行肝硬度检测(liver stiffness measurement,LSM)和受控衰减参数(controlled attenuation parameter,CAP),选择右侧腋前线至腋中线第7~9肋间,进行10次有效测量,取均值。
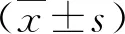
2 结果
2.1 两组肝功能指标比较 CHB合并NAFLD患者血清GGT水平显著高于CHB患者(P<0.05,表1)。

表1 两组肝功能指标的比较
2.2 两组血糖和血脂水平比较 CHB合并NAFLD患者空腹血糖和TC、TG和LDL-C水平显著高于CHB患者(P<0.05,表2),而HDL-C水平显著低于CHB患者(P<0.05,表2)。
2.3 两组血清ROS、ADPN和TNF-α水平比较 CHB合并NAFLD患者血清ROS和TNF-α水平显著高于CHB患者(P<0.05,表3),而血清ADPN水平显著低于CHB患者(P<0.05,表3)。

表2 两组血糖和血脂水平的比较

表3 两组血清指标比较
2.4 两组肝纤维化和脂肪变指标比较 CHB合并NAFLD患者NFS评分、LMS和CAP显著高于CHB患者(P<0.05,表4)。

表4 两组肝纤维化和脂肪变指标的比较
3 讨论
约有15%~40%HBV感染者可发展为肝硬化,甚至肝癌[12]。研究显示[13,14],合并NAFLD可加重CHB患者的肝损伤,加快肝组织纤维化进展,但其相互作用的机制尚未明确。因此,本研究比较了单纯CHB患者与CHB合并NAFLD患者肝功能、糖脂代谢、脂质过氧化、炎症介质水平的差异,以期分析CHB合并NAFLD进展的机制。本研究中,CHB合并NAFLD患者血清GGT和TG水平均明显升高,而HDL-C水平明显降低,提示CHB合并NAFLD可以加重患者的肝功能损伤,其作用可能与体内异常升高的血脂水平有关。目前,大部分研究认为NAFLD的发生与“二次打击”学说有关,由各种原因导致的胰岛素抵抗(insulin resistance,IR)可以引起体内脂质代谢异常,导致肝细胞内TG大量蓄积,大量的游离脂肪酸氧化产生过量的ROS,引起线粒体功能损伤,脂质代谢障碍,细胞内氧化/抗氧化水平失衡,肝细胞的炎症反应活动剧烈,诱导肝组织细胞坏死[15,16]。CHB患者肝脂肪变性与病毒载量无关,而与患者的BMI和血脂水平升高有关[17]。肝脂肪变性是影响CHB患者合并NAFLD发生的独立危险因素[18]。
本研究中,CHB合并NAFLD患者血清ROS和TNF-α水平均明显高于CHB患者,而ADPN水平明显低于CHB患者。TNF-α是机体的炎症因子,可以激活炎症信号通路,诱导多种炎症介质的释放,参与肝炎、肝纤维化等多种疾病的发生发展。ROS是肝细胞内过量游离脂肪酸氧化过程中产生的一系列活性氧簇,可以损伤线粒体功能,影响游离脂肪酸代谢,过多的游离脂肪酸还可以直接激活炎症信号通路,增加TNF-α等炎症介质的合成和释放,加重肝组织炎症反应,诱导肝纤维化的形成[19],提示ROS可能通过调节脂质过氧化和炎症信号通路,推进CHB合并NAFLD的病情进展。ADPN是一种由脂肪细胞分泌的脂肪细胞因子,参与调节胰岛素信号通路,影响IR、糖脂代谢等多种代谢性疾病的发生,还可以抑制炎性介质的生成,发挥抗炎作用,在肥胖、糖尿病和NAFLD的发生发展过程中发挥重要作用[20]。
肝纤维化是CHB合并NAFLD患者疾病进展为肝硬化的病理学基础,与肝细胞内大量的炎症介质作用有关[21]。NFS评分是一种非侵入性的肝纤维化评分系统,通过评估患者的年龄、体质量、肝功能、糖代谢等,来评估患者的肝纤维化风险,目前已广泛用于NAFLD患者的肝纤维化评估[22]。因此,本研究结合NFS评分和影像学检查来共同评估CHB合并NAFLD患者的肝纤维化程度。本研究中,CHB合并NAFLD患者NFS评分、CAP和LSM水平显著高于CHB患者。CAP是临床常用的评估肝脂肪变程度的指标,LSM是近年来常用的评估肝纤维化的指标[23]。CHB合并NAFLD患者肝脂肪变程度和肝纤维化程度明显加重,临床有可能联合应用抗氧化、抗炎等药物治疗,保护肝功能损伤。研究显示[24,25],ROS与CHB合并NAFLD患者肝纤维化、脂肪变程度和炎症反应程度有关,低ADPN血症是影响NAFLD发生的独立危险因素,提示ROS和ADPN水平变化可能通过调节机体的糖脂代谢和炎症信号通路,参与CHB合并NAFLD的发生发展。临床可根据患者血清ROS和ADPN水平的变化评估CHB患者发生NAFLD的可能,指导临床处置。
综上所述,CHB合并NAFLD患者血糖、血脂、ROS水平较CHB患者明显升高,而ADPN水平明显降低。本研究结果为CHB合并NAFLD患者的临床处理提供了一定的理论依据。

