放射性125碘粒子对肺腺癌A549细胞荷瘤裸鼠HIF-1α表达的影响
刘登尧,叶尓麦克·阿哈提,李建邦,杨树法,樊喜文
(新疆医科大学附属肿瘤医院介入诊疗科,乌鲁木齐830002)
组织间内照射治疗作为非小细胞肺癌(nonsmall cell lung cancer,NSCLC)的一种治疗手段,对于经传统放化疗后效果不佳的患者,是一种局部治疗选择[1-3]。放射性碘125粒子(125I粒子)组织间近距离治疗,可通过持续释放低剂量率射线造成物理损伤,从而有效控制局部肿瘤[4]。同时,放射性粒子通过辐射生物学效应,刺激分泌各种细胞因子启动细胞凋亡,抑制血管内皮细胞生长[5]。乏氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)在体内显著增加无氧酵解和促进实体瘤内微血管的生成,是血管内皮生长因子(vascular endothelial growth factor,VEGF)最重要的调控因素[6]。本研究通过构建肺腺癌A549细胞荷瘤裸鼠模型,植入碘125放射性粒子,观察组织间粒子植入对移植瘤生长以及肿瘤组织中HIF-1α表达的变化,探讨125I粒子治疗肺癌的作用机制,为临床治疗提供一定的实验依据。
1 材料与方法
1.1 材料肺癌细胞株A549(上海名劲生物科技有限公司),健康雄性BALB/c裸鼠20只(北京华阜康生物科技股份有限公司,SCXK(京)-2014-0004),体重20.0~25.0 g。125I粒子,6711-99型,粒子长4.5 mm,直径0.8 mm,活度分别为22.2 MBq,0 MBq(空源粒子),半衰期59.43 d。
1.2 方法
1.2.1 细胞培养 复苏A549细胞,混匀制成细胞悬液,置于37°C、5%CO2培养。
1.2.2 裸鼠移植瘤建模 实验前24 h禁食,自由饮水。取对数生长期的A549细胞制成浓度为1×107细胞/100µL的单细胞悬液,取100µL接种于裸鼠右上肢皮下,每两天用游标卡尺测量移植瘤长短径。当体积达1 000 mm3时建模成功,进行粒子植入。
1.2.3 动物分组及粒子植入 按随机数字表法将20只模型裸鼠平均分为实验组和对照组,每组10只。造模成功后,瘤体体积达1 cm3进行粒子植入,实验操作者做好射线防护,用徒手穿刺植入法,将放射性粒子植入移植瘤内。根据实验设计不同,实验组和对照组分别植入活度为22.2 MBq和0 MBq的粒子各1颗。各组动物分笼饲养。
1.3 移植瘤生长情况分别于粒子植入前、粒子植入后直至第30天,期间每隔2天测量肿瘤的长径(A)和短径(B),按公式计算肿瘤相对体积(V)=A×B2/2,观察两组的体积曲线变化趋势。
1.4 HIF-1α蛋白表达常规制备移植瘤组织切片,脱蜡,水洗。抗原修复:高压修复:锅内倒入0.01 M柠檬酸钠缓冲液,温度调到最大,高压锅置气后开始计时165 s,脱蜡至水,脱蜡液I 20 min,脱蜡液II 20 min,脱蜡液III 20 min,脱水后放入80%乙醇浸泡8 min,水洗,灭活,将处理后的组织玻片擦干,滴加内源性过氧化物酶阻断剂,置于室温(25℃)避光处理10 min后,PBS洗。一抗孵育,将处理后的组织玻片擦干,每张片子加150µL抗体(抗体用专用稀释液稀释,含血清),37℃孵育1 h,后PBS洗。滴加增强酶标羊抗小鼠/兔IgG聚合物,室温静置20 min,PBS洗。DAB显色3 min,水洗。复染后脱水,80%乙醇5 min,95%乙醇5 min,无水乙醇5 min,透明液I 5 min,透明液II 5 min。中性树胶封片。镜下观察,当视野中细胞内出现棕黄色深染颗粒为阳性。半定量结果分析:在20倍镜视野测量相对灰度值,相对灰度值=(背景灰度值-实测灰度值),值越小,代表该蛋白表达越高。
1.5 HIF-1αmRNA表达采用荧光定量PCR法检测移植瘤组织HIF-1αmRNA表达。mRNA相对表达量运用ABI7500软件(美国应用生物系统公司)进行分析,采用法。RNA反转录后扩增(Roche Lightcycler 480II)。引物、内参序列以及反应条件如表1所示。
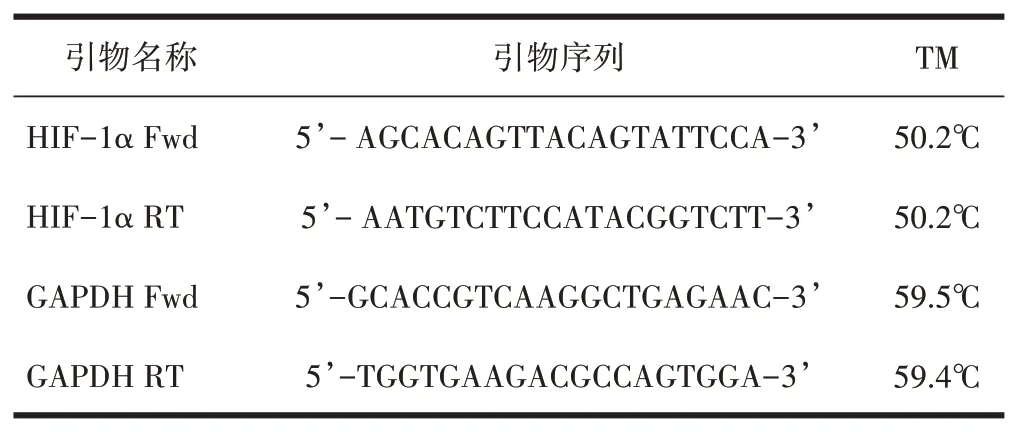
表1 引物序列
1.6 统计学处理采用SPSS 22.0软件进行分析,计量资料以(±s)表示,满足正态分布性检验行下一步分析。采用独立样本t检验分析两组的差异,P<0.05为差异具有统计学意义。
2 结果
2.1 肿瘤生长情况经大体观察测量,实验组与对照组瘤体生长趋势均稳定增长,实验组从125I粒子植入后第10天开始,肿瘤体积增长速度开始放缓,在第14天后直至30天实验组的生长曲线呈下降趋势,与对照组曲线的差距比逐渐增大(图1)。30 d后,实验组移植瘤体积(1 213.8±567.6)mm3,对照组移植瘤体积(1 712.1±437.4)mm3,两组比较差异无统计学意义(t=1.554,P>0.05)。

图1 30 d对照组与实验组移植瘤生长曲线
2.2 HIF-1α蛋白表达免疫组化检测实验组与对照组人肺腺癌A549细胞移植瘤组织中HIF-1α蛋白的表达水平。结果显示,在30 d后对照组(图2)和实验组(图3)瘤组织免疫组化切片中HIF-1α均有阳性表达(胞质和细胞表面呈深棕色)。实验组HIF-1α阳性表达水平(86.7±4.2)较对照组(102.7±3.7)低,差异有统计学意义(t=9.039,P<0.05)。

图2 对照组人肺腺癌A549移植瘤组织HIF-1α表达(400×)

图3 实验组人肺腺癌A549移植瘤组织HIF-1α表达(400×)
2.3 HIF-1αmRNA表达荧光定量PCR实验结果显示,在粒子植入后30 d,实验组、对照组HIF-1αmRNA表达情况不同,经数据转换后分别为(0.223±0.081 4)和(0.879±0.025 9),差异有统计学意义(t=24.285,P<0.05)。
3 讨论
放射性粒子植入在国外批准应用于前列腺癌的治疗[7]。作为一种局部近距离内照射放疗经我国学者引进后,经过不断改进,配合各种辅助引导方式,目前该治疗技术正广泛地应用于各部位实体恶性肿瘤的临床治疗[3,8-11]。本团队前期的临床研究发现,放射性粒子联合静脉标准化疗方案用于不可手术的晚期非小细胞肺癌患者,相较于单独使用化疗的患者,联合治疗局部控制率高(78.4%vs56.4%),1年生存率高(66.7%vs45.3%),提示粒子治疗具有良好的近期疗效[12]。
肿瘤细胞通过HIF-1α的表达可诱导VEGF、EPO、葡萄糖载体蛋白及糖酵解相关酶的表达[13],增加供血、供氧、供能,改善恶性肿瘤因组织增长过快而造成的局部组织严重缺氧和供能与耗能之间的不平衡[14]。放射性粒子近距离治疗时,持续低剂量照射下乏氧细胞发生再氧合,放射拮抗性降低[15]。由于粒子治疗的生物学特性,许多学者对其抑瘤生长机制开展大量研究。前期研究发现,125I粒子可抑制裸鼠人肺鳞癌H520移植瘤生长,并降低移植瘤组织VEGF的表达[16]。陆平等[17]发现将125I放射性粒子植入人类乳腺癌MCF-7细胞裸鼠移植瘤模型后,乳腺癌肿瘤组织及癌旁组织中HIF-1α的mRNA及其蛋白表达明显低于未植入粒子的对照组。李洁清等[18]研究发现,接受等剂量照射下,肺腺癌A549细胞HIF-1α基因沉默型肿瘤生长延缓更明显。本研究结果显示,具有放射活度的粒子植入荷人肺腺癌A549细胞裸鼠移植瘤后,实验组HIF-1α蛋白与mRNA表达水平均较对照组降低(P<0.05),表明放射性125I粒子可在蛋白及基因水平降低人肺腺癌组织HIF-1α表达,同以往其他研究结果类似[6,19-20]。
此外,本研究观察到实验组植入22.2 MBq活度粒子后,在30 d的实验观察期内移植瘤体积生长速度逐渐减慢,与对照组比较,差异无统计学意义(P>0.05),推测可能实验设定观察期较短,未达到粒子的首个自然半衰期所致,部分研究发现延长实验时间超过半衰期时,可观察到体积差异存在统计学意义[21]。
综上所述,放射性125I粒子可抑制人肺腺癌A549细胞荷瘤裸鼠移植瘤的生长,在蛋白与基因水平能抑制HIF-1α的表达,推测放射性粒子可能通过影响该因子的表达发挥抑制肿瘤生长的作用。但因本研究实验动物数量少,仍需扩大样本量进一步研究。

