多毛番茄CIPK 基因家族生物信息学分析及低温下功能研究
柴 畅 狄成乾 汪 杨 王傲雪,*
(1 东北农业大学园艺园林学院,黑龙江哈尔滨 150030;2 东北农业大学生命科学学院,黑龙江哈尔滨 150030)
番茄起源于热带,是一种对低温较为敏感的蔬菜,温度过低会使番茄生长发育不良,严重时甚至死亡。多毛番茄(Solanum habrochaites)是番茄属的一种野生番茄,具有耐低温甚至是抗冻的特性(Venema et al.,1999,2005;Foolad &Lin,2000)。研究表明,与多毛番茄远缘杂交可以提高栽培番茄的抗性和品质,因此许多育种工作者将多毛番茄的特性用于番茄抗病虫性改良和创造抗病虫种质资源(Rick,1973)。然而番茄远缘杂交不亲和,剖析多毛番茄基因调控的信号转导通路,继而通过基因转移方法改造栽培番茄,能创造耐低温的栽培番茄,也可以为其他作物遗传改良提供基因材料。
钙离子信号是植物中一种普遍的信号转导途径,钙离子作为真核生物中通用的离子几乎涉及植物生长的各个方面并参与调控过程。钙离子浓度升高到某些阈值水平能激活钙离子传感器蛋白和离子通道,调控细胞质中游离钙离子浓度变化,产生相应生理反应。这些传感器主要包括钙调素蛋白(CaM)、钙依赖型蛋白激酶(CDPK)和类钙调磷酸酶B 蛋白(CBL)。CBL 作为传感器需要与相互作用的蛋白激酶(CIPK)特异性结合形成功能上的复合物传递植物信号,调控离子流入。
CIPK 蛋白包含保守的N 端的激酶结构域和C端的调节结构域。前者包含丝氨酸/苏氨酸蛋白激酶催化结构域,有可以磷酸化的激活环。后者包含磷酸酶相互作用域PPI 和自调节结构域NAF(又称FISL 基序)。特征氨基酸Asn(N)、Ala(A)、Phe(F)、Ile(I)、Ser(S)和Leu(L)组成的NAF基序是结合CBL 蛋白所必需的(Albrecht et al.,2001)。当CBLs 与CIPKs 相互作用时,自抑制的NAF 结构域从蛋白质结构域释放,产生活性激酶构象(Weinl &Kudla,2009)。
CBL-CIPK 复合物在非生物胁迫、生物胁迫以及营养信号级联中有重要的作用。许多CBLCIPK 网络已被证明参与了植物在非生物胁迫条件下的信号传递,特别是在盐胁迫和渗透胁迫下。蛋白激酶CIPK24/SOS2 在盐胁迫条件下结合蛋白CBL4/SOS3,进而激活下游成分SOS1/(Na+/H+antipoter),从而改善盐脱毒过程(Qiu et al.,2002)。过表达SICIPK24/SISOS2增加了番茄的耐盐性(Huertas et al.,2012)。AtCBL1激活AtCIPK23来调节接收器NPF6;3,同时激活K+通道AKT1 抑制铵离子的转运并调节植物对铵离子的敏感性,AtCIPK23和AtAKT1的突变体植株叶片气孔关闭,可以减少植物失水,从而间接响应干旱胁迫(Nieves-Cordones et al.,2012;Straub et al.,2017)。CBL-CIPK 网络在低温下也有一些研究。在拟南芥中,AtCBL9-AtCIPK3 和AtCBL1-AtCIPK7 复合物在冷胁迫下有重要的作用(Huang et al.,2011)。AtCBL1、AtCBL9和AtCIPK26互作激活NADPH 氧化酶RBOHF(respiratory burst oxidase homolog F),从而作用于细胞中的H2O2(Drerup et al.,2013)。MdCIPK22-MdSUT2.2 促进了糖积累从而增加了耐旱性(Ma et al.,2019)。
CIPKs 作为钙离子信号转导途径中的一个重要蛋白家族,在多毛番茄中还未见报道。为确定多毛番茄CIPK 基因家族成员,本试验利用生物信息学方法对多毛番茄CIPK 基因家族成员的序列信息进行了鉴定和分析,采用实时荧光定量PCR 的方法研究了冷胁迫下各成员的表达变化,以期为进一步探索冷胁迫下多毛番茄钙信号转导途径奠定基础。
1 材料与方法
1.1 材料
供试多毛番茄(Solanum habrochaites)为东北农业大学园艺园林学院保存的LA1777。将消毒后的种子放在湿滤纸上,发芽后将其播种到装有蛭石、土壤混合物(1V∶1V)的塑料盆中,置于20~25 ℃的人工气候室中,光周期16 h/8 h(昼/夜)。同时对同一批次的多毛番茄幼苗进行低温胁迫(4 ℃)处理,取样时间为处理后0、3、9、12、24、36 h。采集植株形态学上端第2 片完全展开的功能叶,各个处理的样品均准确称取0.08 g,3 次生物学重复,将样品快速转移至液氮中,用于后续RNA 的提取。
1.2 方法
1.2.1 多毛番茄CIPK 基因家族成员鉴定及基本信息分析 从Pfam 蛋白家族数据库(https://pfam.xfam.org/)下载蛋白酶(PF00069)和NAF 结构域(PF03822)对应的隐马尔可夫模型(HMM)文件,再通过hmmsearch 从多毛番茄全基因组数据(https://tomato.biocloud.net)中搜索CIPK基因(E-value <1×10-7,相似度>50%)(Finn et al.,2007)。用bio-linux 软件预测多毛番茄CIPK 蛋白的长度、分子质量、等电点。利用MapChart 软件绘制染色体定位图。利用SOSUI(http://harrier.nagahama-i-bio.Ac.jp/sosui/)在线软件预测蛋白跨膜结构域。利用CELLO(http://cello.life.nctu.edu.tw)预测亚细胞定位。
1.2.2 多毛番茄CIPK 基因家族系统进化分析 为探究CIPK 基因家族内的进化关系,使用MEGA软件的邻接法(Neighbor-Joining)对多毛番茄、栽培番茄、拟南芥、杨树的CIPK 基因家族进行系统进化分析,校验参数500 次重复。
1.2.3 多毛番茄CIPK 基因家族基因结构分析 提取多毛番茄CIPK基因CDS 序列及对应的基因组序列信息,运用GSDS 工具(http://gsds.cbi.pku.edu.cn/)进行基因结构分析并绘制外显子-内含子结构图。
1.2.4 多毛番茄CIPK 基因家族保守基序分析 为研究多毛番茄CIPK基因的进化关系,用MEME(http://meme.nbcr.net/meme/)在线分析18 个多毛番茄CIPK基因的保守基序。
1.2.5 多毛番茄CIPK 基因家族基因复制 使用MCSCanX 的默认参数对多毛番茄和拟南芥、多毛番茄和栽培番茄进行共线性关系分析。利用ClustalW 对全长氨基酸序列进行比对,使用KaKs_Calculator 2.0 计算Ks 和Ka 程序,用同义突变率估计基因对的离散时间,每年每个同义位点的替换量为T=Ks/2X(X=6.56×10-9)(Yuan et al.,2015)。
1.2.6 实时荧光定量PCR 分析 使用美国OMEGA公司生产的RNA-Solv Reagent 提取RNA,具体步骤参照说明书,RNA 提取过程所需其他试剂均为国产分析纯。RNA 逆转录试剂盒使用日本东洋纺公司ReverTra Ace qPCR RT Master Mix with gDNA Remover。利用NCBI(https://www.ncbi.nlm.nih.gov/)数据库中Primer Blast 功能设计荧光定量引物(Max值设为200),引物序列见表1,利用qRT-PCR 方法检测多毛番茄CIPK 基因家族各成员在4 ℃处理0、3、9、12、24、36 h 的表达量。实时荧光定量PCR 分析所用荧光染料试剂盒为北京全式金生物技术有限公司TransStart Top Green qPCR SuperMix。使用仪器为QuantStudio1。反应程序为94 ℃ 30 s;94 ℃ 5 s,50~60 ℃ 15 s,72 ℃ 10 s;40 个循环。以稳定的Actin基因作为内参,与0 h 未处理叶片(CK)相比并计算,采用2-ΔΔCT方法进行分析。
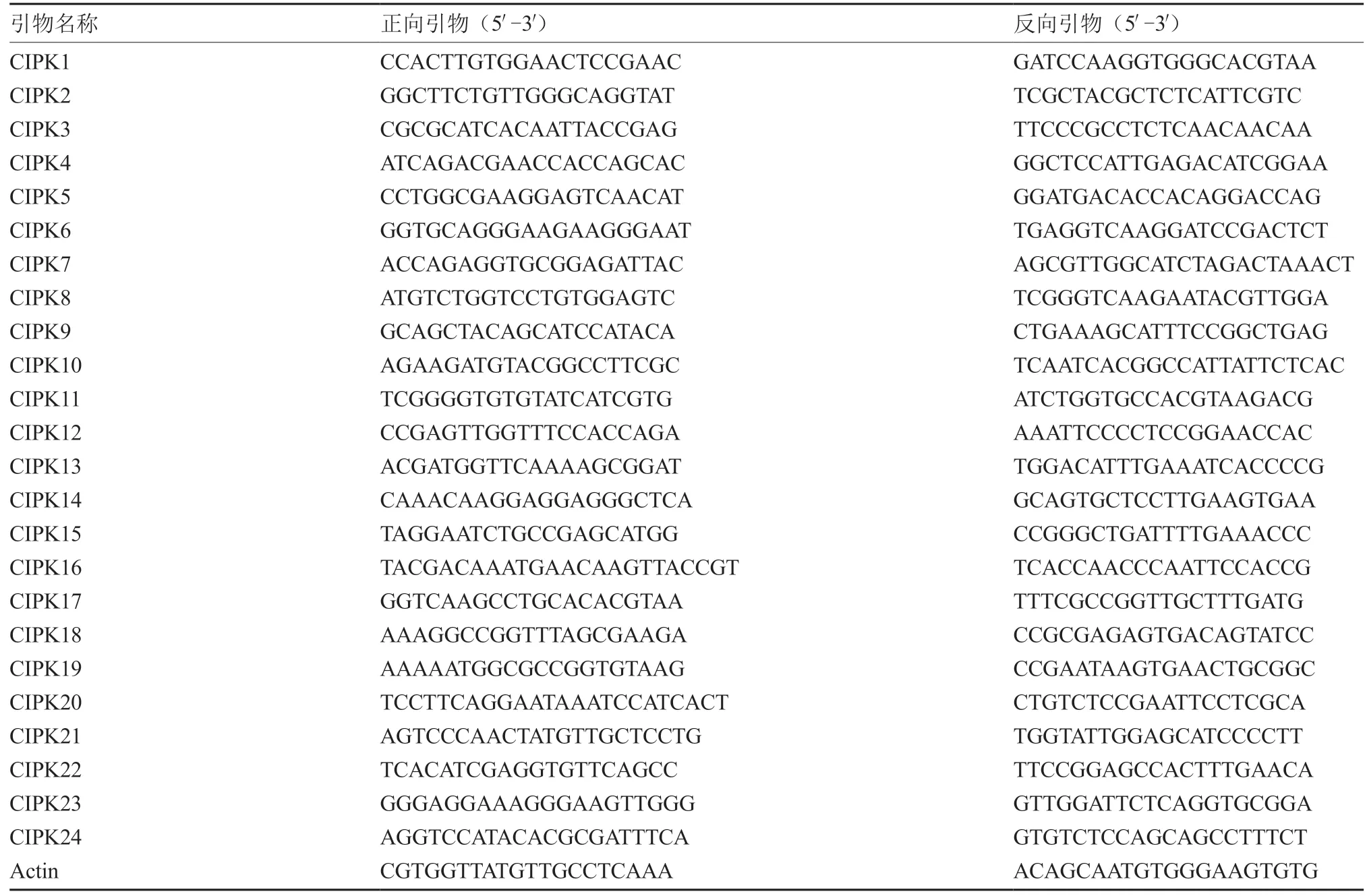
表1 荧光定量PCR 引物序列
2 结果与分析
2.1 多毛番茄CIPK 家族成员鉴定
利用hummer 模型分析,鉴定出多毛番茄中24 个CIPK 基因家族成员,将其命名为ShCIPK1~ShCIPK24,在12 条染色体上均有分布,其中6、9、12 号染色体上分布最多,均为4 个,5号染色体有3 个,2 号染色体有2 个,其余染色体上均为1 个(图1)。从表2 可以看出,多毛番茄CIPK 家族基因长度差距不大,范围在1 260~1 464 bp,编码氨基酸的范围为419~487 aa。等电点最小(ShCIPK21)为 6.37,最大(ShCIPK19)为9.90,除ShCIPK5、ShCIPK6、ShCIPK21外,等电点均大于7,共21 个碱性蛋白。分子量变化范围为48 497.8~108 454.7 Da,变化较大。亚细胞定位分析表明,大多数基因定位于细胞质,少数基因分布于质膜、细胞核、线粒体。大多数家族成员存在1个跨膜结构域。多毛番茄CIPK 基因家族的NAF结构域中残基A、F、I 和L 是绝对保守的,表明这些残基可能在与CBLs 的相互作用中起重要作用(图2),起始位置在300~350 bp 之间,长度为20个氨基酸左右。
2.2 多毛番茄CIPK 基因家族系统进化分析
为了研究多毛番茄与其他物种的进化关系,对多毛番茄、栽培番茄、拟南芥和杨树的CIPK 基因家族构建进化树。由图3 可知,98 个CIPK基因可分为5 个亚族,分别命名为group 1~group 5。其中group 1 包括ShCIPK7、ShCIPK12、ShCIPK13、ShCIPK17、ShCIPK235 个多毛番茄基因家族成员;group 2 包 括ShCIPK2、ShCIPK9、ShCIPK11、ShCIPK18、ShCIPK195 个家族成员;group 3 包括ShCIPK4、ShCIPK10、ShCIPK14、ShCIPK15、ShCIPK16和ShCIPK226 个基因家族成员;group 4 包括ShCIPK5、ShCIPK6、ShCIPK21、ShCIPK244 个家族成员;group 5 包括ShCIPK1、ShCIPK3、ShCIPK8、ShCIPK204 个家族成员。5 个group 中group 1 为3 个垂直同源对,其余4 个group 均有4个垂直同源对,除ShCIPK17和PtCIPK22这对垂直同源对外,其他均为多毛番茄和栽培番茄垂直同源对。结果表明,在多毛番茄与栽培番茄基因组之间,CIPK 基因家族具有相似的基因。
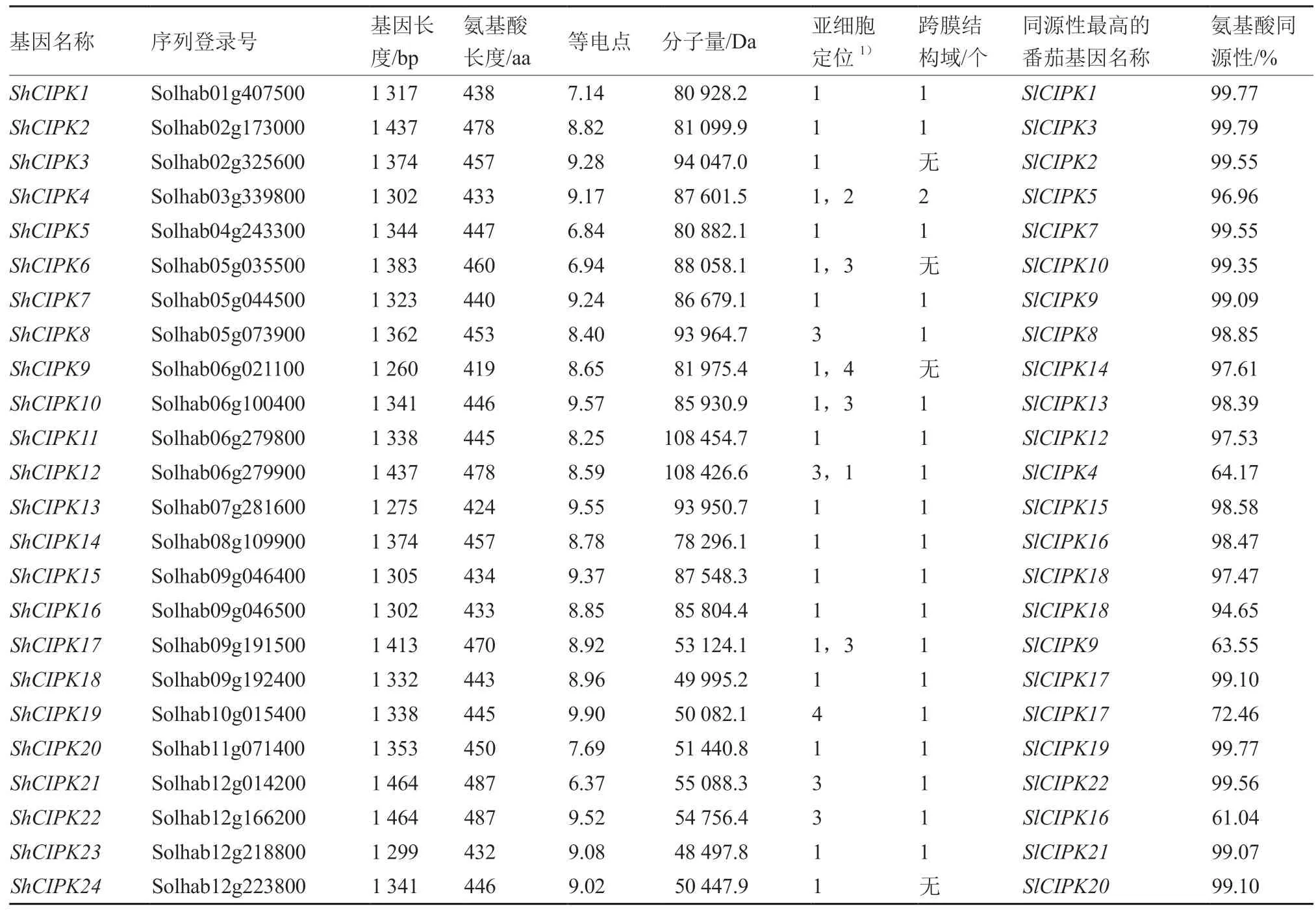
表2 多毛番茄CIPK 基因家族特征分析
2.3 多毛番茄CIPK 基因家族结构分析
如图4 所示,多毛番茄CIPK 基因家族分为内含子富集和内含子缺失两类,其中ShCIPK4、ShCIPK9、ShCIPK10、ShCIPK13、ShCIPK14、ShCIPK15、ShCIPK16、ShCIPK17、ShCIPK18、ShCIPK22、ShCIPK23无内含子,ShCIPK7、ShCIPK11、ShCIPK12、ShCIPK19只有1 个内含子,ShCIPK2有3 个内含子,属于内含子缺失;ShCIPK6、ShCIPK21有11 个内含子,ShCIPK5有13 个内 含 子,ShCIPK1、ShCIPK3、ShCIPK8、ShCIPK20、ShCIPK24有14 个内含子,以上成员均属于内含子富集组。
2.4 多毛番茄CIPK 基因家族基序分析
运用MEME 软件在番茄CIPK基因家族中预测到18 个基序,基序类型及排列顺序基本一致,同源性越高的基因基序排列相似性越高(图5)。24 个ShCIPK基因均有Motif1~Motif8 和Motif11。除ShCIPK4、ShCIPK15、ShCIPK9外均有Motif10。ShCIPK4、ShCIPK15和ShCIPK16具有相似基序且排列顺序相同,相对于家族中其他成员额外含有Motif14、Motif15 和Motif17。ShCIPK21、ShCIPK6还含有Motif18。
2.5 多毛番茄CIPK 基因家族基因复制与共线性分析
从表3 可以看出,多毛番茄CIPK 基因家族中包括ShCIPK15:ShCIPK16,ShCIPK1:ShCIPK11,ShCIPK23:ShCIPK13,ShCIPK4:ShCIPK15,ShCIPK9:ShCIPK11共5 个基因复制对。4 段重复的Ka/Ks 范围为0.031 85~0.270 09,可推测出分离时间为8.51~276 Mya(Million years ago,百万年以前)。这5 个复制基因对的片段重复的Ka/Ks 值均小于1,说明它们都经过了纯化选择。
为了进一步推断多毛番茄CIPK基因家族的系统发育关系,分别构建了模式植物拟南芥和多毛番茄(图6)、栽培番茄和多毛番茄(图7)种间共线性分析图。分析结果表明,在拟南芥中有14 个基因对与多毛番茄存在共线性关系。存在1 个基因与2 个基因共线性关系的现象,如ShCIPK2与AtCIPK12和AtCIPK13,ShCIPK15与AtCIPK4和AtCIPK7,ShCIPK19与AtCIPK14和AtCIPK22。拟南芥与多毛番茄中的共线性关系对还有ShCIPK1与AtCIPK3,ShCIPK3与AtCIPK23,ShCIPK4与AtCIPK4,ShCIPK5与AtCIPK8,ShCIPK9与AtCIPK11,ShCIPK10与AtCIPK25,ShCIPK12与AtCIPK10,ShCIPK21与AtCIPK1。
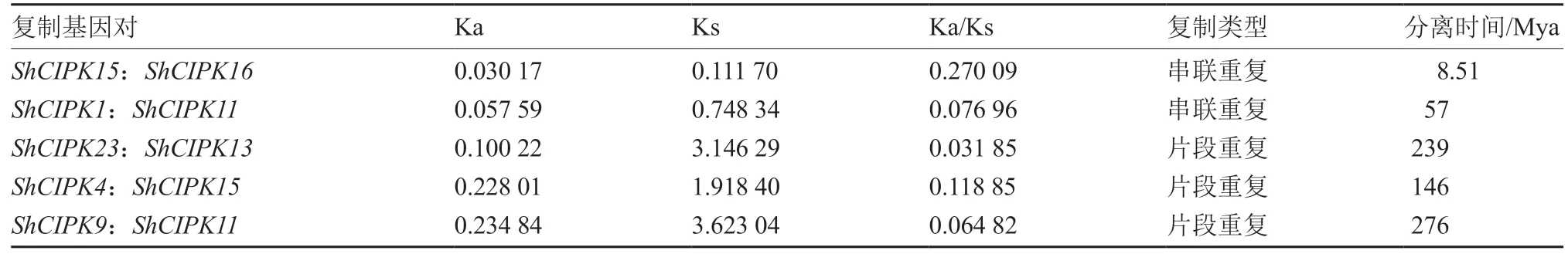
表3 多毛番茄CIPK 基因家族中的基因复制
栽培番茄和多毛番茄中存在的共线性基因对有12 个,包括ShCIPK7与SlCIPK9,ShCIPK8与SlCIPK8,ShCIPK9与SlCIPK14,ShCIPK10与SlCIPK13,ShCIPK11与SlCIPK12,ShCIPK13与SlCIPK15,ShCIPK14与SlCIPK16,ShCIPK18与SlCIPK17,ShCIPK20与SlCIPK19,ShCIPK21与SlCIPK22,ShCIPK23与SlCIPK21,ShCIPK24与SlCIPK20。栽培番茄与多毛番茄基因之间的共线性关系存在于同条染色体上。ShCIPK10和ShCIPK21这2 个基因的共线性关系存在于拟南芥和栽培番茄中,ShCIPK10、ShCIPK21、AtCIPK25、AtCIPK1、SlCIPK13、SlCIPK22等可能在祖先分离之前就已经存在。
2.6 多毛番茄CIPK 基因家族顺式作用原件分析
启动子的结构影响启动子和RNA 聚合酶的亲和力,从而影响基因表达水平。对多毛番茄CIPK基因家族成员上游1 500 bp 进行分析,存在多个与植物逆境应答相关的顺式作用元件(表4)。在顺式作用元件分析当中,除常见的 CAAT-box 和TATAbox 原件之外,可以将其分为3 类。第一类是与激素相关的原件,如ABRE、TCA。第二类是与调控相关的原件,如光(Light)调控原件。第三类是与生物胁迫相关的原件,如MBS、LTR。所有成员均有光调控顺式作用元件,超过一半的成员具有脱落酸(ABRE)、水杨酸(TCA)、厌氧诱导(ARE)、茉莉酸甲酯(CGTCA-motif)顺式作用元件。9 个家族成员有防卫和逆境应答(TC-rich repeats)顺式作用元件,8 个家族成员有冷胁迫(LTR)顺式作用原件,7 个家族成员有干旱胁迫(MBS)顺式作用元件,这些家族成员可能与胁迫应答相关。有防卫应答(W-BOX)、赤霉素(P-BOX)顺式作用元件的家族成员分别为6 个和5 个。
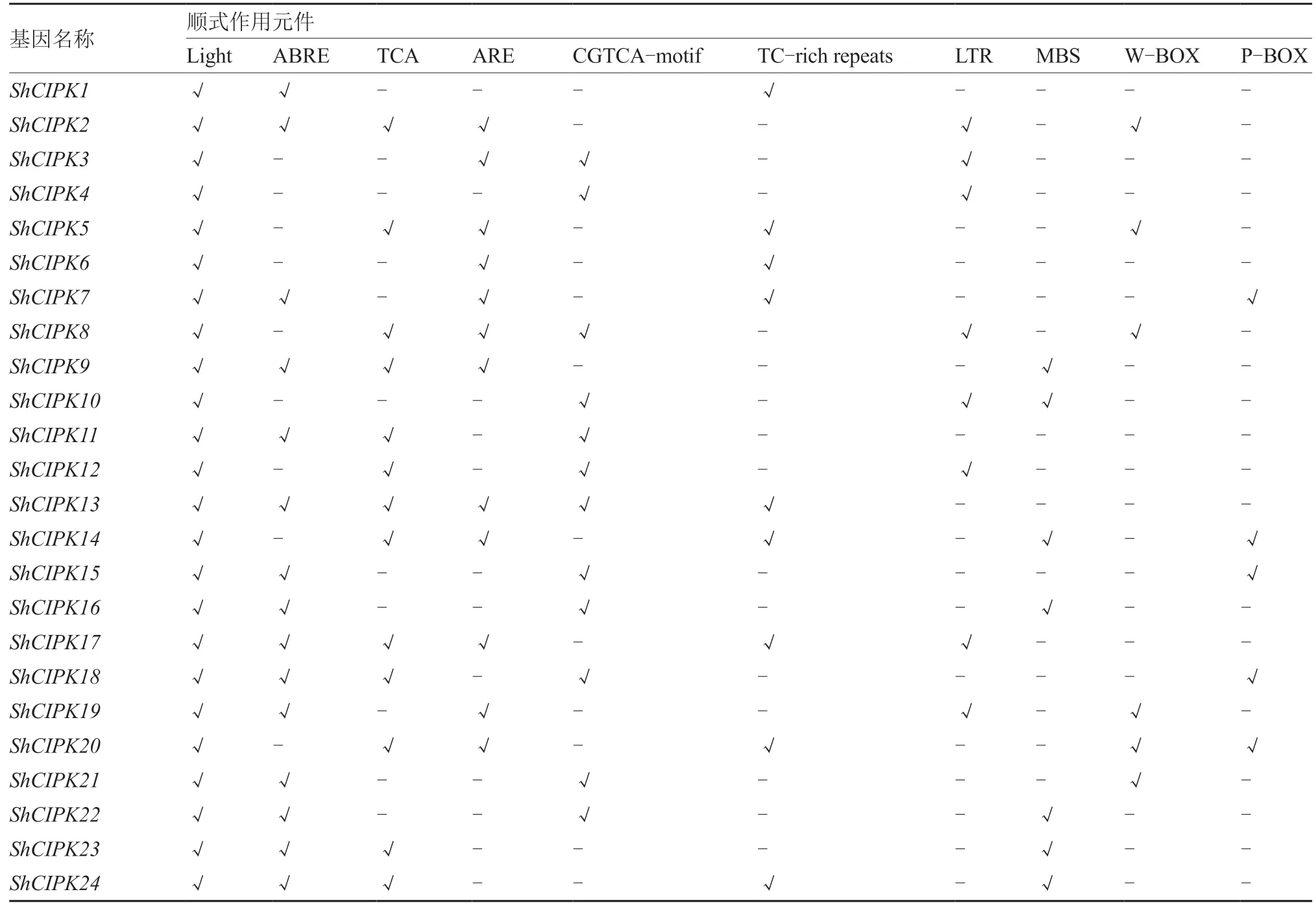
表4 多毛番茄CIPK 基因家族的顺式作用元件分析
2.7 多毛番茄CIPK 基因家族在低温胁迫下的表达分析
从图8 可以看出,多毛番茄CIPK 基因家族中各成员在低温胁迫下的表达量均有一定程度的变化,其中ShCIPK1、ShCIPK2、ShCIPK4、ShCIPK5、ShCIPK7、ShCIPK8、ShCIPK9、ShCIPK13、ShCIPK14、ShCIPK15、ShCIPK16、ShCIPK17、ShCIPK18、ShCIPK19、ShCIPK20、ShCIPK22、ShCIPK24共17 个基因家族成员低温诱导后上调表达明显,ShCIPK19、ShCIPK17表达量上调尤为显著。ShCIPK19在低温诱导下的表达量峰值最大,4 ℃诱导12 h 时的表达量为0 h 未处理叶片(对照)的89.27 倍,36 h 的表达量为对照的23.20 倍;ShCIPK17在低温诱导12 h 的表达量为对照的70.34 倍,36 h 的表达量为对照的36.61倍。在低温处理中大多数家族成员表现出表达量波动的趋势,只有ShCIPK2表达量持续上升,在36 h 达到峰值,为对照的54.13 倍。
3 讨论与结论
冻害阻碍了大多数植物的生长,对番茄的大面积栽培造成越来越大的威胁。多毛番茄具有抗冻特性,可以作为优秀的种质材料。在以往的研究中,Ca2+在冷胁迫中起着重要的作用,CIPK-CBL 配合物的功能与Ca2+密切相关。空泡Ca2+/H+逆向转运蛋白增强了CBF(CRT/DRE binding factor)基因的表达,使其具有更强的耐低温能力。ShCBF1在转基因烟草中过量表达,正调控其下游抗冷相关基因表达和相关蛋白含量改变,表现出更强的耐低温能力(葛君 等,2017)。AtCIPK3的表达对寒冷、干旱、ABA、高盐和创伤均有反应,AtCIPK3可作为冷反应信号通路中ABA 依赖、ABA 独立通路之间的“节点”(Kim et al.,2003)。AtCIPK7通过与AtCBL1相互作用在冷信号转导中发挥作用,AtCIPK7在被AtCBL1激活后,可能调节参与冷反应的其他蛋白质组分的活性(Huang et al.,2011)。BdCIPK31的异位表达增强了低温下ROS 解毒体系和渗透保护剂生物合成,参与低温胁迫应答的转录调控,是植物低温适应的一个正调控因子(Luo et al.,2018)。过表达OsCIPK3提高了转基因植株的抗寒性(Xiang et al.,2007)。小麦TaCIPK7、TaCIPK15、TaCIPK24、TaCIPK32分别诱导对低温胁迫的应答(Sun et al.,2015)。番茄SlCIPK1在低温下的表达量显著高于其他成员(王傲雪和刘思源,2018)。BnaCIPK基因在冷胁迫下转录水平会显著提高(Zhang et al.,2014)。
本试验通过生物信息学分析筛选出多毛番茄中的24 个CIPK 基因家族成员。植物CBL和CIPK基因最早在模式植物拟南芥中被发现,在拟南芥中有26 个CIPKs(Kolukisaoglu et al.,2004)。目前在多种植物中也有了CIPK 基因家族的报道。茄科植物中,栽培番茄有22 个CIPK 基因家族成员(王傲雪和刘思源,2018),茄子中有15 个(Li et al.,2016),辣椒中有21 个(刘思源 等,2017)。禾本科植物中,水稻有31 个CIPK 基因家族成员(Xiang et al.,2007),高粱有32 个(Weinl &Kudla,2009)、玉米有43 个(Chen et al.,2011)、小麦有32 个(Sun,2015)。木本植物中,杨树有27 个CIPK 基因家族成员(Zhang et al.,2008)。藤本植物葡萄有20 个(Xi et al.,2017)。除此之外,还在藻类、苔藓、蕨类、葫芦科等植物中发现了CIPK基因家族。多毛番茄CIPK 基因家族在6、9、12号染色体上分布较多,在其他染色体上分布较少这种分布不均匀的现象,与禾本科植物谷子、玉米的发现一致,基因的不平衡分布可能与物种进化和遗传变异有关。
由多毛番茄、栽培番茄、拟南芥和杨树构建的系统进化树分为5 个亚族,每个亚族均有ShCIPK分布。group 1 包括3 对多毛番茄与栽培番茄垂直同源对。group 2、group 3、group 4、group 5 均包括4 对多毛番茄与栽培番茄的垂直同源对。这些结果表明多毛番茄和栽培番茄相关的同系物基因有着保守的结构功能。对比而言,拟南芥与多毛番茄没有垂直同源对,说明多毛番茄的CIPK 基因家族与拟南芥的功能进化上出现了偏离。多毛番茄ShCIPKs分为内含子富集组和内含子缺失组,内含子外显子的组成都够反映基因家族的进化关系,内含子富集 的ShCIPK1、ShCIPK3、ShCIPK5、ShCIPK6、ShCIPK8、ShCIPK20、ShCIPK21、ShCIPK24、ShCIPK6在系统进化树中位于group 4 和group 5;内含子缺失的位于系统进化树的group1、group 2、group 3。拟南芥CIPK 基因家族也分为2 个分支,第1 种不含内含子或者只含有1 个内含子,第2 种含有9 个或者以上的内含子。内含子获得的速率相比内含子缺失的速率更慢,内含子缺失的CIPK基因的系统发生可能是在内含子富集的基因之后,推测是内含子富集的基因mRNA 反转录过程中,重新插入基因组而出现的分支。
在ShCIPKs中存在2 对串联重复基因和3 对片段重复基因。研究表明,片段重复源于胁迫。这5 对基因在保守motif 上表现出高度一致,表明串联复制和片段复制在ShCIPKs的扩增上有重要的作用。串联重复基因对的Ks 在0.111 70~0.748 34,分离时间在8.51~57 Mya。片段重复基因对的Ks 在1.918 40~3.623 04,分离时间在146~276 Mya。单双子叶分化的时期在200~205 Mya,推测ShCIPKs的片段复制发生在单双子叶分化时期(Wolfe et al.,1989)。
ShCIPKs在冷胁迫下的波动表达与小麦和玉米一致,证明ShCIPKs可能在冷胁迫应答中有重要的作用。SlCIPK1在栽培番茄CIPK 基因家族中受冷诱导表达量上升最大,表达量的峰值出现在3 h,为对照未处理叶片的50.91 倍(刘思源,2018)。本试验中,ShCIPK19、ShCIPK17上调表达显著,ShCIPK19在低温诱导下的表达量峰值最大,冷诱导12 h 时的表达量为对照的89.27 倍;ShCIPK17的表达量峰值在低温诱导下12 h,表达量为对照的70.34 倍;只有ShCIPK2的表达量持续上升,推测其可能对低温这种非生物胁迫持续作出相应反应,在36 h 达到峰值,为对照的54.13 倍。ShCIPK2、ShCIPK17和ShCIPK19这3 个基因比SlCIPK1的表达量峰值更高,具有研究价值。ShCIPK19与AtCIPK3的相似度为47.41%,推测ShCIPK19可能具有与AtCIPK3相似的功能。ShCIPK2、ShCIPK17和ShCIPK19含有LTR 冷胁迫应答原件,这与冷胁迫下的实时荧光定量试验结果相吻合。
本试验对多毛番茄CIPK 基因家族进行了全基因组鉴定、生物信息学分析和表达分析,推测ShCIPK2、ShCIPK17和ShCIPK19可能参与低温胁迫下多毛番茄钙信号调控,然而目前对多毛番茄抗冷机制认识尚未明确,接下来的试验应进一步研究ShCIPKs对冷胁迫的分子机制,打破地理分布对作物种植和园艺植物生产的影响。

