PET体积计算机辅助判读代谢评估在淋巴瘤疗效随访中的价值
王梓延,冯成涛,张海波,邓赟,郑皓,朱高红
昆明医科大学第一附属医院核医学科,云南昆明 650032; *通讯作者 朱高红 1026909611@qq.com
恶性淋巴瘤是临床常见的起源于淋巴结和淋巴组织的恶性肿瘤,根据细胞形态和组织学特征分为非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)和霍奇金淋巴瘤(Hodgkin's lymphoma,HL)[1]。实体瘤治疗疗效评价(response evaluation criteria in solid tumors,RECIST)标准采用肿瘤解剖大小的变化进行疗效评价,其修订版本RECIST 1.1 已广泛应用于临床诊疗和研究,但存在测量误差及解剖成像无法早期检测出肿瘤功能变化等不足[2]。功能分子影像技术18F-FDG PET/CT 可探测肿瘤组织的糖酵解代谢变化。Wahl 等[3]提出PET 实体瘤疗效评估标准(PET response criteria in solid tumors,PERCIST)1.0,将PET/CT检查作为治疗疗效评价的重要参考,并采用瘦体标准摄取值(SUVlean,SUL)取代标准化摄取值(SUV)以减少体重的影响,同时主张以瘦体标准摄取值峰值(peak SUV normalized by lean body mass,SULpeak)作为治疗反应最主要的定量指标。PET体积计算机辅助判读(PET volume computed assisted reading,PET VCAR)软件测量 SULpeak 可重复性高,有助于推动以SULpeak 作为主要评价指标的PERCIST 1.0 标准的临床应用。本研究拟应用RECIST 1.1 和PERCIST 1.0 标准评估93例治疗后的淋巴瘤患者,比较两种标准的一致性和治疗有效率(response rate,RR),并根据细胞组织形态学特征对患者作NHL 和HL 的分类讨论。
1 资料与方法
1.1 研究对象 回顾性收集2017年6月—2019年11月于昆明医科大学第一附属医院核医学科行18F-FDG PET/CT 扫描的5961 人次的影像资料,其中患者名字出现2次及以上878 人次。
纳入标准:①病理组织学或细胞学检查确诊为恶性淋巴瘤;②行基线PET/CT 扫描前未接受病灶切除、放化疗或激素治疗,随后化疗2~4个周期后行PET/CT观察化疗疗效;③图像基本符合PERCIST 标准要求,至少有1个可评估病灶;④无其他肿瘤病史。排除标准:①行基线PET/CT 扫描前接受治疗;②全身PET/CT检查无阳性病灶;③合并其他肿瘤;④临床资料不完整;⑤化疗前后PET/CT 扫描技术及检查前准备不在以下范围内:前后2次检查的肝脏参考感兴趣体积(VOI)平均值相差20%以内,或相差<0.3 SUL平均单位;前后2次检查注射后摄取时间在15 min内;2次检查的显像药物放射性活度应相差20%。
最终纳入93例淋巴瘤患者,其中NHL 68例,HL 25例,男52例,女41例;年龄49(35,66)岁。本研究经昆明医科大学第一附属医院伦理委员会审查批准[批准号2020(伦审)L 第25 号],所有患者均知情同意。
1.2 方法
1.2.1 PET/CT 扫描 患者禁食 6 h 以上,血糖<11.0 mmol/L。18F-FDG 由昆明医科大学第一附属医院核医学科提供,采用GE MINItrace 麒麟回旋加速器和Tracerlab FDG 合成器(FN 型号)生产合成。放化纯度>99%。静脉注射18F-FDG,剂量3.70~4.44 MBq/kg,安静休息60 min后进行扫描。使用GE DiscoveryTMPET/CT Elite 进行全身扫描,扫描范围为颅顶至股骨中段。PET图像根据患者身高采集7~8个床位,每个床位1.5~2 min,使用3D+飞行时间技术(TOF)+点扩展函数采集及重建技术。CT 采用常规全身螺旋扫描,管电压120 kV,管电流240 mA,螺距0.561,转速0.5 s/周,层厚3.75 mm,间隔3.75 mm。利用CT 扫描数据对PET图像进行衰减校正。记录患者的姓名、性别、身高、体重、血糖、注射药量、扫描时间等。
1.2.2 图像分析 所有数据上传至AW 4.6后处理工作站的PET VCAR 软件进行处理。由2名核医学科主治医师根据下述标准共同分析图像,意见不一致时协商解决。通过CT图像测定病灶的最大长径(Dmax)和短径(Dmin)。由软件自动选择肝脏右后叶1 cm3VOI为参考,以1.5倍VOI 平均SUL+2倍标准差作为定义病灶的标准,并自动计算病灶前后SULpeak。
1.3 评分标准 RECIST 1.1 标准[2]中,每个受累器官最多测量2个病灶,全身累加最多5个病灶,淋巴结短轴>15 mm 可作为检测和评估的目标病灶。①完全缓解(complete remission,CR):所有的靶病灶消失;②部分缓解(partial remission,PR):靶病灶最大径之和减少≥30%;③病情稳定(stable disease,SD):靶病灶既未消失也未进展;④病情进展(progression diseased,PD):靶病灶最大径之和至少增加≥20%或至少增加5 mm,或出现新发病灶[4-5]。
PERCIST 1.0 标准[3]中,选取基线水平代谢最高的病灶作为靶病灶,每个受累器官最多2个病灶,全身累加最多5个病灶。①完全代谢缓解(complete metabolic response,CMR):可测量靶病灶18F-FDG摄取完全消失,低于肝脏VOI 所计算阈值,且不能与周围血池本底相区别;②部分代谢缓解(partial metabolic response,PMR):可测量靶病灶18F-FDG SUL 峰值降低至少30%,SUL 绝对值下降至少0.8 SUL 单位,无新发病灶出现;③代谢进展(progressive metabolic disease,PMD):18F-FDG SUL峰值增加30%(除外炎症反应或治疗效应),或肿瘤摄取18F-FDG 的可见范围扩大,或出现新发病灶;④代谢稳定(stable metabolic disease,SMD):除外CMR、PMR 或PMD[3](图1)。
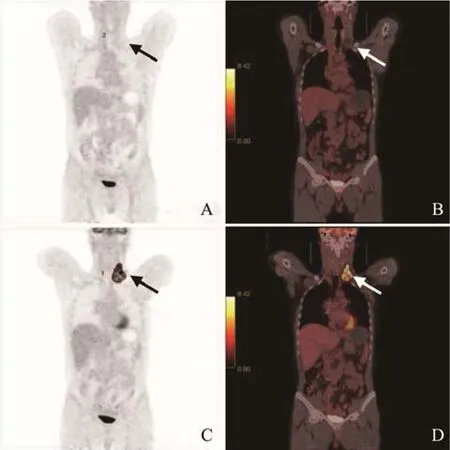
图1 男,52岁,霍奇金淋巴瘤,富于淋巴细胞型。治疗前和治疗后最大密度投影图(A、C)与PET/CT显像(B、D)显示,治疗后靶病灶(箭)18F-FDG 摄取完全消失,低于肝脏VOI所计算阈值,且不能与周围血池本底相区别。PERCIST 1.0 疗效评价为CMR
1.3 统计学方法 采用SPSS 17.0 软件,应用Kappa检验比较两种标准下PET/CT 患者疗效评估的一致性。应用配对χ2检验计算各评判标准间的 RR:RR=CMR/CR+PMR/PR,以P<0.05为差异有统计学意义。
2 结果
2.1 RECIST 1.1 与PERCIST 1.0 标准评估淋巴瘤疗效的一致性 PERCIST 1.0 与RECIST 1.1 标准评估93例淋巴瘤治疗效果的一致性欠佳(Kappa=0.272,P<0.05);对68例非霍奇金淋巴瘤和25例霍奇金淋巴瘤疗效评估的一致性欠佳(Kappa=0.253、0.316,P<0.05;表1)。
2.2 RECIST 1.1 与PERCIST 1.0 标准下RR 的比较RECIST 1.1 标准对93例淋巴瘤的RR 显著低于PERCIST 1.0 标准(RR=46%、64%,P=0.003)。在68例NHL 和25例HL 中,RECIST 1.1 标准的RR均显著低于PERCIST 1.0 标准(NHL:RR=50%、66%;HL:RR=32%、56%,P=0.043、0.031),见图2。
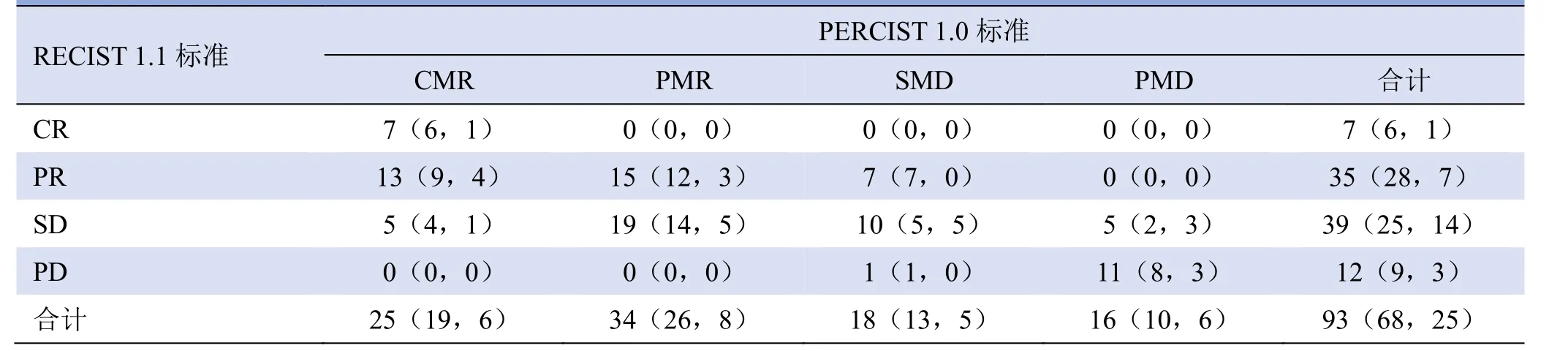
表1 两种标准对淋巴瘤疗效评估的一致性检验结果(例)
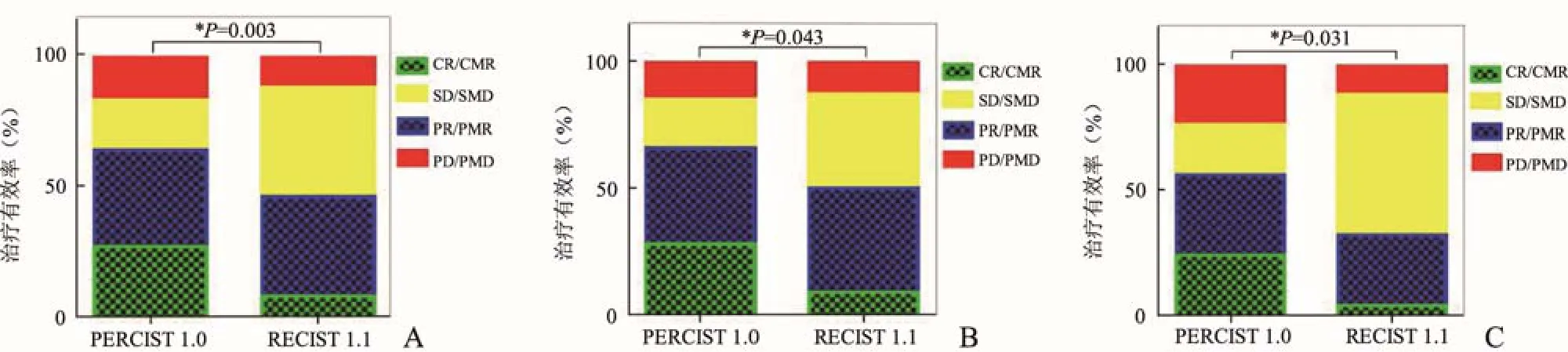
图2 RECIST 1.1 标准与PERCIST 1.0 标准治疗有效率比较。A为两种标准对93例淋巴瘤的治疗有效率;B为两种标准对68例非霍奇金淋巴瘤的治疗有效率;C为两种标准对25例霍奇金w
3 讨论
客观合理的肿瘤治疗疗效评价标准能够为肿瘤治疗提供准确可靠的RR,对后续治疗方案的选择具有重要指导意义。基于解剖结构变化的实体瘤疗效评价标准RECIST 1.1 使用一维(最大径)测量比较,并对可测量病灶大小进行明确规定,为实体瘤治疗方案提供有效的疗效反馈[6]。目前RECIST 1.1 在临床诊疗工作和临床科研中已得到广泛应用。然而,随着新型药物(如细胞生长抑制剂、抗血管生成药物、免疫疗法相关药物等)、影像学技术(PET、MRI 等)以及肿瘤生物学相关研究的发展,单一反映评估标准可能并不适合所有实体瘤。Subbiah 等[7]指出评估治疗后肿瘤的变化时,除肿瘤解剖指标外,还应考虑代谢活性指标。
PET/CT 集功能代谢显像与解剖定位显像于一体,整合体内功能代谢信息和解剖形态信息,可有效应用于淋巴瘤的疗效评估和预后判断[8-9]。多项研究使用能反映肿瘤组织中最大活性代谢程度指标SUVmax 对淋巴瘤进行疗效评估,但其稳定性易受诸多因素影响[10-11]。PERCIST 1.0 使用SUL 代替SUV 在PET/CT 中应用。SUL 由SUV 计算公式中的体重分男女进行标准化校正而得,因此可减少因体重导致的误差。SULpeak 指肿瘤病灶内最高摄取部位固定ROI 内的平均SUL值,与传统评价指标SUVmax 相比,其包含1 cm3的体素,可明显减少图像噪声。马文超等[12]对PET VCAR 自动计算SUVmax 和SULpeak值测量方法进行可靠性分析,结果表明SUVmax 与体重指数明显相关,而SUL指标不受患者体重指数及性别的影响,用于恶性肿瘤代谢定量分析比SUVmax 更为客观。此外,PERCIST 1.0 标准规定选择肝脏右后叶1 cm3VOI为参考,以1.5倍VOI 的SULmean+2×SD 作为定义病灶的标准,较仅靠人为勾画ROI 的SUVmax 重复率和精准性更高,且所测结果更为客观。
既往研究中,基于肿瘤解剖变化的RECIST 1.1 标准与基于肿瘤代谢变化的PERCIST 1.0 标准疗效评价结果比较往往一致率较低[13-15]。Yanagawa 等[16]研究发现RECIST 和PERCIST 标准疗效分级差异有统计学意义。Ding 等[14]研究表明,PERCIST 1.0 标准能够更敏感地发现治疗有效组。徐微娜等[13]报道PERCIST 1.0 标准更能准确区分CMR 与PMR,提示与RECIST 1.1 标准相比,PERCIST 1.0 的优势在于其评价结果更能反映疗效及预后情况。本研究结果显示对于93例淋巴瘤患者,PERCIST 1.0 标准与RECIST 1.1 标准评估淋巴瘤治疗疗效的一致性欠佳,其中两种标准评估68例NHL 和25例HL 疗效的一致性欠佳。本研究结果显示,RECIST 1.1 标准评估93例淋巴瘤的RR 显著低于PERCIST 1.0 标准,RECIST 1.1 标准评估68例NHL 和25例HL 的RR 均显著低于PERCIST 1.0 标准,提示肿瘤疗效偏移最常发生于解剖变化标准下的SD 患者中,其原因为放化疗后肿瘤缩小需要时间,而传统影像学方法对早期治疗反应缺乏特异性。经治疗后,肿瘤代谢改变幅度往往大于肿瘤解剖结构的改变,且前者先于后者发生改变,因此肿瘤代谢的变化能更有效地评估肿瘤疗效[17]。本研究种,7例经RECIST 1.1标准评估为PR 而代谢显像评估为SMD,其中6例弥漫性大B 细胞淋巴瘤,1例NK/T 细胞淋巴瘤,均属于侵袭性NHL。Aras 等[18]研究表明,此类患者随着病灶减小,代谢活性未发生预期的下降,可能对无进展生存造成负面影响,但仍需大样本数据进行统计随访。5例经RECIST 1.1 标准评估为SD 而,代谢显像评估为PMD(其中2例NHL,3例HL)。Min 等[15]报道,对于代谢显像降级为PMD 的患者,在随后的临床实践中需要改变治疗方案,进一步表明PERCIST 1.0 对临床治疗决策有显著影响。
PERCIST 1.0 标准也存在一定的缺点,如CMP定义中的临界值(即肝脏VOI 所测阈值或背景血池活性)可能导致阳性预测值较低[19];并且由于PET/CT 所用成像技术的自限性,该标准无法用于所有的实体肿瘤[特别是泌尿生殖系统肿瘤和原发性和(或)转移性中枢神经系统肿瘤][18]。然而,基于代谢变化评价的PERCIST 1.0 标准可更准确地识别疾病状态。本研究纳入HL 病例较少,可能造成统计学结果偏倚。今后仍需扩大样本进行前瞻性、多中心临床疗效随访研究。

