体外圈套器牵引辅助内镜黏膜下剥离术对消化道早癌患者的治疗效果*
王春蓉, 吴孟杰, 李静, 朱锋辉
(1.丹阳市人民医院 消化内科, 江苏 丹阳 212300; 2.徐州医科大学附属医院 急诊外科, 江苏 徐州 221000)
近年来消化道肿瘤患病率逐渐升高,对患者生命安全产生严重威胁[1]。随着高清内镜、放大内镜的发展及其在临床的广泛应用,大大提高了我国消化道早期癌的检出率,极大地改善了消化道癌症患者的生存率[2]。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)与传统外科手术相比,具有创伤小、费用低、恢复快及并发症少的优点[3],但因手术过程中病灶黏膜下层暴露不充分,会增加手术难度,从而导致术中出血穿孔的风险增加,因此,清晰的操作视野至关重要[4]。体外圈套器牵引辅助ESD可通过反向牵引病灶,使黏膜下视野得以充分暴露[5],但其在消化道早癌切除中的应用报道较少,同时相关研究主要集中于近期疗效的比较[6],忽略了对患者远期预后的影响。基于此,本研究将体外圈套器牵引应用于ESD手术中对消化道早癌进行治疗,分析其对患者的治疗效果和预后的影响。
1 对象与方法
1.1 对象
选取2017年7月—2019年1月消化外科收治的消化道早癌患者,纳入标准:(1)经精细胃镜、超声内镜确诊为消化道早癌或癌前病变、未发生淋巴转移并符合2010年美国癌症联合会消化道早癌或癌前病变的诊断标准者[7];(2)无严重心脑血管系统疾病、肝肾疾病及造血系统疾病者;(3)无精神障碍、语言障碍及听力障碍者;(4)临床资料完整者。排除标准:(1)中晚期消化道恶性肿瘤者;(2)合并其他恶性肿瘤者;(3)手术禁忌症者;(4)妊娠或哺乳期妇女。共纳入消化道早癌患者124人,均分为观察组(体外圈套器牵引辅助ESD术治疗)和对照组(传统性外科手术治疗)。观察组患者男33例、女29例,年龄42~63岁、平均(51.28±5.67)岁,肿瘤位于食管和胃分别有30例和32例,肿瘤直径0.5~2 cm、平均(1.21±0.41)cm;对照组患者男34例、女28例,年龄43~64岁、平均年龄(50.72±5.19)岁,肿瘤位于食管和胃分别有29例和33例,肿瘤直径0.5~2 cm、平均(1.17±0.48)cm。2组患者一般资料比较差异均无统计学意义(P>0.05)。
1.2 手术方法
对照组患者采用传统外科手术进行治疗,其中上消化道早癌患者术前8 h禁食、禁水,下消化道早癌于术前6 h服复方聚乙二醇电解质散[舒泰神(北京)生物制药股份有限公司,国药准字H20040034,批号20200224]进行肠道清洁,患者全麻、仰卧或侧卧,采用常规开放性外科手术D1/D2切除病灶,沿标记切开黏膜层,逐层剥离并切除黏膜下病灶组织,术后止血、缝合。观察组患者采用JHY-SD体外圈套器(常州市久虹医疗器械有限公司,国械注准20173250736,批号20170515)牵引辅助内镜黏膜下剥离术进行治疗,术前准备与对照组一致,首先在GVE-2600P胃镜(上海成运内窥镜设备有限公司,国械注准20163221575,批号20160930)镜头段带上透明帽,电凝标记出病灶范围,根据电凝痕迹多点注射肾上腺素(山西振东泰盛制药有限公司,国药准字H14020817,批号20160323)、亚甲蓝(济川药业集团有限公司,国药准字H20083164,批号20171108)及甘油果糖(四川美大康佳乐药业有限公司,国药准字H20043181,批号20150609)混合液;沿标记点切开黏膜层,逐层剥离;将55-0102型钛夹(杭州市桐庐医疗光学仪器总厂,国械注准20153460959,批号20150608)插入内镜,在钛夹的一侧臂上打结固定棉线,打成圈状后与圈套器连接固定,将圈套器收紧于透明帽外;重新进镜至病灶处,释放推出圈套器后适当收紧,将钛夹固定在已剥离的组织上;推送或牵拉圈套器,暴露黏膜下层,边注射边将病灶完整切除,退出圈套器和内镜,切除的病灶进行病理检查,术后常规止血、缝合。
1.3 观察指标
1.3.1手术相关指标 收集2组患者的手术时间、术中出血量及住院时间等手术相关指标信息。
1.3.2疼痛和生活质量 采用数字疼痛评分量表(Numerical pain scale ,NRS)和生命质量测定表-30(Quality of Life-Liver Cancer-30,QLQ-C30)分别对2组患者术前及术后3、6、12个月的疼痛情况和生活质量进行评价。NRS量表总分10分,0~3分属于轻度疼痛,4~7分属于中度疼痛,8~10分属于重度疼痛[8];QLQ-C30量表有30个条目,除最后2个条目分值为1~7分外,其他条目分值均为1~4分,总分126分,分值越高患者生活质量越好[9〗。
1.3.3并发症和预后 收集2组患者术后住院期间并发症(包括出血、穿孔、感染及食管返流)情况;2组患者术后随访12个月,观察患者病灶残留、转移及其他消化道癌症发病情况。
1.4 统计学分析
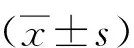
2 结果
2.1 手术相关指标
观察组患者手术时间、术中出血量及住院时间的均值均明显短于对照组,差异有高度统计学意义(P<0.001)。见表1。
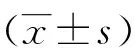
表1 观察组和对照组患者手术相关指标Tab.1 Comparison of surgical indicators
2.2 疼痛和生活质量
2组患者术后3、6及12个月的QLQ-C30评分均较术前升高,且观察组高于对照组,差异均有统计学意义(P<0.05);2组患者术后3、6及12个月的NRS评分较术前降低,且观察组低于对照组,差异均有统计学意义(P<0.05)。见表2。
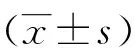
表2 观察组和对照组患者疼痛和生活质量Tab.2 Comparison of pains and quality of life between two
2.3 并发症发生及预后情况
观察组和对照组患者中分别有2例和10例出现出血、穿孔、感染及食管返流等并发症,且观察组发生率(16.13%)低于对照组(3.23%),差异有统计学意义(χ2=4.520,P=0.030);2组患者术后随访12个月均存活,均未发现原发病灶的残留及转移,观察组患者无消化道癌发生,但对照组则出现食管早期癌病灶和结肠早期癌病灶各1例。
3 讨论
消化道癌病变主要在黏膜层或黏膜下层[10],以往常通过传统外科手术对病灶进行剥离治疗,但对患者身体创伤大,且术后患者疼痛值较高[11]。同时由于手术视野等诸多因素的限制,患者术后容易发生食管反流,多数患者需终身抗反流治疗,不利于患者预后[12]。ESD是在内镜黏膜切除术基础上发展而来的利用特殊电刀剥离病灶的新型微创手术疗法[13],与传统手术相比,具有微创的优点,同时手术视野也得到了很大的扩大,但对于一些位置较为偏僻的的病变[14],随着手术的深入其操作的空间越狭小,造成手术视野难以完全暴露,手术操作难度增大[15]。此时为了能够安全方便地操作,需要有与手术操作方向相反的侧向拉力将组织提起,以便手术视野完全暴露,体外圈套器牵引辅助ESD应运而生[16]。
本研究结果发现,观察组患者手术时间、出血量和住院时间均值均明显短于对照组,NRS评分和QLQ-C30评分优于对照组,提示ESD术中联合牵引技术辅助能明显缩短手术时间、减少术中出血及改善患者预后,这与前人研究结果一致[17]。体外圈套器牵引技术能通过增加病灶组织展翘度,充分暴露黏膜或黏膜下层[18],有助于手术视野的扩大,减少手术盲区,防止误伤其他组织,有利于减少手术时间,并进一步降低术后并发症的发生[19],患者术后疼痛程度更低,术后住院时间明显缩短[20]。此外,良好的手术视野是确保消化道早癌手术安全性的前提[21],ESD的优点在于手术时间短、出血量少及并发症少,有助于提高患者术后生活质量[22]。临床研究显示,ESD术中联合牵引技术辅助能显著提高术中视野,实现安全精确地对病灶切割和剥离[23]。经查阅文献结合本研究,发现与单纯ESD相比,采用体外圈套器牵引辅助手术治疗消化道早癌具有以下优势:(1)增加病灶部位展翘度,充分暴露黏膜或黏膜下层,手术视野更清晰,有利于彻底清除病灶,同时利于术中出血部位的探查,以便快速止血[24];(2)圈套器有助于钛夹固定部位的选择,既能将剥离的黏膜或病变组织推向肛侧端,也可向口侧端牵引剥离的黏膜或黏膜下层病变组织,操作灵活,实用性更高[25];(3)操作简单,同时圈套器鞘管光滑且较粗,牵拉时对周边粘膜无损伤;(4)术后更容易取出病变组织,有利于术后病理检查和明确底切缘及侧切缘的累及情况[26]。
综上所述,体外圈套器牵引辅助ESD治疗消化道早癌可明显缩短患者手术时间和住院时间,减少术中出血和术后并发症的发生,同时彻底清除病变组织,减少其他消化道癌症的发生,患者预后更好,值得在临床推广。

