刺参精子冷冻保存方法研究
赵谭军,尹文露,邹炀,刘丽,宋坚,常亚青,湛垚垚
(大连海洋大学 农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
精子冷冻保存技术是动物种质资源保存的重要技术手段,也是目前畜牧业和渔业中种质保存及提供育种基础材料的重要途径[1-2]。水产动物的精子冷冻保存技术与方法的研究最早始于20世纪50年代,英国学者Blaxter[3]首次探讨了大西洋鲱Clupeaharengus精巢(testis)的冷冻保存技术与方法,随后,精子冷冻保存技术与方法的研究在其他水产生物(尤其是水产经济物种)中陆续开展起来。目前,水产经济动物中精子冷冻技术与方法研究开展得相对广泛、体系相对成熟的种类主要有鱼类[4-7]、贝类[8-10]和甲壳类[11-15],而关于棘皮动物精子冷冻方法的研究则相对滞后。关于海胆类精子冷冻保存方法的研究见于中间球海胆Strongylocentrotusintermediushe和新西兰巨海胆Evechinuschloroticus[16-17],这两种海胆精子的冷冻保存液均由过滤海水和不同终体积分数的冷冻保存剂二甲基亚砜(Dimethyl sulfoxide,DMSO)配制;而关于棘皮动物中经济价值较高的海参类精子冷冻方法的研究,仅见Shao等[18]的报道,此报道中,刺参Apostichopusjaponicus精子的冷冻保存液以蒸馏水为溶剂,加以一定质量的NaCl、KCl和CaCl2等5种盐类和终体积分数为15%的DMSO配制而成,不同降温方式为:先将聚乙烯网冷冻30 min,后在距离液氮6 cm处的聚乙烯网上放置0.5 mL的聚乙烯管(内含冷冻保存的精子与冷冻保存液)平衡15 min,然后直接投入液氮再转移到容器中,对刺参精子仅进行了1 h冷冻保存,结果显示,冷冻1 h后复苏的刺参精子寿命仅为1 200 s,由于冷冻时间过短且复苏后精子寿命较短,因此,该研究所提供的方法并不具备长期保存刺参精子及在生产实践中应用的潜力。
刺参隶属于棘皮动物门Echinodermata游走亚门Eleutherozea海参纲Holothuroidea,广泛分布于全球温带区及热带区海洋,是最常见的海洋高等无脊椎动物,也是重要的渔业经济种类之一[19]。20世纪80年代以来,随着人们对刺参营养价值和药用价值认识的不断提高,刺参的市场需求日益增长,人工养殖及刺参商品加工等产业的规模也逐年扩大。作为全球刺参的主要生产国和消费国,中国养殖刺参的年产量从2013年的19.4万t增加至2018年的22.0万t[20-21]。然而,受全球气候变化、生态环境破坏、水质污染和过度捕捞等多种因素影响,近年来,野生刺参的资源量急剧减少,养殖刺参则由于良种选育周期长、常年近交繁殖和杂交育种基础材料匮乏等原因而出现种质退化和单产降低等问题,严重制约和影响了刺参产业的健康可持续发展。为解决以上问题,本研究中从精子冷冻保存的关键环节着手,在借鉴其他水产物种相关研究的基础上,对刺参精子冷冻保存过程中的降温方式、冷冻保存液、精子与冷冻保存液混合比例及复苏温度4个环节进行比较和筛选,以期初步获得一种能够长期冷冻保存刺参精子及建立刺参精子资源冷冻库的方法,以便高效利用刺参良种繁育与杂交育种用精子资源。
1 材料方法
1.1 材料
本研究于2019年5—7月的刺参繁殖期内开展。试验用30头刺参取自农业农村部北方海水增养殖重点实验室,自繁家系(湿体质量为450~650 g/头)发育良好且健康有活力。目前,由于无相对成熟的技术可以进行刺参活体的性别鉴定,因此,在试验前按照常规方法对试验用刺参进行促熟和催产[22],并根据其排出的配子进行雌雄鉴别,随后将雌雄个体分开暂养于实验室500 L 循环水槽中。暂养期间,每3日换水一次,每日投喂自制饲料(1 kg海泥中加入10 g酵母和10 g螺旋藻粉),循环水槽24 h充分溶氧,自然光照周期。
1.2 方法
1.2.1 精液的获得与精子质量判定标准 随机选取暂养后恢复较好的雄性刺参,于冰上解剖,取其生殖腺于无菌滤纸上吸干体腔液,用消毒剪刀剪碎组织,将释放出的精液置于2 mL无菌冻存管中,即为本研究后续试验所用的精液样本,试验中对每次采集到的鲜精液均进行精子质量检验,精子活率达到85%以上的用于精子冷冻保存研究(表1)。
根据齐文山等[6]的方法,本研究中以精子活率、快速运动时间及精子寿命作为评价精子质量的3个指标,其中,精子活率指随机视野中运动精子占该视野全部精子的百分比,快速运动时间指精子激活到转入慢速运动的时间,精子寿命指从精子激活开始运动到99%精子停止运动的时间。按照文献[6]中的方法,用吸管醮取少许精液涂抹在载玻片上,滴加一滴海水激活,在显微镜下(Leica,DM4 B,德国)观察并记录精子活率、快速运动时间和精子寿命,以3次独立试验作为重复。

表1 各筛选步骤所用刺参的精子质量Tab.1 Sperm quality of sea cucumber Apostichopus japonicus used in each screening step
1.2.2 降温方式的筛选 利用超纯水、葡萄糖(glucose)(12 g/L)、NaCl(7 g/L)、KCl(0.7 g/L)与冷冻保存剂二甲基亚砜(DMSO)(纯度≥99.7%)配制成DMSO终体积分数为10%的精子冷冻保存液,按照精液与冷冻保存液体积比为1∶1的比例混匀后放入无菌、干燥的2 mL冻存管中,按照A、B、C 3种降温方式,进行冷冻保存,3种降温方式具体操作如下:
A:4 ℃下平衡5 min,置于-80 ℃下过夜(12 h),最后液氮保存;
B:4 ℃下平衡5 min,置于-20 ℃下平衡30 min,之后于-80 ℃下过夜(12 h),最后液氮保存;
C:三步法,将冷冻管先悬置于距离液氮表面15 cm处10 min,然后置于液氮表面处5 min,最后再浸入液氮中冷冻保存。
分别选取按照A、B、C 3种降温方式冷冻保存48 h后的刺参精子,于37 ℃恒温水浴短时快速复苏至完全融化无冰晶存在,立即取出,于显微镜下观察并记录精子质量,重复3次,筛选出最佳的刺参精子降温方式。
1.2.3 精子冷冻保存液的筛选 目前,用于配制水产动物精子冷冻保存液的溶剂主要有海水[8,16]和蒸馏水[5-7],因此,本研究中也分别尝试使用过滤消毒海水和超纯水分别配制刺参精子冷冻保存液。由于海水是刺参精子的激活剂,为避免刺参精子在海水溶剂中由于过活跃而导致冷冻过程中的机械损伤,同时尽量延长精子寿命,本研究中借鉴了鱼类精子冷冻保存液[5-7]和Shao等[18]刺参精子冷冻的配方,即加入一定比例的NaCl、KCl和CaCl2以抑制精子的活动,加入一定量的葡萄糖以延长精子寿命。预试验显示,以海水作为溶剂配制的含有NaCl、KCl、CaCl2和葡萄糖的精子冷冻保存液,冷冻保存刺参精子1~2 h后,复苏的刺参精子活率在10%以上,在此基础上进行后续正式筛选试验。
利用煮沸消毒海水或超纯水作为溶剂,分别加入葡萄糖、NaCl、KCl、海藻糖(trehalose)和无水CaCl2配制3种精子稀释液(表2),在3种稀释液中加入DMSO(纯度≥99.7%)、甘油(Glycerine,Gly)(纯度≥99.0%)或1,2-丙二醇(1,2-Propylene Glycol,1,2- G)(纯度≥99.0%)抗冻保护剂,配制成冷冻保存剂终体积分数为5%、10%和15%的27种精子冷冻保存液(表3),以精液与冷冻保存液体积比为1∶1的比例混合,用三步法降温方式进行冷冻保存,冷冻保存48 h后的刺参精子,于37 ℃恒温水浴短时快速复苏至完全融化无冰晶存在,立即取出,于显微镜下观察并记录精子质量,试验重复3次,筛选出最佳的刺参精子冷冻保存液。

表2 刺参精子稀释液的组成成分Tab.2 Ingredient of sperm cryopreservation diluents of sea cucumber Apostichopus japonicus
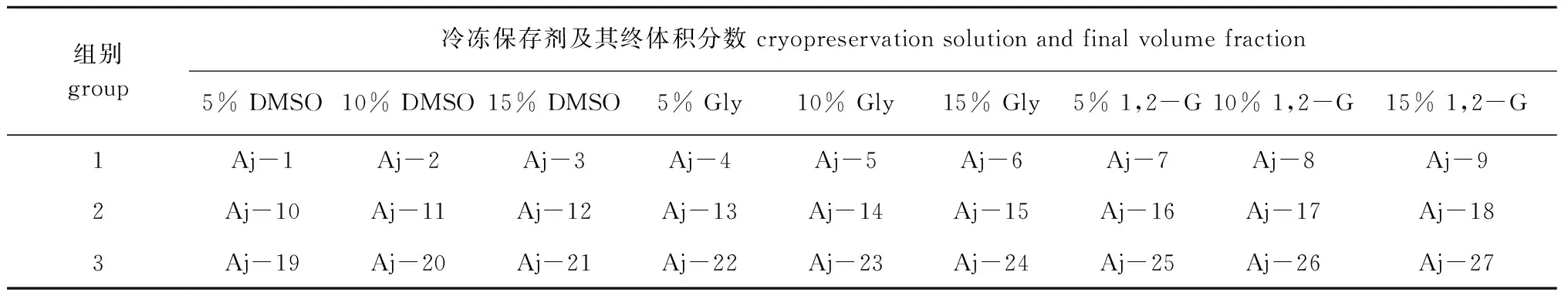
表3 刺参精子冷冻保存剂的组成成分Tab.3 Composition of sperm cryopreservation solution of sea cucumber Apostichopus japonicus
1.2.4 精子与冷冻保存液混合比例的筛选 分别以精液与冷冻保存液体积比为1∶1、1∶2和1∶3的3种比例,将刺参精子与最佳精子冷冻保存液Aj-20进行混合均匀,按照三步法降温方式进行冷冻保存,冷冻保存48 h后的刺参精子,于37 ℃恒温水浴短时快速复苏至完全融化无冰晶存在立即取出,于显微镜下观察并记录精子质量,试验重复3次,筛选出最佳的刺参精子与冷冻保存液混合比例。
1.2.5 冷冻精子复苏温度的筛选 分别以精液与冷冻保存液体积比为1∶1和1∶2的2种比例,将刺参精子与最佳精子冷冻保存液Aj-20进行混合均匀,按照三步法降温方式进行冷冻保存,冷冻保存48 h后,分别在30 ℃和37 ℃恒温水浴条件下,对冷冻保存的精子进行短时快速复苏至完全融化无冰晶存在,立即取出,于显微镜下观察不同温度条件下冷冻精子的复苏效果,并记录精子质量,试验重复3次,筛选出最佳的冷冻精子复苏温度。
1.2.6 复苏精子的受精及受精卵孵化 从分开暂养的刺参中分别选取健康、活力好的雄、雌性刺参各5头,用常规方法催产[22],收集刺参精子与卵子。以精液与冷冻保存液的体积比为1∶2的比例,将刺参精子与冷冻保存液Aj-20进行混合均匀,按照三步法降温方式进行冷冻保存,在30 ℃恒温水浴条件下,分别对冷冻保存72、120、408 h后的刺参精子进行短时快速复苏至完全融化无冰晶存在,立即取出进行授精。将收集的刺参卵子平均分到24个1 L的量杯中(注满海水后卵子约20粒/mL),将量杯随机分为4组:0 h组(鲜精液)、72 h组、120 h组和408 h组,每组设6个重复。分别将鲜精液及不同冻存时间复苏后的精子注入相对应的量杯中,加入过滤海水,水温为21~22 ℃,每隔1 h上下搅动海水,促进精卵结合(精子与卵子数量的比约为1×106∶1),受精2 h后,用0.048 mm筛绢洗卵,洗去多余精子,同时,在每组中随机挑选3个量杯,从每个量杯中取不少于100粒卵在显微镜下观察受精情况,记录并统计受精率(n=3)。 将每组剩余的3个量杯继续在21~22 ℃条件下培养,待培养至受精后第10 h,于Leica显微镜下观察每组剩余3个量杯中受精卵的囊胚孵化情况,分别记录并计算各组的囊胚孵化率。受精至孵化期间,选用过滤自然海水,温度保持在21~22 ℃,自然光照周期。
受精率=(受精卵数/总卵数)×100%,
囊胚孵化率=(囊胚期胚胎数/受精卵总数)×100%。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 25.0软件对试验结果进行单因素方差分析(One-way ANOVA),采用Student-Newman-Keuls法进行多重比较和显著性差异分析,显著性水平设为0.05。
2 结果与分析
2.1 刺参精子冷冻降温方式的筛选结果
以相同的冷冻保存液,分别按照A、B、C 3种降温方式对刺参精子进行冷冻保存。从表4可见:3种降温方式冷冻保存的刺参精子活率依次为C>B>A。其中,冷冻保存效果最差的是方式A,采用该降温方式冷冻保存的刺参精子,复苏后精子活率低(2.67%±0.58%),且快速运动时间(0 s)及精子寿命(360.67 s±23.80 s)均显著低于其他两组(P<0.05);冷冻保存的精子质量最好的是方式C(三步法),采用该降温方式冷冻保存的刺参精子复苏后,精子活率(9.67%±1.53%)、快速运动时间(543.67 s±20.5 s)及精子寿命(968.33 s±14.01 s)均显著高于其他两组(P<0.05)。因此,本研究中将方式C(三步法)筛选为刺参精子冷冻保存的最佳降温方式,用于后续技术条件的筛选。
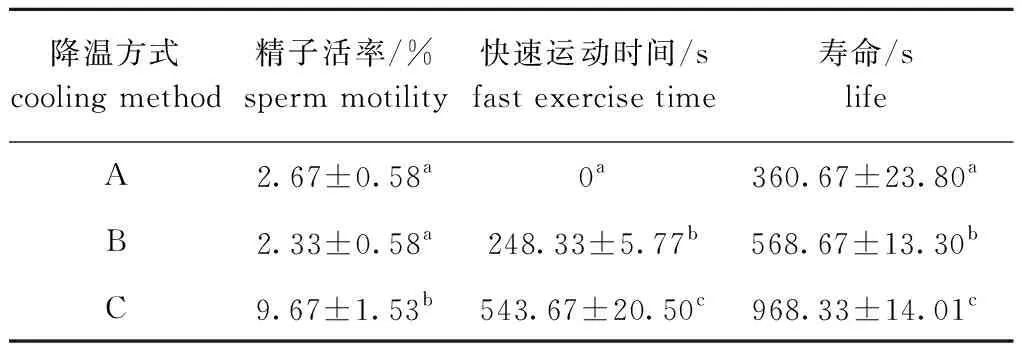
表4 不同降温方式对刺参精子活率、快速运动时间及寿命的影响
2.2 刺参精子冷冻保存液的筛选结果
从表5可见:在相同条件下,以过滤消毒海水为溶剂的冷冻保存液(Aj-1~Aj-9)中冷冻保存的刺参精子,复苏后均未检测到精子活率;而采用冷冻保存液Aj-11(DMSO终体积分数为10%)和Aj-20(DMSO终体积分数为10%)冷冻保存的刺参精子,复苏后的精子活率均显著高于其余25组(P<0.05),其中,使用Aj-20保存液冷冻保存的刺参精子,复苏后精子活率(11.78%±3%)略高于使用Aj-11保存液冷冻保存的精子(11.00%±2.33%),两者间并无显著性差异(P>0.05),但快速运动时间(431.33 s±63.86 s)、精子寿命(1 012.89 s±79.83 s)则均显著高于使用Aj-11保存液冷冻保存的精子快速运动时间(227.67 s±7.02 s) 、精子寿命(539.00 s±48.87 s)(P<0.05)。因此,确定Aj-20(12 g/L葡萄糖、7 g/L NaCl、0.7 g/L KCl、5 g/L海藻糖、0.1 g/L无水CaCl2和终体积分数为10%的DMSO)冷冻保存液为本研究中筛选到的最佳刺参精子冷冻保存液。
2.3 精子与冷冻保存液配比的筛选结果
采用“2.1节”和“2.2节”中筛选到的刺参精子最佳降温方式和冷冻保存液,进行刺参精液与冷冻保存液混合比例的筛选。从表6可见,在相同条件下,分别以精液与冷冻保存液体积比为1∶1、1∶2、1∶3的3种比例进行刺参精子冷冻保存,复苏后3种比例条件下冷冻精子的活率分别为(9.00±1.00)%(1∶1)、(11.00±2.00)%(1∶2)和<1%(1∶3),其中,以精液与冷冻保存液体积比为1∶1和1∶2的2种比例保存效果较好,能够获得一定数量有活力的精子,且精子的快速运动时间分别为(508.00±36.01)、(554.33±25.81)s。进一步统计学分析显示,精液与冷冻保存液体积比为1∶1和1∶2的2种比例保存的精子虽然在精子活率和精子快速运动时间上并无显著性差异(P>0.05),但是,当精液与冷冻保存液比例为1∶2时,冷冻保存的精子在复苏后的寿命显著高于混合比例为1∶1时冻存的精子(P<0.05)。因此,初步确定刺参精液与冷冻保存液混合的最适比例为1∶2。

表5 不同冷冻保存液对刺参精子活率、快速运动时间及寿命的影响
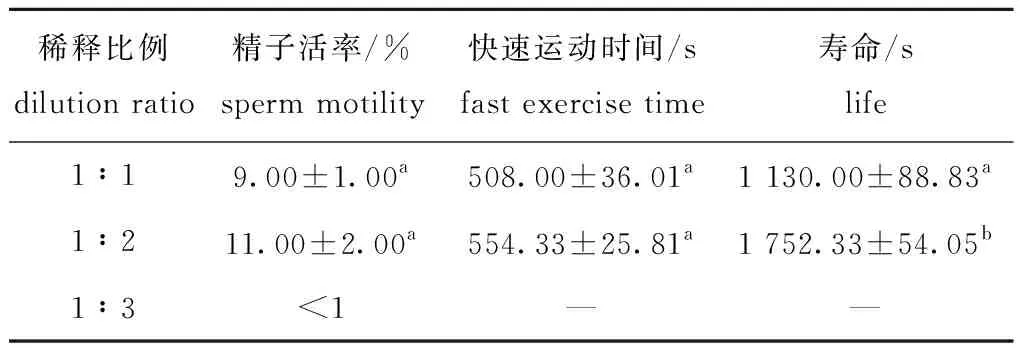
表6 精液与冷冻保存液配比对刺参精子活率、快速运动时间及寿命的影响
2.4 精子复苏温度的筛选结果
为了进一步确认“2.3节”中的初步筛选到的精子与冷冻保存液的最适比例(1∶2),同时筛选冷冻保存刺参精子的最佳复苏温度条件,采用精子冷冻保存液Aj-20,分别以精液与冷冻保存液体积比为1∶1或1∶2两种混合比例,按照三步法降温方式进行刺参精子冷冻保存,将冷冻保存的刺参精子分别在30、37 ℃恒温水浴中短时复苏后进行质量检测。结果显示:无论是30 ℃还是37 ℃条件下复苏,以1∶2比例混合的精液与冷冻保存液冷冻保存的精子在复苏后,其精子质量均高于等比例(1∶1)混合的精液与冷冻保存液,进一步证实刺参精液与冷冻保存液的最适比例为1∶2。此外,当冷冻精子在30 ℃条件下复苏后,无论精子活率、快速运动时间还是精子寿命,均优于37 ℃条件复苏组,其中,以精液与冷冻保存液体积比为1∶2配比冷冻保存的刺参精子在30 ℃水浴复苏后的精子活率最高,快速运动时间和精子寿命最长,且均显著高于其他组(P<0.05)(表7)。
2.5 复苏精子的受精及受精卵孵化试验
按照本研究中筛选出的最适刺参精子冷冻方法进行刺参精子冷冻保存,分别将冷冻72、120、408 h后的刺参精子在30 ℃恒温水浴复苏,以复苏精子与卵子数量比为1×106∶1的比例分别与收集到的同一批刺参卵子混合授精并培养,同时,以等量鲜精液与同一批刺参卵子混合授精并培养。
从图1可见:冷冻保存0 (鲜精液)、72、120、408 h刺参精子受精率分别为(92.47±2.33)%、(77.63±5.7)%、(83.72±2.33)%、(83.74±3.67)%,受精卵的囊胚孵化率分别为(79.83±2.51)%、(51.49±3.08)%、(56.47±2.56)%、(55.00±2.33)%;冷冻保存72、120、408 h的刺参精子在受精率和受精卵囊胚孵化率方面均无显著性差异(P>0.05),但与鲜精液相比,冷冻保存的刺参精子受精率和受精卵囊胚孵化率均比鲜精液低10%和30%左右,且存在显著性差异(P<0.05)。研究表明,本研究中的筛选方法适宜于刺参精子的长期冷冻保存,但仍存在一定的优化提升空间。
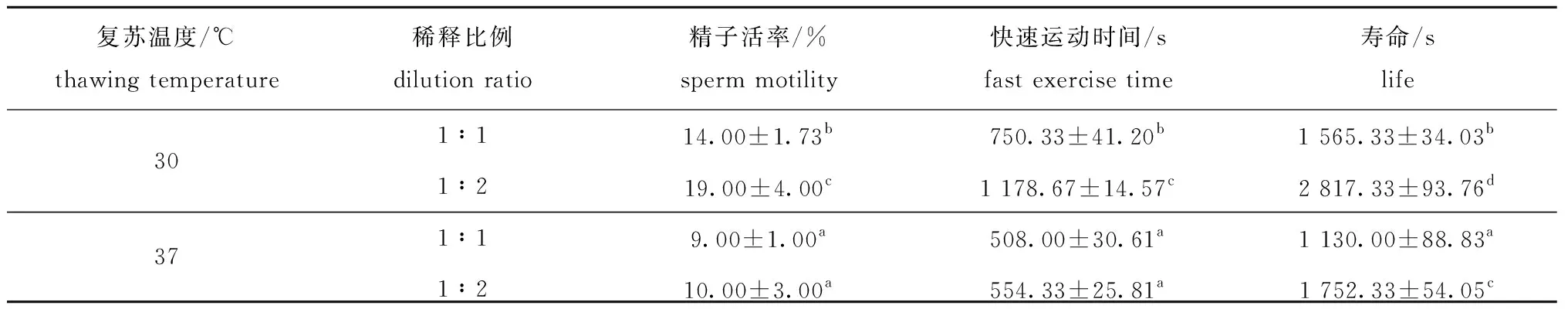
表7 不同复苏温度对刺参精子活率、快速运动时间及寿命的影响
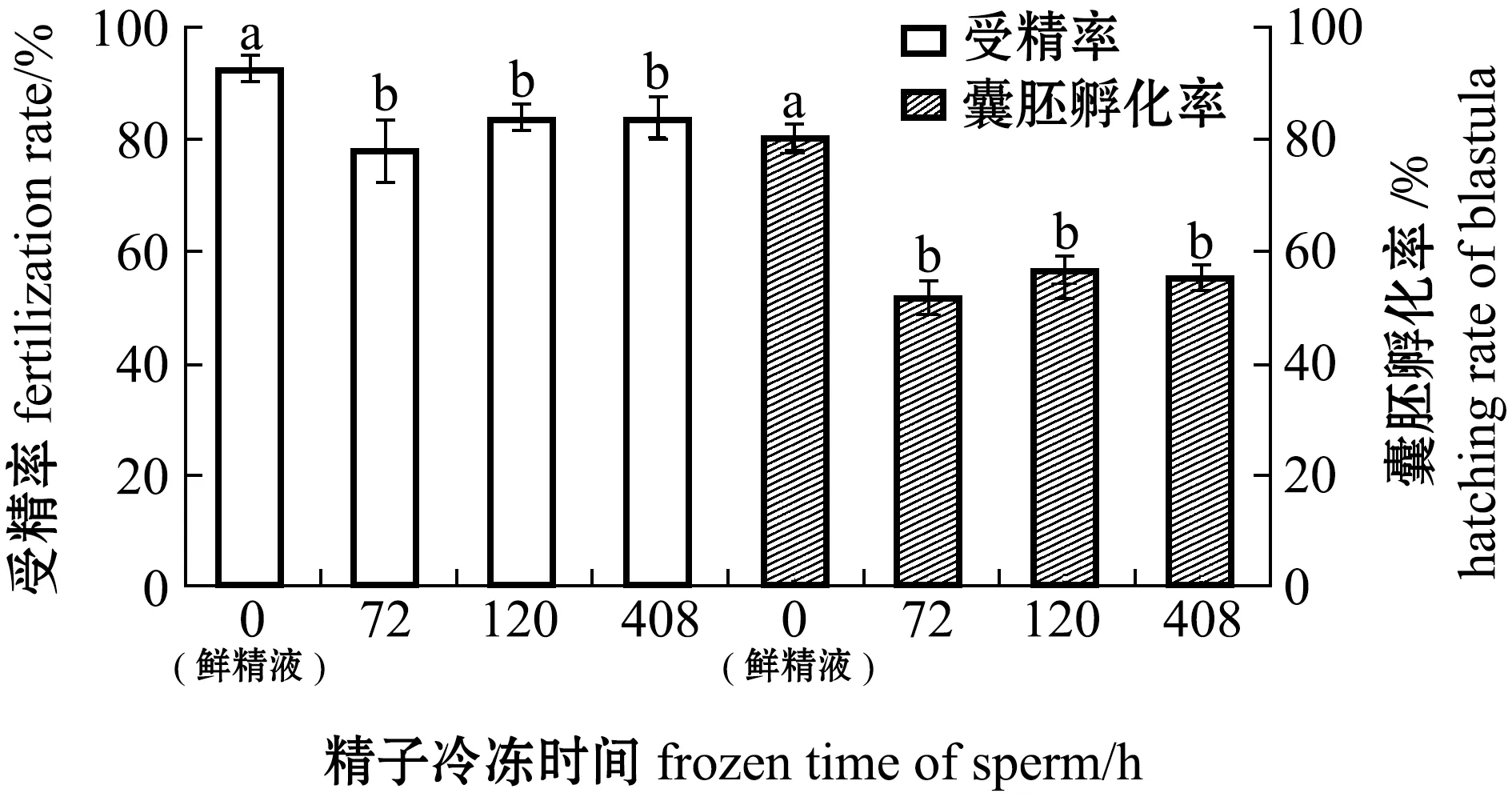
同颜色柱形图中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无差异性显著(P>0.05)。The means with different letters in the same color column chart is significant between groups (P<0.05), and the means with the same letter is not significant between groups (P>0.05).图1 冷冻保存不同时间的刺参精子受精率与囊胚孵化率Fig.1 Fertilization rate and blastula hatching rate of sea cucumber Apostichopus japonicus sperm cryopreserved at different time
3 讨论
3.1 保存液对刺参精子冷冻保存效果的影响
适宜的冷冻保存液是进行生物配子低温冷冻保存的基础前提,对精子的存活起着至关重要的作用,可有效防止细胞膜在冷冻保存时被降温过程中形成的机械剪切力损伤,以及被胞内胞外形成的冰晶刺透,保护细胞膜的完整性[23]。目前,用于冷冻保存精子的冷冻保护液主要由稀释液和冷冻保存剂组成。其中,稀释液是为了提供体外适宜的生理生存环境,通过渗透压的调节脱出细胞中多余的水分,冷冻时防止细胞中大的冰晶形成,保护精子细胞膜结构,尽可能减少精子的冷冻损伤,获得较高的复苏后存活率[24]。现有报道显示,水产动物精子冷冻保存液配制溶剂主要采用过滤海水和蒸馏水两种,其中,海胆[16-17]、贝类[8,25-26]和甲壳类[11,13]精子冷冻保存液的溶剂主要使用过滤海水,而鱼类[5-7]和海参[18]精子冷冻液的配制则多使用蒸馏水。
Shao等[18]的研究中,刺参精子冷冻液使用蒸馏水为溶剂,而与刺参同属于棘皮动物的海胆精子冷冻保存液溶剂则为消毒海水,因此,本研究中尝试分别以超纯水和消毒海水作为溶剂进行刺参精子冷冻保存液的配制。结果表明,本研究中筛选到的最佳用于刺参精子冷冻的精子稀释液为以超纯水为溶剂配制的Aj-20精子冷冻保存液(12 g/L葡萄糖、7 g/L NaCl、0.7 g/L KCl、5 g/L海藻糖、0.1 g/L无水CaCl2和终体积分数为10%的DMSO),其中,冷冻保存液中的KCl和NaCl提供的K+、Na+是精浆的重要组成成分,可以较好地维持刺参精子的渗透压;CaCl2提供的Ca2+会引起精子聚集,使得精子活率降低,对精子的活动具有抑制作用[27];葡萄糖被证实可以增强精子活率,延长精子寿命[27];海藻糖具有生物保护作用,可提高生物在低温时的存活率[28]。刺参精子的天然等渗液虽然为自然海水,但是,Shao等[18]的研究则是以蒸馏水为溶剂,通过组合5种盐类配制精子稀释液,对刺参精子冷冻保存1 h,复苏后的精子寿命仅为1 200 s,并未获得较好的冷冻效果。此外,与刺参同属于棘皮动物且地理分布区域比较相似的中间球海胆的精子冷冻保存液组成与本研究中筛选到的最佳刺参精子冷冻保存液在溶剂的选取上差别较大,刘志丹等[16]的研究显示,以煮沸消毒海水作为溶剂配制的中间球海胆精子冷冻保存液可以有效保护中间球海胆精子,由此推测,即使是相似地理分布的同类生物,其精子冷冻保存液在配方上也会存在一定的种属特异性。
本研中还发现,以海水为溶剂配制的冷冻保存液冷冻保存刺参精子1~2 h内有活力,但冷冻保存48 h后的精子却无活力,可能是由于本研究中以海水为溶剂的冷冻保存液中的生理盐、葡萄糖和抗冻剂等物质通过渐进式渗透压破坏方式影响刺参精子的活率,但其具体机制还有待进一步研究。此外,有研究指出,以蒸馏水为溶剂配制精子冷冻液的关键是各种生理盐的浓度和配比[27]。本研究中曾通过预试验对葡萄糖、NaCl和KCl等的浓度进行初步筛选,结果发现,在相同条件下,以葡萄糖(15 g/L)、NaCl(10 g/L)、KCl(1 g/L),以及葡萄糖(12 g/L)、NaCl(7 g/L)、KCl(0.7 g/L)分别配制的两种精子冷冻保存液进行刺参精子冷冻保存(48 h),复苏后的精子活率并无显著性差异,且目前关于以蒸馏水为溶剂配制刺参精子冷冻保存液的可借鉴资料较少,加之受到繁殖季节和样本量等因素制约,因此,本着节约原则,本研究中选择了葡萄糖(12 g/L)、NaCl(7 g/L)和KCl(0.7 g/L)的生理盐比例,这也说明本研究中筛选到的刺参精子冷冻液配方还有进一步优化的空间。
冷冻保存剂的主要作用是保护细胞不被温度速降过程中由冰晶产生的机械剪切力所损伤[29],目前用于生物配子低温冷冻的抗冷冻保存剂主要有DMSO、Gly、1,2- G、甲醇、乙二醇和鸡蛋黄等,其中,DMSO由于毒性较低、抗冻效果好,常被用到石斑鱼、鲑、鲟、扇贝和海胆等水产动物的精子冷冻保存[5-7,9,16],本研究结果也表明,以DMSO为冷冻保存剂保存的刺参精子质量明显优于Gly和1,2-G,从一定程度上证实了DMSO作为水产动物精子冷冻保存剂的优势。值得注意的是,本研究中发现,精子与冷冻保存液混合冷冻体系中DMSO的最终体积分数从6.67%升至7.50%时会极显著影响刺参冷冻精子的活率,比如,本研究中以精液与Aj-20冷冻保存液的体积比为1∶3和精液与Aj-21冷冻保存液的体积比为1∶1冷冻保存的刺参精子活率均低于1%,这两种比例保存液中的DMSO的最终体积分数均为7.50%,高于本研究中筛选到的最佳冷冻保存条件中的DMSO最终体积分数(6.67%),推测原因,可能是抗冻剂浓度的增加提高了细胞毒性,进而对精子造成损伤。进一步比较本研究中筛选到的最佳刺参精子冷冻保存液和已经报道的鱼类[6]、贝类[9]及海胆[16]的精子冷冻保存液发现,DMSO、Gly等可作为通用冷冻保存剂用于水产动物精子冷冻保存液的配制,但在含量配比上却存在一定的种属特异性。
3.2 降温方式对刺参精子冷冻保存效果的影响
降温方式是影响冷冻精子质量的重要因素之一,冷冻速度过快,会导致细胞内脱水不充分,不能有效阻止细胞内冰晶的生成。研究发现,冰晶化只有在0~-60 ℃的条件下缓慢降温才能生成,降温越慢,冰晶越大,在-15~-25 ℃时形成的冰晶最多,对细胞危害最大,同时,冷冻速度过慢也会导致精子失水严重,对精子质膜产生较大的压力应激,因此,在冷冻保存过程中,尽量避开这个有害温度区,才能更好地保护冻存的细胞[23]。目前,在水产动物精子冷冻保存中采用的降温方式主要有两种,一种是程序降温,即利用程序降温仪器设定降温速度进行降温,如李纯等[9]利用程序降温的方法,以20 ℃/min的速度进行降温冷冻保存了栉孔扇贝Azumapectenfarreri的精子,取得了较好的冷冻效果;另一种则是平衡法降温,即将精液处在不同温度节点进行平衡降温,刘志丹等[16]采用该方法较好地冷冻保存了中间球海胆的精子。本研究结果显示,采用平衡法降温,可以较好地冷冻保存刺参精子,与中间球海胆精子降温方式具有一定的一致性,表明在进行棘皮类动物精子冷冻保存方法研究时,可选择平衡法降温方法,且该方法操作简单,具有较好的应用于生产实践的潜力。但是,在平衡降温的具体细节上,刺参与中间球海胆仍具有一定差异,这表明采用平衡法降温进行棘皮动物精子冷冻保存在具体实施步骤上具有一定的种属特异性,应根据具体种类的精子特点进行筛选。
3.3 复苏温度对刺参精子冷冻保存效果的影响
复苏方法是影响冷冻精子质量的最后一环,其中,适宜复苏温度的确定尤为重要。目前,冷冻精子复苏时的温度范围主要有3个,即低温冰水复苏(0~5 ℃)、温水复苏(30~40 ℃)和高温复苏(50~80 ℃)[23];水产动物冷冻精子的复苏温度主要集中在20~40 ℃(温水)[5-7,9,16]。比如,哲罗鲑Huchotaimen和云纹石斑鱼Epinehelusmoara等鱼类冷冻精子的适宜复苏温度为37 ℃[5-6],冷冻的栉孔扇贝精子则在35 ℃水浴中的复苏效果最佳[9],中间球海胆的冷冻精子在20~24 ℃水浴中复苏后的活率较好。本研究中发现,冷冻的刺参精子在30 ℃恒温水浴中复苏后的精子活率较好,本研究结果与其他水产动物冷冻精子复苏温度的数据表明,水产动物精子冷冻在复苏时间上具有一定的种属特异性。但是,由于本研究中并未检测冷冻的刺参精子在30 ℃以下条件复苏后的质量,因此,刺参精子冷冻保存方法在复苏温度的选择上可能存在优化空间。
与Shao等[18]报道的刺参精子冷冻方法相比,本研究中筛选到的最佳刺参精子冷冻保存方法在冷冻保存液的盐类组成上相对简单,筛选到的冷冻保存液中的盐类仅有3种,而Shao等[18]的研究中盐类有5种,如未来应用于生产,本研究中的方法可以节约成本;其次,采用本研究中筛选到的方法进行刺参精子冷冻保存,复苏后精子寿命为(2 817.33±93.76)s,是Shao等[18]报道中复苏后精子寿命的2.3倍,且本研究中所保存的精子时间为408 h,比Shao等[18]报道中的冷冻保存1 h更久;最后,虽然使用本研究中筛选到的方法进行刺参精子冷冻,获得的复苏精子活率仅有19%左右,但是,在实际操作中,本研究中通过提高复苏精子与卵的比例(一般情况精子与卵子数量的比例为(1×103~1×104)∶1,而本研究中精子与卵子数量的比例为1×106∶1),也获得了比较理想的受精率和胚胎孵化率,且通过比较3个冷冻保存不同时间复苏后的刺参精子的受精能力及受精卵的发育情况发现,冷冻保存72、120、408 h的刺参精子的受精能力与受精卵的囊胚孵化率并无显著性差异,这表明本研究中筛选到的最佳技术方法可以用于刺参精子的长期冷冻保存,具有较好地应用于生产实践的潜力。
4 结论
1)将冷冻管悬置在距离液氮表面15 cm处10 min,然后再将冷冻管悬置在液氮表面处5 min,最后将冷冻管浸入液氮中冷冻保存的降温方式,为本研究中筛选到的刺参精子冷冻保存最佳降温方式。
2)以超纯水为溶剂配制的 Aj-20 冷冻保存液(12 g/L葡萄糖、7 g/L NaCl、0.7 g/L KCl、5 g/L海藻糖、0.1 g/L无水CaCl2和终浓度为10%的DMSO)为本研究中筛选到的刺参精子最佳冷冻保存液。
3)精子与冷冻保存液的混合比例1∶2为本研究中筛选到的最佳混合比例。
4)30 ℃水浴短时迅速复苏温度为本研究中筛选到的刺参精子最佳复苏温度。
5)按照本研究中筛选出的最佳冷冻方法进行刺参精子冷冻保存408 h,复苏后的精子与卵子的受精率可达83.74%,囊胚孵化率可达55.00%,表明本研究中筛选到的最佳冷冻保存技术方法可用于刺参精子的长期冷冻保存,具有较好地应用于生产实践的潜力。

