菲律宾蛤仔硒依赖性谷胱甘肽过氧化物酶基因克隆、表达及其对脂多糖和肽聚糖的刺激响应
王珺,梁腾,王化敏,闫喜武,丁鉴锋*
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023; 2.辽宁省贝类良种繁育工程技术研究中心,辽宁 大连 116023)
生物体有氧呼吸和氧化代谢过程中产生的活性氧(Reactive oxygen species,ROS)在介导信号转导和细胞凋亡过程中扮演重要角色,在对病原微生物的免疫过程中发挥重要作用[1]。但过量的活性氧能够引起严重的细胞损伤并导致生物体存活时间缩短[2]。因此,生物体内存在维持机体活性氧水平的机制,其中,由超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)组成的抗氧化酶系统在维持体内活性氧平衡过程中发挥重要作用[3-4]。GPx是一类内源性抗氧化酶,其通过使用谷胱甘肽(Glutathione,GSH)作为电子供体,催化过氧化氢和有机过氧化物还原为水和氧气,在保护机体免受氧化损伤过程中起着关键作用[5]。根据其亚细胞的定位、与底物的结合特性和氨基酸序列,哺乳动物GPx分为GPx1~GPx6共6个家族[4,6]。根据催化活性中心是否含硒代半胱氨酸,又将GPx分为硒依赖性谷胱甘肽过氧化物酶(Se-GPx)和非硒依赖性谷胱甘肽过氧化物酶(non-Se-GPx)。在无脊椎动物中,珠蚌属的Uniotumidus[7]和长牡蛎Crassostreagigas[8]中的GPx在抗氧化反应中发挥重要作用,而皱纹盘鲍Haliotisdiscusdiscus[6]、栉孔扇贝Chlamysfarreri[9]、凡纳滨对虾Litopenaeusvannamei[10]和中国明对虾Fenneropenaeuschinensis[11]中的GPx则参与免疫调节过程。
菲律宾蛤仔Ruditapesphilippinarum(以下简称蛤仔)是重要的海水养殖贝类,占中国滩涂养殖贝类总量的近70%[12]。在过去几十年里,蛤仔养殖过程中发生的几次大规模死亡造成严重的经济损失。造成蛤仔死亡的原因可能是环境污染导致的水质恶化,或者是弧菌、病毒等引起的感染等,因此,了解蛤仔免疫调控机制对蛤仔健康养殖具有重要意义。此外,不同壳色蛤仔对环境胁迫抗性及其免疫能力有所不同[13-14],研究不同壳色抗逆性差异机制对于蛤仔优良品系的选育具有重要的理论价值。本研究中,结合基因组数据,采用cDNA末端快速扩增技术(RACE)获得蛤仔Se-GPx基因(命名为RpSe-Gpx)全长序列,通过实时荧光定量PCR技术(RT-qPCR)对基因组织表达及不同壳色蛤仔免疫应答过程中的作用进行分析,以期深入了解Se-GPx基因在蛤仔免疫中的作用,为蛤仔壳色选育和健康养殖提供基础数据。
1 材料与方法
1.1 材料
试验用蛤仔采自辽宁省盘锦市滩涂区域,为辽宁省贝类良种繁育工程技术研究中心繁育的橙蛤、白蛤、白斑马蛤3种蛤仔,壳长为(2.0±0.5)cm。挑选壳形完整且活力较强的个体,在50 L水体的平底塑料槽中暂养一周,水温为(18.0±0.5)℃,盐度为32,溶解氧为(7.50±0.05)mg/L。每天换水一次,并投喂螺旋藻粉,持续充氧,使其适应实验室环境后再进行正式试验。
1.2 方法
1.2.1 组织表达和免疫刺激处理 取暂养的普通养殖群体蛤仔3只,采集其闭壳肌、外套膜、鳃、水管、性腺、肝胰腺和足组织样品,用液氮速冻后于-80 ℃下保存,用于基因克隆和组织表达分析。
脂多糖(LPS)和肽聚糖(PGN)用磷酸缓冲液(PBS)配制成浓度为100 μg/mL的溶液。取暂养的3种壳色菲律宾蛤仔,分别设置LPS和PGN刺激组。LPS刺激组3种壳色蛤仔各设置2个重复组,共分为6组,每组30枚蛤仔,分别向每只蛤仔血淋巴中注射50 μL LPS溶液,注射后的蛤仔置于水温为(18±0.5)℃、盐度为32、溶解氧为(7.5±0.05)mg/L、容积为50 L的养殖水槽中。分别在处理后0、6、12、24、48 h随机选取3种壳色蛤仔各3枚,取外套膜组织50~100 mg,迅速放入液氮中冷冻后于-80 ℃下保存,用于免疫刺激基因表达分析。PGN刺激组采用相同方式处理,其注射剂量也为50 μL。
1.2.2 RNA提取和反转录 按照天根生化科技(北京)有限公司动物组织总RNA抽提试剂盒说明书方法进行总RNA提取,用15 g/L琼脂糖电泳检测产物完整性,用核算分析仪(Thermo Nanodrop 2000c)检测A260 nm/A280 nm值。使用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa公司)反转录试剂盒对提取的RNA进行反转录获得cDNA。
1.2.3RpSe-GPx基因全长克隆RpSe-GPx基因开放阅读框由菲律宾蛤仔基因组数据中获取[15],以鳃组织反转录产物为模板,3′RACE采用半巢式PCR法,按照SMARTer®RACE 5′/3′ Kit说明书进行操作,所用引物见表1。
1.2.4 基因表达分析 以蛤仔Tublin基因作为内参基因,对RpSe-GPx基因表达量进行分析。引物设计见表1。本试验中采用2-ΔΔCt法计算基因相对表达量。不同组织基因表达量分析中以水管组织表达量作为对照;免疫刺激基因表达量分析中以白蛤0 h的表达量作为对照。

表1 试验使用引物序列Tab.1 Sequences of primers used in the experiment
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,采用SPSS 20.0软件进行单因素方差分析,用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 基因全长及序列分析
序列分析表明,RpSe-GPx-a cDNA序列全长1 257 bp (GenBank 登录号:MH085058.1)(图1(a)),包括582 bp的开放阅读框(ORF),编码193个氨基酸(GenBank 登录号:AVZ23985.1),5′端非编码区(5′-UTR)长度为97 bp, 3′端非编码区(3′-UTR)长度为578 bp,推导的蛋白相对分子质量为 22 250,等电点(pI)为7.71。RpSe-GPx-b序列全长为1 112 bp (GenBank 登录号:MH085059.1)(图1(b)),包括633 bp的开放阅读框(ORF),编码210个氨基酸(GenBank 登录号:AVZ23986.1),5′端非编码区长度109 bp,3′端非编码区长度为370 bp,推导的蛋白相对分子质量为24 110,等电点为8.88。使用SignalP 4.1 Server 进行信号肽预测(http://www.cbs.dtu.dk/services/SignalP/),结果显示,两个蛋白N末端无信号肽结构。使用SECISearch 2.19工具(http://genome.unl.edu./SECISearch.html)分析发现,在Se-GPx基因3′UTR区域存在SECIS元件(图2)。

起始密码子ATG和终止密码子TAA用粗体标注;硒半胱氨酸U及其密码子TGA用粗体和单下划线标注;GPx活化位点基序GKVVLVENVASLUGTT、信号肽基序LGFPCNQF和典型的GPx的活化位点基序WNFEKF用双下划线标注;SECIS元件用斜体和单下划线标注;加尾信号AATAAA用方框标注。Start codon ATG and stop codon TAA are shown in bold,selenocysteine and its codon TGA are shown in bold and underlined,GPx active site motif GKVVLVENVASLUGTT,the signal peptide motif LGFPCNQF and the typical activation site motif WNFEKF of Se-GPx are indicated in double underlined,the SECIS components are italicized and in single underlined, and the tailed signal AATAAA is boxed.图1 菲律宾蛤仔Se-GPx-a和Se-GPx-b基因全长 cDNA 序列及其编码的氨基酸序列Fig.1 cDNA sequence and the deduced amino acid sequence of Se-GPx-a and Se-GPx-b genes in Manila clam Ruditapes philippinarum
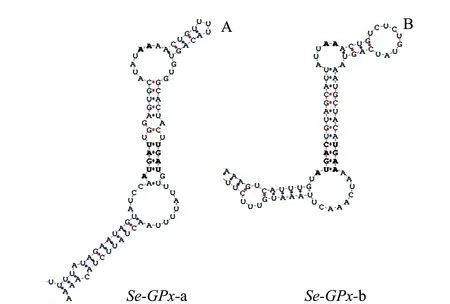
图2 RpSe-GPx-a和RpSe-GPx-b基因SECIS元件Fig.2 SECIS components of RpSe-GPx-a and RpSe-GPx-b genes
2.2 蛤仔Se-GPx基因多序列比对和系统进化分析
使用BioEdit 7.09软件的Clustal W程序进行氨基酸多序列比对。从图3可见:RpSe-GPx-a与RpSe-GPx-b基因一致性为67%;RpSe-GPx-a基因与三角帆蚌序列一致性最高,为73%;RpSe-GPx-b基因与背角无齿蚌序列一致性最高,为71%。此外,硒代半胱氨酸位点、GPx活化位点基序GKVVLVENVASLUGTT和典型的GPx活化位点基序WNFEKF在选用的物种中高度保守,此位点和两个功能域与GPx的催化活性相关[7]。
为进一步分析菲律宾蛤仔Se-GPx在进化中所处的地位,利用MEGA 6.0软件,基于邻接法(Neighbor-joining,NJ)构建34个物种的Se-GPx氨基酸序列的系统进化树。从图4可见,所使用物种的GPx1~GPx6各自聚集到相应分支,而菲律宾蛤仔Se-GPx-a和Se-GPx-b则聚为一支,并与其他软体动物Se-GPx聚集在一个单独的分支中,这表明软体动物Se-GPx可能具有区别于脊椎动物的共同进化途径。
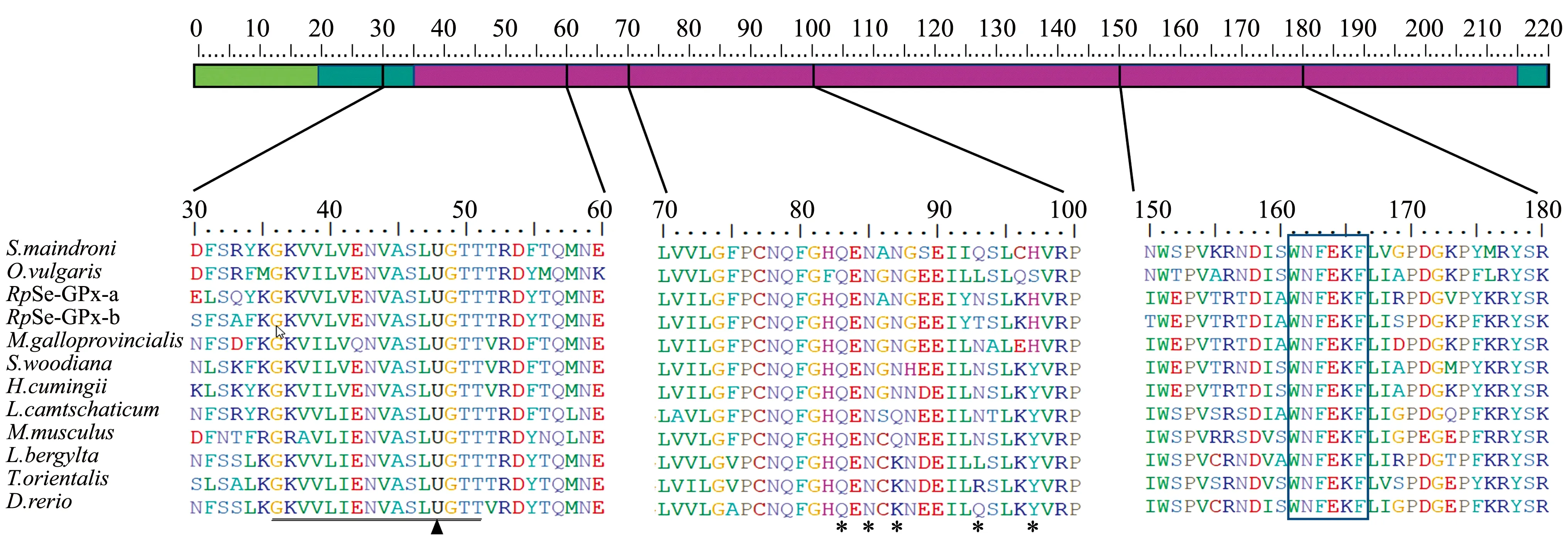
曼氏无针乌贼(ID: AEK48346,AGZ63440)、紫贻贝(ADY38576)、背角无齿蚌(ANG56607)、三角帆蚌(ACY72387)、真蛸北极七鳃鳗(AIU44099)、小鼠(NP_109602)、双斑隆头鱼(XP_020497739)、蓝鳍金枪鱼(BAL41419)和斑马鱼(NP_001007282);硒代半胱氨酸位点(U)用三角号标注;GPx活化位点基序GKVVLVENVASLUGTT用下划线标注;典型GPx活化位点基序WNFEKF用方框标注;参与二聚体形成的氨基酸残基用星号标注。Sepiella maindroni,Octopus vulgaris, Mytilus galloprovincialis,Sinanodonta woodiana,Hyriopsis cumingii,Lethenteron camtschaticum,Mus musculus,Labrus bergylta,Thunnus orientalis,and Danio rerio; Highly conserved regions are shown in the figure and completely conserved selenocysteines (U) are indicated with a black triangle;the GPx signature motif (GKVVLVENVASLUGTT) is underlined and the active site motif (WNFEKF) is boxed,and residues involved in making dimer interface are marked with asterisks.图3 菲律宾蛤仔Se-GPx氨基酸序列多重比较Fig.3 Multiple amino acid sequence alignments of Se-GPx in Manila clam Ruditapes philippinarum
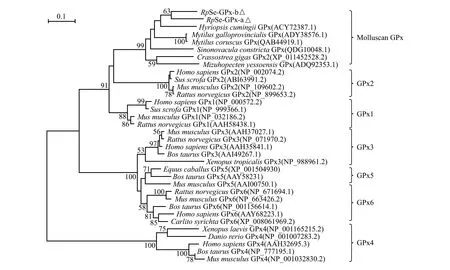
图4 菲律宾蛤仔Se-GPx系统进化分析Fig.4 Phylogenetic analysis of Se-GPx family amino acid sequences in Manila clam Ruditapes philippinarum
2.3 蛤仔Se-GPx基因的组织表达
从图5可见:蛤仔Se-GPx基因在闭壳肌、外套膜、鳃、水管、性腺、肝胰腺和足组织中均有表达;Se-GPx-a和Se-GPx-b在肝胰腺中表达量均最高(P<0.05),分别在外套膜、鳃组织中表达量次之,而闭壳肌中表达水平均最低(P<0.05)。
2.4 LPS刺激下3种壳色蛤仔Se-GPx表达变化
使用Ttublin作为内参基因,对3种壳色蛤仔Se-GPx基因在LPS刺激下外套膜的相对表达量水平进行检测。从图6(a)可见:白蛤Se-GPx-a基因表达量在12 h时达到最大值(P<0.05),且显著高于其他2种壳色蛤仔(P<0.05);白斑马蛤Se-GPx-a表达量在48 h时达到最大值(P<0.05),且显著高于其他2种壳色蛤仔(P<0.05);橙蛤Se-GPx-a表达量在3 h时达到最大值(P<0.05),在3、6 h时表达量均显著高于其他2种壳色蛤仔(P<0.05)。从图6(b)可见:白蛤和白斑马蛤Se-GPx-b基因表达量均在6 h时达到最大值(P<0.05),且均显著高于橙蛤(P<0.05);橙蛤Se-GPx-b表达量在24 h时达到最大值(P<0.05),且显著高于其他2种壳色蛤仔(P<0.05)。

标有不同字母者表示同一种基因不同组织间有显著性差异(P<0.05),标有相同字母者表示无显著性差异(P>0.05)。The means with different letters in the same gene are significantly different in the different tissues at the 0.05 probability level, and the means with the same letter are not significant differences.图5 菲律宾蛤仔Se-GPx基因的组织表达Fig.5 Expression levels of Se-GPx gene in various tissues in Manila clam Ruditapes philippinarum

标有不同大写字母者表示同一时间下3种壳色蛤仔间有显著性差异(P<0.05),标有不同小写字母者表示同一壳色蛤仔在不同时间点有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。Note:The means with different capital letters at the same time are significantly different among shell-colour groups at the 0.05 probability level; the means with different letters in different time at the same shell-colour group being significantly different at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.图6 LPS刺激下3种壳色蛤仔外套膜组织中Se-GPx mRNA表达量比较Fig.6 mRNA expression level of Se-GPx mRNA in mantle of three shell-colour Manila clam challenged with LPS at different time intervals
2.5 PGN刺激下3种壳色蛤仔Se-GPx表达变化
从图7(a)可见:白蛤外套膜组织中Se-GPx-a基因表达量在24 h时达到最大值(P<0.05),且显著高于其他2种壳色蛤仔(P<0.05);白斑马蛤Se-GPx-a基因表达量在24 h时达到最大值(P<0.05),在48 h时显著性下降(P<0.05);橙蛤Se-GPx-a基因表达量在48 h时达到最大值(P<0.05),且显著高于其他2种壳色蛤仔(P<0.05)。
从图7(b)可见:白蛤Se-GPx-b基因表达量在24 h时达到最大值(P<0.05),在6 h时显著高于其他2种壳色(P<0.05);白斑马蛤Se-GPx-b基因表达量在24 h时达到最大值(P<0.05),在12 h和24 h时显著高于其他2种壳色蛤仔(P<0.05);橙蛤Se-GPx-b基因表达量在48 h时显著升高并达到最大值(P<0.05),在0、3、48 h时均显著高于其他2种壳色蛤仔(P<0.05)。

图7 PGN刺激下3种壳色蛤仔外套膜组织中Se-GPx mRNA表达量比较Fig.7 mRNA expression level of Se-GPx mRNA in mantle of three shell-colour Manila clam challenged with PGN at different time intervals
3 讨论
3.1 蛤仔Se-GPx基因序列特征
本研究中,蛤仔Se-GPx-a中第184~186位和Se-GPx-b中第183~185位发现密码子TGA,在不含硒蛋白中,UGA往往被识别作为终止密码子,而在含硒蛋白中,可识别并翻译作为Se-Cys,成为硒蛋白的重要部分并作为催化基团发挥作用[16]。此外,真核生物中处于3′UTR区域的硒代半胱氨酸插入元件(SECIS)则是密码子UGA被翻译成Se-Cys所必需的结构[17]。在蛤仔Se-GPx的3′UTR区域存在SECIS结构,由此可以推断,蛤仔Se-GPx为含硒依赖性谷胱甘肽过氧化物酶且具有与其他物种Se-GPx类似的抗氧化功能[3,6]。
3.2 蛤仔Se-GPx基因的组织表达
对皱纹盘鲍[3]、栉孔扇贝[9]、菲律宾蛤仔[18]、珠蚌属的Uniotumidus[7]、淡水双壳蚌Dreissenapolymorpha[19]等贝类的研究发现,其肝胰腺组织中均有高表达量的Se-GPx基因。对紫贻贝Mytilusedulis和Mytilusgalloprovincialis的研究发现,其肝胰腺消化细胞内溶酶体能够蓄积细胞内离子转移过程中产生的ROS[20]。而保护溶酶体膜免受氧化损伤,可能是贝类肝胰腺中较高Se-GPx基因表达量的重要原因之一。此外,对青蛤Cyclinasinensis的研究发现,其组织抗氧化能力依次为肝胰腺>外套膜>鳃[21]。本研究结果与上述文献结果一致,蛤仔肝胰腺中Se-GPx基因高表达,且蛤仔外套膜和鳃组织中Se-GPx基因可能与其组织抗氧化能力密切相关。
3.3 3种壳色蛤仔Se-GPx基因免疫应答反应比较
谷胱甘肽过氧化物酶能够催化降解体内的各种ROS保护机体免受氧化损伤,并在先天免疫反应过程中扮演重要角色[22]。本研究中3种壳色蛤仔Se-GPxmRNA表达量在LPS和PGN刺激后均表现出了一个增加的过程。研究发现,皱纹盘鲍在使用革兰氏阴性菌弧菌Vibrioalginolyticus感染后其体内Se-GPx能够被诱导表达[6];凡纳滨对虾Se-GPx表达量在弧菌Vibrioalginolyticus感染后的12 h呈现出升高过程[10];斑节对虾PenaeusmonodonSe-GPx基因表达量在被美人鱼发光杆菌Photobacteriumdamsela感染后6~12 h也表现出显著升高过程[4];栉孔扇贝感染Listonellaanguillarum8 h时体内Se-GPx基因表达量显著升高[9];罗氏沼虾Macrobrachiumrosenbergii注射汉斯德巴氏酵母菌Debaryomyceshansenii后Se-GPx基因表达量显著升高[23]。本研究中3种壳色蛤仔经LPS和PGN刺激后,Se-GPx表达量均显著升高,并在不同时间点呈现最大值,蛤仔Se-GPx基因表达量增加可能是细菌感染导致的呼吸爆发产生大量的活性氧,导致作为抗氧化组分的Se-GPx基因被大量诱导表达的结果[6]。研究表明,无脊椎动物对LPS和PGN刺激具有不同的免疫反应途径,LPS通过与体内革兰氏阴性菌结合蛋白结合,激活蛋白酶级联反应,诱导抗菌肽的合成,并可以促进血淋巴吞噬、黑化、包囊和凝集反应[24];而PGN主要与肽聚糖识别蛋白结合,激活酚氧化酶途径,产生黑色素和活性氧完成其免疫响应过程[25]。酚氧化酶表达量差异所导致的黑色素合成及分布的不同是贝类产生壳色变化的一个重要因素[26-27]。此外,对3种壳色菲律宾蛤仔转录组分析发现,其酚氧化酶基因表达量依次为白斑马蛤>白蛤>橙蛤,且白斑马蛤表达量显著高于白蛤和橙蛤[28]。本研究中,使用LPS刺激时,白斑马蛤和白蛤Se-GPx-a和Se-GPx-b基因表达量增加幅度显著高于橙蛤,使用PGN刺激时,橙蛤Se-GPx-a和Se-GPx-b基因表达量增加幅度显著高于白蛤和斑马蛤,两种刺激剂对酚氧化酶诱导途径差异所引起的活性氧生成量不同,可能是蛤仔Se-GPx基因表达量差异的主要原因。在活性氧清除过程中,白斑马蛤和白蛤体内黑色素能够参与并一定程度替代了抗氧化酶的作用[29],因此,PGN诱导后白斑马蛤和白蛤两种蛤仔的Se-GPx表达量要略低于橙蛤。
综上所述,壳色形成机制差异是导致3种壳色蛤仔Se-GPx基因对LPS和PGN刺激后出现不同响应过程的重要原因之一,本研究结果可为菲律宾蛤仔壳色选育及健康养殖提供数据资料。

