苹果蠹蛾瞬时感受器离子通道基因的克隆及温度胁迫表达分析
梁林 吕志创 武强 刘怀 刘万学 万方浩


摘要 :瞬時感受器离子通道(transient receptor potential, TRP)是影响昆虫温度感知系统的关键组成。为探讨苹果蠹蛾温度感知和温度适应的机理,本研究以苹果蠹蛾Cydia pomonella为研究对象,通过分子克隆获得TRPA家族中的CpPainless和CpWater_witch基因,进行生物信息学分析,并利用实时荧光定量PCR技术分析靶基因在高低温胁迫后的表达。结果表明,CpPainless基因编码938个氨基酸,N端有8个锚蛋白重复序列。CpWater_witch基因编码980个氨基酸,N端有10个锚蛋白重复序列,二者编码产物均有6个跨膜结构,具瞬时感受器离子通道家族成员结构典型特征。表达分析结果显示,和对照26℃相比,高低温胁迫1 h后,CpPainless在5龄幼虫雌虫体内的表达量显著下调,而5龄幼虫雄虫经低温胁迫1 h后CpPainless表达量显著上调,但高温胁迫1 h后表达差异不显著;CpWater_witch在雌雄虫体内均没有显著变化。研究结果为研究瞬时感受器离子通道在苹果蠹蛾温度感知中的作用奠定基础。
关键词 :苹果蠹蛾; 瞬时感受器离子通道; 温度感知; 温度胁迫; 表达量
中图分类号: S 436.611.29
文献标识码: A
DOI: 10.16688/j.zwbh.2019564
Cloning and expression analysis of transient receptor potential gene in Cydia pomonella under temperature stress
LIANG Lin1,2, L Zhichuang2, WU Qiang2, LIU Huai1, LIU Wanxue2, WAN Fanghao2*
(1. College of Plant Protection, Southwest University, Chongqing 400715, China; 2. State Key
Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,
Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract :TRP (transient receptor potential) is a key component of the temperature sensing system in insects. To understand the mechanism of temperature perception and temperature adaptation in Cydia pomonella, CpPainless and CpWater_witch, which belong to TRPA subfamily, were cloned by RTPCR (reverse transcription PCR). After conducting bioinformatics analysis, quantitative realtime PCR was applied to characterize the relative expression levels of two genes at different temperature stresses. CpPainless and CpWater_witch were successfully predicted and cloned, which encoded 938 amino acids and 980 amino acids, respectively. Protein structure analysis indicated that CpPainless and CpWater_witch had 8 ankyrin repeats and 10 ankyrin repeats, respectively. Both of the genes had 6 transmembrane domains, which is the structural signature of TRP. The RTPCR analysis showed that the expression level of CpPainless was significantly decreased in female 5thinstar larvae 1 h after temperature stress, but significantly increased in male 5thinstar larvae 1 h after lowtemperature stress, whereas there was no significant difference in male larvae 1 h after hightemperature stress; besides, CpWater_witch did not show significant difference in both male and female 5thinstar larvae after temperature stress. The results laid a foundation for further understanding of the role of transient receptor channels in temperature perception of C.pomonella.
Key words :Cydia pomonella; TRP channel; temperature sensing; temperature stress; expression
苹果蠹蛾Cydia pomonella (L.)属鳞翅目Lepidoptera小卷蛾科Olethreutidae,是最重要的世界性检疫性害虫之一,其以幼虫蛀食果实为害,严重降低果实品质[1],并导致果实成熟前腐烂和脱落[2],给世界各地苹果、沙果、梨、桃、杏、石榴等水果的生产带来了毁灭性危害[3]。苹果蠹蛾原产于欧亚大陆南部,现已广泛分布于除南极洲外其他各大洲的各大苹果产区[4]。在我国,苹果蠹蛾也具有广泛的适生区域,其中中高度适生区主要包括黑龙江、内蒙古、北京、新疆等省(市、自治区)的大部分地区,以及辽宁西部、青海北部、云南北部、及山东沿海等地区[6],而最佳适生区几乎包括了我国苹果、梨等水果的全部主产区[7],提示其具有广泛的温度适应性。为更好地理解苹果蠹蛾温度适应能力,研究苹果蠹蛾怎样感知外界温度并将其传递至体内具有重要意义。
瞬时感受器离子通道(transient receptor potential, TRP)是一种阳离子通道,可允许包括钙离子在内的阳离子进行跨膜运输,最早发现于黑腹果蝇Drosophila melanogaster视觉信号通路[8]。之后发现TRP通道是多种感觉机制中的关键因子,如视觉、听觉、化学感受、机械感受和温度感受[9]。1989年Montell等[10]成功克隆了TRP基因。迄今为止,在生物中已鉴定出30多个TRP通道[11],经研究,TRP蛋白包含6个跨膜域結构(S1~S6)[12]。根据基因的功能及同源性,可将TRP基因家族分为7个主要亚家族[13]:TRPC(canonical)、TRPV(vanilloid)、TRPM(melastatin)、TRPML(mucolipin)、TRPP(polycystin)、TRPA(ankyrin transmembrane protein)和 TRPN(NomPClike)。对温度敏感且参与生物体环境温度感知的TRP,称为thermoTRP[14]。
ThermoTRP 的活性与温度密切相关[15]。果蝇体内已鉴定出13个TRP通道[9],有6个thermoTRP[16],其中TRPA1、Painless、Pyrexia均属于TRPA亚家族。研究表明,果蝇体内的painless基因是伤害性高温激活其感觉神经过程中所必需的[17]。此外,膜翅目昆虫中同样属于TRPA亚家族的Water_witch,在复制过程中形成的HsTRPA也参与了温度感知[18]。因此,本文选取TRPA亚家族中的painless和Water_witch两个基因,对其在苹果蠹蛾体内是否参与温度感知过程进行探讨。
本研究克隆了苹果蠹蛾中的2个TRP通道基因,并进行了生物信息学和温度胁迫下靶基因表达的分析,以期为其在苹果蠹蛾温度调节机制中的作用研究提供参考。
1 材料与方法
1.1 供试昆虫
苹果蠹蛾以人工饲料饲养于中国农业科学院植物保护研究所P2实验室。饲养条件为:温度(25±1)℃,相对湿度(75±5)%,光周期L∥D=14 h∥10 h。
1.2 总RNA提取及第一链cDNA的合成
取一头5龄幼虫,采用TRIzol(Invitrogen,USA),参照其说明书进行RNA提取,采用Implen超微量紫外可见分光光度计(NanoPhotometerTM PClass)和1%琼脂糖凝胶电泳鉴定RNA的纯度和完整度。采用Super Script FirstStrand Synthesis System试剂盒反转录合成第一链cDNA,并于-20℃保存备用。
1.3 TRP基因cDNA序列片段的克隆
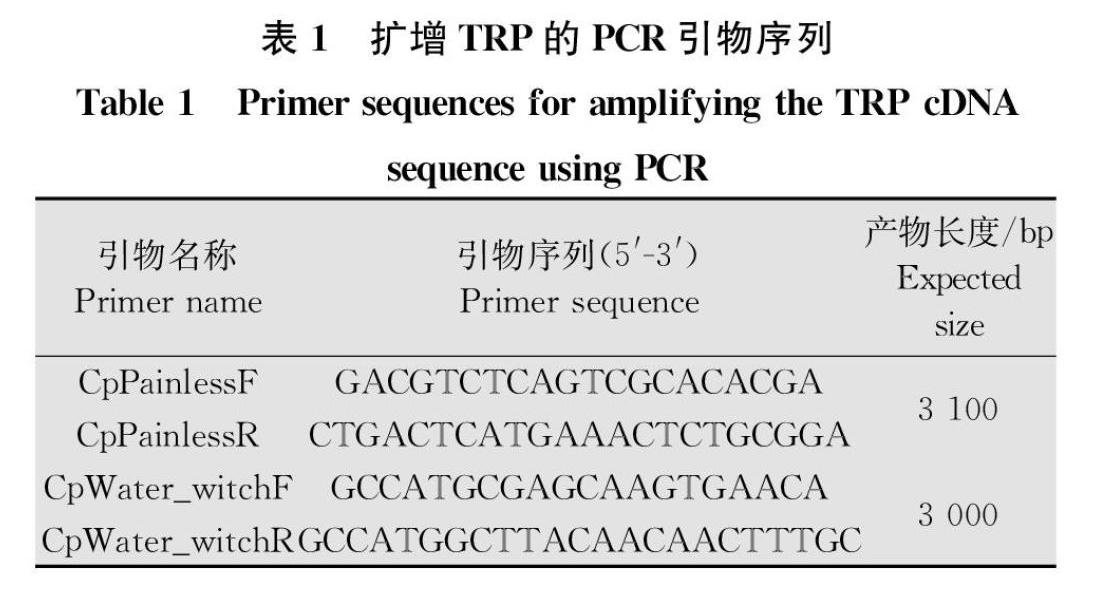
通过生物信息学的方法,分别以黑腹果蝇 TRPA亚家族中Painless 和Water_witch两个基因序列作为参考序列,用tBlastn从苹果蠹蛾转录组数据库中检索CpPainless 和CpWater_witch的基因序列,之后根据检索结果,使用Primer premier 5.0 设计引物,使用RTPCR(reverse transcriptionpolymerase chain reaction) 方法从苹果蠹蛾cDNA 中克隆CpPainless 和CpWater_witch的序列。
PCR扩增反应体系(25 μL):2.5 μL 10× PCR buffer,0.5 μL dNTPs,上下游引物各1 μL,0.5 μL TransStart Taq DNA聚合酶,19 μL ddH2O,0.5 μL cDNA模板。反应条件:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 3 min 10 s,35个循环;72℃ 10 min。
PCR 扩增产物用1%琼脂糖凝胶电泳进行鉴定,经琼脂糖凝胶回收试剂盒纯化后,与TransGen pEASYT1 Cloning Vector连接,转化至Trans1T1感受态细胞中,接种至含Ampicillin、Xgal 和IPTG 的LB 固体培养基37℃培养12 h。挑取白色单菌落于含Amp的LB液体培养基中摇床培养10 h,选出重组克隆,送上海生工生物工程技术服务有限公司测序。
1.4 苹果蠹蛾TRP基因生物信息学分析
1.4.1 TRP基因cDNA序列分析
应用MEGA 5软件对预测序列与克隆序列进行比对,确定克隆序列与预测序列一致后,采用DNAMAN软件对所得基因cDNA序列进行分析;利用ORF Finder(http:∥www.ncbi.nlm.nih.gov/gorf/gorf.html) 工具鉴定cDNA的开放阅读框;使用在线工具SMART(simple modular architecture research tool)对克隆得到的CpPainless和CpWater_witch进行蛋白结构预测,分析其序列N 端的锚蛋白重复序列及跨膜结构域。
1.4.2 TRP基因系统发育分析
检索GenBank等数据库中已报道同源TRP基因序列,并采用MEGA 5软件,选用邻接法重复1 000次,构建系统进化树。进化树构建所用序列的序列号见表2。
1.5 苹果蠹蛾TRP基因表达分析
研究表明,5龄为最耐热的幼虫阶段[5],因此本研究选取5龄幼虫作为试验材料,分别对5龄幼虫的雌、雄虫进行0、10、35、40℃胁迫1 h,以常温(26℃)饲养品系作为对照。将试虫迅速置于液氮致死,提取其总RNA,反转录1 μg总RNA获得cDNA,稀释10倍备用。根据测序正确的CpPainless和CpWater_witch序列,分別设计特异性扩增引物,选用tub[1]作为内参基因,引物序列见表3。
qRTPCR 反应采用ABI 7500 realtime PCR system(Applied Biosystems, USA)进行。反应体系20 μL,包括1.0 μL 的cDNA 模板,10.0 μL 的Hieff qPCR SYBR Green Master Mix(Low Rox),1.0 μL 上游引物(10 μmol/L),1.0 μL 下游引物(10 μmol/L),DEPC水补足至20 μL。反应程序为:95℃ 5 min;
95℃ 10 s,60℃ 30 s,40个循环。所有样品均为3个重复。PCR反应结束后,根据Ct值采用2-ΔΔCt法进行统计分析[19]。realtime PCR结果通过相对定量Ct阈值方法进行相对定量分析[20],不同温度处理下CpPainless和CpWater_witch相对表达量的差异显著性应用SAS 9.4统计软件的单因素方差分析(Oneway ANOVA)法进行分析。显著性测定采用Tukeys HSD法,显著性检验水平为P<0.05。
2 结果与分析
2.1 苹果蠹蛾CpPainless基因序列及结构分析
利用从苹果蠹蛾转录组预测的CpPainless序列设计一对引物(CpPainless F和CpPaninless R),通过PCR扩增得到约为3 100 bp的特异性条带,对扩增条带回收测序后,将测序结果与预测序列进行比对,确认所得片段为苹果蠹蛾CpPainless基因的cDNA序列。使用DNAMAN软件对序列进行分析,结果显示,序列的开放阅读框长2 817 bp,编码938个氨基酸(图1),预测分子量大小为106.5 kDa,且存在8处AATAA(A)加尾信号。
将苹果蠹蛾CpPainless基因蛋白质序列提交至NCBI的SMART数据库,结构预测结果显示,推导的氨基酸序列具有8个锚蛋白重复序列(图2),在线工具TMpred预测苹果蠹蛾CpPainless基因具有6个跨膜的结构域,具备TRP家族基因的典型特征。
2.2 苹果蠹蛾CpWater_witch基因序列及结构分析
利用从苹果蠹蛾转录组预测的CpWater_witch序列设计一对引物(CpWater_witch F和CpWater_witch R),通过PCR扩增得到约为3 000 bp的特异性条带,对扩增条带回收测序后,将测序结果与预测序列进行比对,确认所得片段为苹果蠹蛾CpWater_witch基因的cDNA序列。使用DNAMAN软件对序列进行分析,结果显示,序列的开放阅读框长2 943 bp,编码980个氨基酸(图3),预测分子量大小为109.8 kDa,且存在3处AATAA(A)加尾信号。
将苹果蠹蛾CpWater_witch基因蛋白质序列提交至NCBI的SMART数据库,结构预测结果显示,推导的氨基酸序列具有10个锚蛋白重复序列(图4),在线工具TMpred预测苹果蠹蛾CpWater_witch基因具有6个跨膜的结构域,具备TRP家族基因的典型特征。
为研究苹果蠹蛾Painless和Water_witch与其他昆虫TRP家族成员的进化关系,选取果蝇、冈比亚按蚊、意大利蜜蜂、家蚕、赤拟谷盗这5种已经完成基因组测序的昆虫的TRP序列构建进化树。通过昆虫TRP进化树分析,TRP超家族在昆虫中各家族成员之间分支清晰,进化关系保守。由进化树可见,苹果蠹蛾CpPainless基因与已知昆虫的painless聚为一支,CpWater_witch基因与已知昆虫的Water_witch聚为一支,且二者均归结到TRPA亚家族所在的簇。(图5)
2.3 苹果蠹蛾CpPainless和CpWater_witch基因表达分析
对CpPainless的定量结果分析后发现,经高低温胁迫1 h后,5龄雌虫体内的CpPainless表达量均显著下调,而5龄雄虫经高温胁迫1 h后体内的CpPainless表达量无显著变化,低温胁迫1 h后CpPainless表达量均显著上调(图6)。
对CpWater_witch的定量结果分析后发现,高低温胁迫1 h后,5龄幼虫体内CpWater_witch的表达量均无显著性变化(图7)。
3 结论与讨论
从苹果蠹蛾中克隆得到瞬时感受器离子通道CpPainless和CpWater_witch基因,并对其在昆虫TRP中的进化地位进行分析,结果表明CpPainless和CpWater_witch属于昆虫TRPA亚家族成员;通过表达分析发现,高低温胁迫1 h后,CpPainless在5龄幼虫雌虫体内的表达量显著下调,雄虫经低温胁迫1 h后,CpPainless表达显著上调,但高温胁迫1 h后表达差异不显著;而CpWater_witch在雌雄虫体内表达均没有显著变化。
TRP基因家族因参与调控生物体对外界多种刺激的感知而受到广泛关注[21],研究表明,其在昆虫感知温度刺激的过程中起到重要作用[22]。在对TRPA亚家族成员的基序比较中发现,N端大量串联的锚蛋白重复序列是TRPA亚家族的一项重要特征。有研究提出,N端锚蛋白重复序列有可能是感知并传递热刺激的重要组成部分[2324]。本研究得到的CpPainless聚类到TRPA亚家族Painless一簇,且N端具有8个锚蛋白重复序列,与果蝇的经典Painless结构较为相似;此外,作为果蝇中鉴定出来的第1个thermoTRP,DmelPainless被认为是热伤害受体,能够感知高温伤害性热刺激,且该离子通道在果蝇体内能被39~42℃的高温激活,这在昆虫感知疼痛从而逃避热伤害的行为过程中起重要作用。综上,推测painless很有可能在苹果蠹蛾体内参与热伤害感受。此外,从本研究CpWater_witch的表达分析结果,推测该基因未直接参与苹果蠹蛾温度感知过程。
本研究对苹果蠹蛾TRP在温度响应方面的探讨,有助于我们进一步研究其温度适应机制,从而为生态防控苹果蠹蛾提供新思路。后续也将利用RNAi、电生理等技术对其进行基因功能研究,以揭示瞬时感受器离子通道在苹果蠹蛾温度适应中的作用。
参考文献
[1] WAN Fanghao, YIN Chuanlin, TANG Rui, et al. A chromosomelevel genome assembly of Cydia pomonella provides insights into chemical ecology and insecticide resistance [J/OL]. Nature Communications, 2019, 10(1):4237.DOI:10.1038/s41467019121759.
[2] 申建茹, 李明福, 陳乃中, 等. 苹果蠹蛾热激蛋白Hsp90基因的克隆及热胁迫下的表达分析[J]. 昆虫学报, 2011, 54(11): 12361248.
[3] ISCI M, AY R. Determination of resistance and resistance mechanisms to thiacloprid in Cydia pomonella L. (Lepidoptera: Tortricidae) populations collected from apple orchards in Isparta Province, Turkey [J]. Crop Protection, 2017, 91: 8288.
[4] 吴永美,金彪,谷志容,等. 苹果蠹蛾的分布及防控[J]. 华中昆虫研究, 2018, 14:150157.
[5] 刘月英, 罗进仓, 周昭旭, 等. 不同温度下苹果蠹蛾实验种群生命表[J]. 植物保护学报, 2012, 39(3):205210.
[6] 梁亮, 余慧, 刘星月, 等. 苹果蠹蛾在中国的适生性分析[J].植物保护, 2010, 36(4): 101105.
[7] 赵琴娃, 陈臻, 蒲崇建, 等. 苹果蠹蛾在我国的传播及其防控对策[J]. 甘肃农业科技, 2015(11): 7376.
[8] COSENS D J, MANNING A. Abnormal electroretinogram from a Drosophila mutant [J]. Nature, 1969,224(5216): 285287.
[9] FOWLER M A, MONTELL C. Drosophila TRP channels and animal behavior [J]. Life Sciences, 2013, 92(89): 394.
[10]MONTELL C, RUBIN G M. Molecular characterization of the Drosophila trp locus: a putative integral membrane protein required for phototransduction [J]. Neuron, 1989,2(4): 13131323.
[11]SUN Ziling, ZHENG Yunhua, LIU Wei. Identification and characterization of a novel calmodulin binding site in Drosophila, TRP Cterminus [J]. Biochemical and Biophysical Research Communications, 2018,501(2):434439.
[12]HOFMANN L, WANG Hongmei, ZHENG Wang, et al. The S4S5 linkergearbox of TRP channel gating [J]. Cell Calcium, 2017, 67: 156165.
[13]NILIUS B, OWSIANIK G. The transient receptor potential family of ion channels [J]. Genome Biology, 2011, 12(3): 218.
[14]VRIENS J, NILIUS B, VOETS T. Peripheral thermosensation in mammals [J/OL]. Nature Reviews Neuroscience, 2014, 15(9): 573.DOI:10.1038/nrn3784.
[15]CASTILLO K, DIAZFRANULIC I, CANAN J, et al. Thermally activated TRP channels: molecular sensors for temperature detection [J/OL]. Physical Biology, 2018, 15(2): 021001.DOI:10.1088/14783975/aa9abf.
[16]魏金金, 曹德盼,杨婷,等. 豌豆蚜温度受体基因Painless的克隆及时间和组织表达[J]. 中国农业科学,2014,47(19): 37993809.
[17]TRACEY W D, WILSON R I, LAURENT G, et al. Painless, a Drosophila gene essential for nociception [J]. Cell, 2003, 113(2):261273.
[18]MATSUURA H, SOKABE T, KOHNO K, et al. Evolutionary conservation and changes in insect TRP channels [J/OL]. BMC Evolutionary Biology, 2009, 9(1):228.DOI:10.1186/147121489228.
[19]LIVAK K, SCHMITTGEN T. Analysis of relative gene expression data using realtime quantitative PCR and the 2-ΔΔ C T method [J]. Methods, 2001,25(4): 402408.
[20]GIULIETTI A, OVERBERGH L, VALCKX D, et al. An overview of realtime quantitative PCR: applications to quantify cytokine gene expression [J]. Methods, 2002,25(4): 386401.
[21]ALONSOCARBAJO L, KECSKES M, JACOBS G, et al. Muscling in on TRP channels in vascular smooth muscle cells and cardiomyocytes [J]. Cell Calcium, 2017, 66: 4861.
[22]ROSENZWEIG M, KANG K, GARRITY P A. Distinct TRP channels are required for warm and cool avoidance in Drosophila melanogaster [J]. Proceedings of the National Academy of Sciences, 2008, 105(38):1466814673.
[23]LISHKO P V, PROCKO E, JIN Xiangshu, et al. The ankyrin repeats of TRPV1 bind multiple ligands and modulate channel sensitivity [J]. Neuron, 2007, 54(6):905918.
[24]CORDEROMORALES J F, GRACHEVA E O, JULIUS D. Cytoplasmic ankyrin repeats of transient receptor potential A1(TRPA1) dictate sensitivity to thermal and chemical stimuli [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(46):1859518596.
(責任编辑:田 喆)

