基于粘度响应的线粒体靶向铱(Ⅲ)配合物用于肿瘤的光动力治疗
欧阳艾 罗雨珩 陆 农 胡仁涛 张平玉 张黔玲
(深圳大学化学与环境工程学院,深圳 518071)
0 引言
亚细胞器粘度是最重要的微环境参数之一,它通过影响活细胞内生物分子和化学信号的相互作用来促进生物学功能[1-4]。细胞的粘度与很多疾病息息相关,如动脉粥样硬化[5]、糖尿病[6]、阿尔兹海默病[7]、恶性肿瘤等[8]。此外,一些影响细胞内粘度的药物可以用来调节神经递质受体的净通量,从而降低神经活性,因此,细胞内粘度探针的研究和开发对于相关疾病的诊断具有重大意义。
线粒体是能量工厂,是传导细胞凋亡信号的关键调节剂[9]。细胞内粘度影响着细胞膜中蛋白质之间的相互作用[10],此外,线粒体基质中的粘度与线粒体网络组织、线粒体呼吸、代谢和代谢物扩散密切相关[3,11]。近来,一些具有分子内旋转动力学特性的荧光分子转子已被设计用于检测细胞内粘度。由于内部旋转特性,它们通常具有较低的量子产率,而随着粘度的增加旋转会受到限制,荧光随之增强[12]。粘度的定量测量可以使用具有粘度依赖性和非依赖性发光带的比值粘度监测器来实现[13]。此外,还可以通过引入靶向基团开发以针对特定细胞器的粘度检测的探针[2,14-16]。
近年来,光动力疗法(PDT,photodynamic therapy)作为一种微创且高效的癌症治疗方法引起了越来越多的关注。PDT由于高选择性、显著的靶向治疗效果以及较低的毒副作用,已成为化疗的替代方法[17-18]。PDT通过使用光敏剂(photosensitizers,PSs)、光辐射和基态氧发挥作用,在适当波长的光照射下,PS可以与基态氧相互作用产生高细胞毒性的单线态氧(1O2),从而导致癌细胞死亡[19]。与传统癌症治疗手段相比,PDT能最大限度地降低对机体的器质性损伤,治疗时间短,而且能够深入病灶对肿瘤进行治疗。
金属配合物由于具有优异的光物理和化学特性,在发光探针和光动力治疗中显示出巨大的潜力[20],例如作为氧气、离子、靶向细胞器和生物分子的探针及光敏剂等[21-30]。金属配合物的主要优点包括[31]:(ⅰ)具有高的光稳定性,可用于实时监测细胞内微环境的变化;(ⅱ)具有高的荧光量子产率、大斯托克斯位移和相对长的发光寿命而被广泛应用于靶向细胞器成像;(ⅲ)具有丰富的电荷转移激发态、结构可塑性等[32],可作为光敏剂有效地杀死癌细胞[33]。鉴于此,我们设计了2个对粘度具有灵敏荧光响应的铱配合物,可对线粒体内的粘度进行荧光成像检测,同时表现出高效光动力治疗效果。如图1所示,Ir1和Ir2在水溶液中可以自由旋转,导致荧光猝灭,而在粘度环境下,旋转受阻,从而荧光上升。粘度环境中的荧光配合物在光照的条件下,产生大量的单线态氧,可有效地用于肿瘤的光动力治疗。
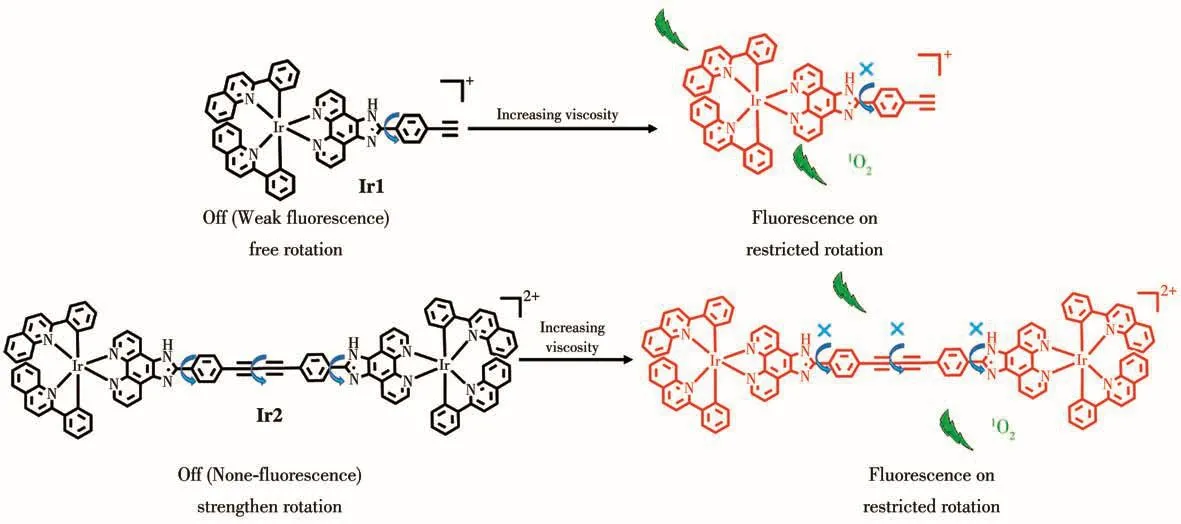
图1 Ir1和Ir2的粘度响应机理与光动力效应示意图Fig.1 Schematic diagram of viscosity response mechanism and photodynamic therapy of Ir1 and Ir2
1 实验部分
1.1 仪器和试剂
所用仪器有:BrukerAV-500MHz核磁共振仪、CHN/O/S元素分析仪(CE440)、UV-2550紫外可见分光光度计、F-7000荧光光谱仪、Bruker电子顺磁共振仪、Zeiss LSM880共聚焦扫描显微镜。
实验中所用试剂均为分析纯,反应中所有溶剂都按照溶剂手册进行蒸馏除水。
1.2 合 成
铱配合物Ir1与Ir2的合成路线如图2所示,主要有3步,先由三氯化铱水合物与二苯基喹啉配体合成铱配合物前体,再由前体和配体2-(4-(2-乙炔基)苯基)-1H-咪唑并[4,5-f][1,10]-菲咯啉(EPIP)合成Ir1,最后用单核铱配合物Ir1通过炔烃偶联反应合成双核铱配合物Ir2,其中配体EPIP根据文献报道进行合成[34]。我们选择EPIP配体的原因有2个,其一是EPIP配体具有可旋转的单键但在粘度条件下旋转受阻的特性,这是我们探索粘度探针的研究思路;其二是EPIP配体含有的炔基基团可以设计合成双核铱化合物Ir2,从而对比Ir1和Ir2的性质区别。化合物[Ir(2pq)2Cl2]的合成:称取 IrCl3(1 mmol)和 2-苯基喹啉配体(2.15 mmol),置于40 mL乙二醇乙醚和水(3∶1,V/V)的混合溶剂中,在氮气保护下于加热器中120℃回流24 h。冷却至室温后,减压过滤收集固体,并用乙醚洗涤3次,干燥后获得橙红色粉末。
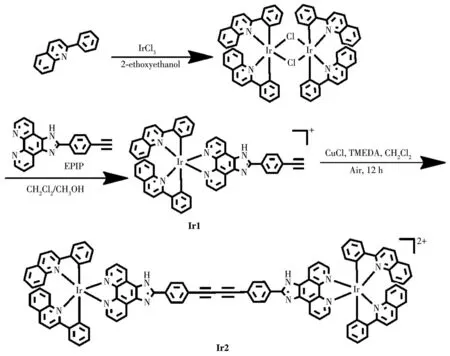
图2 Ir1和Ir2的合成路线图Fig.2 Synthetic routes of Ir1 and Ir2
化合物Ir1的合成:称取[Ir(2pq)2Cl2](0.1 mmol)和配体EPIP(0.21 mmol)置于100 mL的圆底烧瓶中,加入30 mL二氯甲烷和甲醇(2∶1,V/V)的混合溶剂,在氮气保护下于加热器中65℃下回流8 h。冷却至室温后,减压过滤收集固体,用水和乙醚洗涤3次并干燥后得到橘黄色粉末,即为Ir1,产率为88.5%。ESI-MS:m/z921.2[M-Cl]+。1H NMR(500 MHz,DMSO-d6):δ9.12(s,2H),8.62(d,J=8.9 Hz,2H),8.51(d,J=8.9 Hz,2H),8.34(dd,J=16.7,8.0 Hz,5H),8.04(s,3H),7.81(d,J=7.3 Hz,2H),7.63(d,J=7.5 Hz,2H),7.21(dt,J=15.9,8.1 Hz,6H),6.96~6.71(m,4H),6.52(d,J=7.3 Hz,2H),4.38(s,1H)。 元 素 分 析 按C51H32ClIrN6计算值(%):C 64.04,H 3.37,N 8.79;实验值(%):C 64.05,H 3.39,N 8.72。
化合物Ir2的合成[35]:将二氯甲烷(40 mL)、氯化亚铜粉末(110 mmol)和四甲基乙二胺(110 mmol)置于100 mL的圆底烧瓶中,向其鼓入纯净空气。随后称取Ir1(22.0 mmol)溶解于15 mL的二氯甲烷中,用分液漏斗滴入到上述溶液中,混合过夜搅拌。用水洗涤分液,有机相二氯甲烷用硫酸镁干燥后,旋蒸除去二氯甲烷得到粗品。最后通过柱色谱法提纯,以水、乙腈和硝酸钾混合溶液为流动相(10∶1∶0.1,V/V)进行洗脱纯化,得到橙色粉末为产物Ir2,产率63%。ESI-MS:m/z919.2[M-2Cl]2+/2。1H NMR(500 MHz,DMSO-d6):δ8.90(s,4H),8.60(d,J=9.0 Hz,4H),8.55~8.46(m,5H),8.35(d,J=8.4 Hz,4H),8.30(d,J=7.6 Hz,4H),8.19(s,4H),7.88(s,4H),7.80(d,J=7.1 Hz,4H),7.64(s,5H),7.21(dd,J=19.4,11.1 Hz,10H),6.94~6.77(m,8H),6.57(s,1H),6.52(d,J=7.4 Hz,3H)。元素分析按 C102H62Cl2Ir2N12计算值(%):C 64.11,H 3.27,N 8.80;实验值(%):C 64.06,H 3.33,N 8.84。
1.3 不同粘度中荧光强度和荧光寿命的测试
利用甘油与纯水来配制不同粘度的溶液体系,具体为用甘油与纯水依次配制体积比为0%~99%的混合溶剂,加入配合物母液后配制成浓度为10 μmol·L-1的不同粘度的样品溶液,依次测量配合物在不同粘度体系中的荧光发射光谱,同时在紫外线下拍摄其光学图片。最后分别取配合物在555 nm(Ir1)和557 nm(Ir2)处的发射强度与对应的粘度数值进行对数函数拟合。
1.4 1O2量子产率测定
利用对亚硝基二甲基苯胺(RNO)检测配合物产生的1O2量子产率,具体为:分别以甘油体积分数为0%和80%的甘油-纯水混合溶剂配制浓度均为10 mmol·L-1的RNO溶液和组氨酸溶液,以3 mL组氨酸溶液作为溶剂(空白),不断滴加配合物母液,使配合物溶液在465 nm处的吸收强度为0.1,以此浓度的配合物溶液作为参比溶液,在另一份相同的溶液中加入6 μL的RNO溶液作为样品溶液,测定其440 nm处的吸收强度为A0。随后使用功率为10 mW·cm-2的465 nm光源持续照射样品溶液5 min,测量其在440 nm处的吸收强度为A,记录每次光照后的440 nm处的吸收值(总共光照时长为30 min)。最后以光照时间为横轴,以A0-A为纵轴,拟合曲线,按照文献中的方法[4]计算配合物1O2量子产率(Φ),以光敏剂[Ru(bpy)3]2+作为对照(Φref,1O2=0.22)。
1.5 细胞培养
Hep-G2细胞(人肝癌细胞)、LO2细胞(人正常肝细胞)、A549细胞(人肺癌细胞)和MRC-5细胞(人正常肺细胞)购于ATCC细胞库。以DMEM作为细胞培养基,在培养基中加入体积分数为10%的胎牛血清、1%的双抗(青霉素和链霉素),细胞置于体积分数5% CO2的37℃恒温培养箱中培养。
1.6 细胞共聚焦荧光成像
取对数生长期的细胞,以每孔1×106个细胞接种于共聚焦培养皿中。细胞贴壁后,加入含有10 μmol·L-1的铱配合物的培养液,孵育1 h后吸去培养基,用PBS洗涤3次。用线粒体红色染料MitoTrackers®Red或溶酶体红色染料LysoTrackers®Red染色30 min,用PBS清洗3次后,置于激光共聚焦显微镜下进行拍照成像。
1.7 细胞光、暗毒性测试
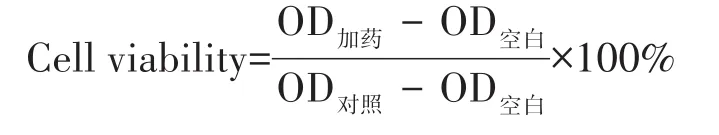
2 结果与讨论
2.1 光物理和化学性质
Ir1和Ir2在水溶液中(含0.2% DMSO)的紫外可见吸收光谱如图3所示。Ir1和Ir2在近紫外280~400 nm处强吸收峰归属为配体内部的电荷转移峰(ILCT);在400 nm左右,2个配合物均具有一个较弱的吸收带,这归属为配合物中金属中心铱原子到配体间的MLCT电子跃迁峰。用405 nm波长激发,Ir1和Ir2在水溶液中的荧光发射光谱如图3所示,Ir1在555 nm处有黄色的荧光发射,而Ir2在557 nm处几乎没有荧光发射,相比于单核铱配合物Ir1,双核铱配合物Ir2荧光被猝灭。
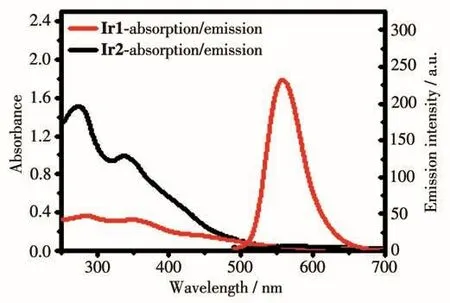
图3 Ir1和Ir2的紫外可见吸收光谱和荧光光谱图Fig.3 UV-Vis absorption spectra and emission spectra of Ir1 and Ir2
2.2 对粘度的荧光强度响应
Ir1和Ir2在不同粘度的甘油-水体系中的荧光发射情况如图4所示。在405 nm激发下,随着甘油体积分数的增大,体系粘度增大,Ir1和Ir2相应的荧光强度显著增强。将溶剂从纯水变成体积分数99%的甘油体系时,Ir1探针的荧光强度增强约35.7倍,Ir2探针的荧光强度增强约1 311.6倍,因此,Ir2对粘度响应更加明显和灵敏。Mao等报道了铱(Ⅲ)配合物粘度探针在高粘度环境下荧光增强了6.4倍[16],与其相比,Ir1和Ir2均具有非常灵敏的粘度响应。随后采用对数函数对探针的发射强度的对数值(lgI)和粘度的对数值(lgη)进行拟合,发现其相关系数都在0.99以上,表明Ir1和Ir2探针可对溶液体系的粘度进行定量测定。同时在紫外灯下可以明显观察到,随着粘度的不断增大,Ir1和Ir2的黄色荧光逐渐增强,即可通过肉眼观察荧光强弱来判定溶液体系的粘度大小,可作为一种可视化的荧光探针。
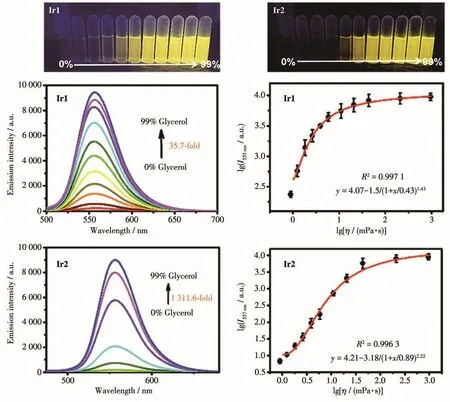
图4 Ir1和Ir2在不同粘度体系中的荧光图片、荧光光谱图以及荧光强度-粘度对数拟合曲线Fig.4 Optical images,emission spectra and fitting curves of logarithm of emission intensity-viscosity of Ir1 and Ir2 in the systems with different viscosities
2.3 对粘度的荧光寿命响应
Ir1和Ir2在不同甘油-水组分溶剂中的荧光寿命(τ)如图5所示,随着溶剂粘度的增加,探针的荧光寿命显著延长,Ir1的荧光寿命从1.02 μs增大到3.19 μs,Ir2的荧光寿命从 0.27 μs增大到 4.47 μs,其变化幅度比文献报道中的粘度探针更大[16]。
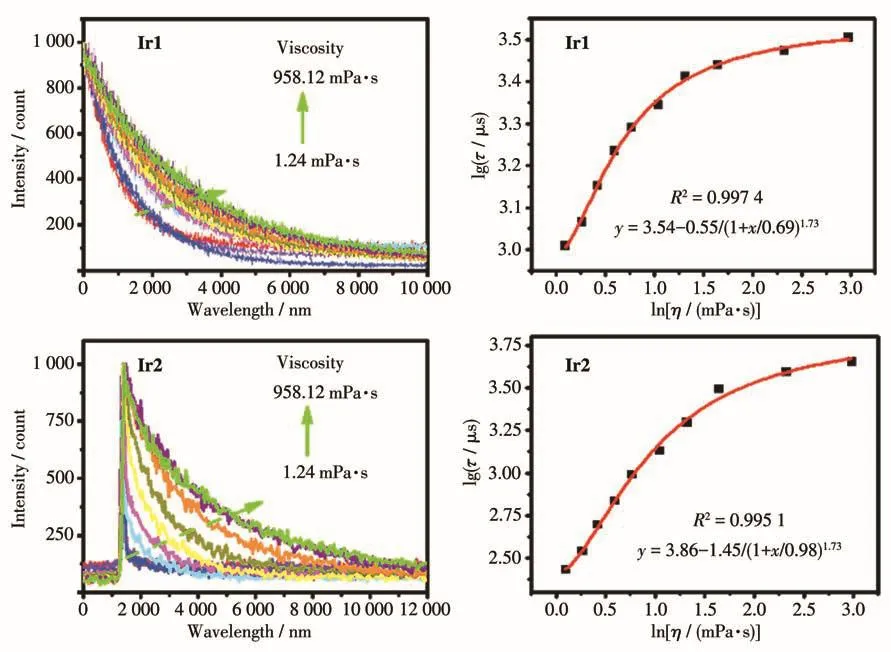
图5 Ir1和Ir2在不同粘度体系中的荧光寿命图谱以及寿命-粘度的对数拟合曲线Fig.5 Lifetime spectra and fitting curves of logarithm of lifetime-viscosity of Ir1 and Ir2 in the systems with different viscosities
2.4 不同条件的响应情况
使用465 nm的光源持续照射甘油体积分数为0%和80%的甘油-水体系的溶液30 min,结果如图6a所示,可见荧光强度几乎没有变化,表明探针在体外溶液中的光稳定性良好。同时,在不同pH值、不同粘度体系中,探针的荧光强度也基本没有变化,证明探针对粘度的检测具有pH稳定性(图6b)。但随着温度的增加(从20℃升高到45℃),配合物在不同粘度环境中的荧光强度呈下降的趋势(图6c),这是由于在高温条件下,体系粘度降低导致荧光强度也随温度的升高而降低,该结果与文献的报道相吻合[36]。
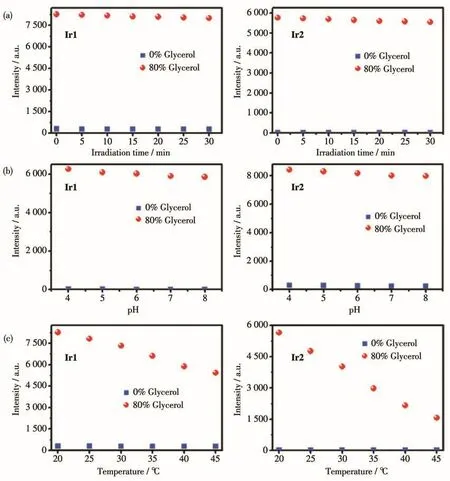
图6 不同粘度体系中Ir1和Ir2的荧光强度随光照时间、温度和pH的变化Fig.6 Fluorescence intensity changes of Ir1 and Ir2 as function of irradiation time,temperature,pH in the systems with different viscosities
2.5 细胞共聚焦显微成像
使用共聚焦激光扫描显微镜研究Ir1和Ir2在Hep-G2细胞中的定位情况。如图7所示,共染实验表明,配合物Ir1和Ir2能够快速进入活的Hep-G2细胞中并能清晰地显示出较强荧光,同时,Ir1和Ir2在Hep-G2细胞中都与线粒体染料MitoTrackers®Red表现出高度重叠,共染系数分别达到了87.5%与79.6%。然而,Ir1和Ir2与溶酶体染料LysoTrackers®Red仅有少量重叠,由此得出结论:Ir1和Ir2可以特异性地定位于Hep-G2细胞线粒体中。
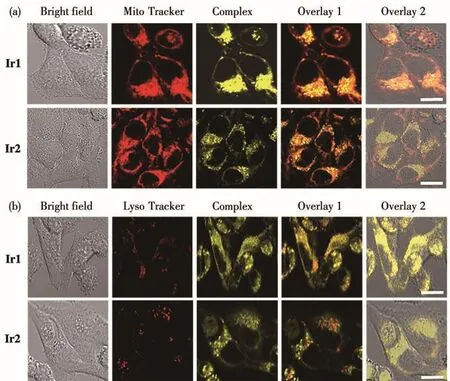
图7 Ir1或Ir2与细胞器染料(a)MitoTrackers® Red和(b)LysoTrackers® Red共孵育Hep-G2细胞的激光共聚焦图像Fig.7 Cellular colocalization microscopy images of Hep-G2 cells incubated with Ir1 or Ir2 and(a)MitoTrackers® Red and(b)LysoTrackers® Red
2.6 细胞摄取
进一步采用电感耦合等离子体质谱仪(ICP-MS)定量研究Hep-G2细胞对Ir1和Ir2的摄取和配合物在细胞内的分布情况。分别用10 μmol·L-1的配合物Ir1和Ir2孵育细胞1 h后,从细胞中提取出线粒体,经ICP-MS测试,结果如图8所示,Ir1和Ir2在线粒体中的相对含量均非常高,分别为71.4%和78.5%,表明大部分配合物主要聚集在线粒体中,这与上述细胞共定位实验结果相符合。
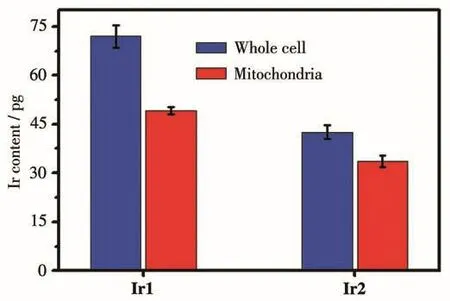
图8 ICP-MS定量测定的Ir1和Ir2在每个Hep-G2细胞中的含量Fig.8 ICP-MS quantitative determination of content of Ir1 and Ir2 in each Hep-G2 cell
2.7 对细胞的光、暗毒性测试
采用MTT法检测Ir1和Ir2对各种细胞的光、暗毒性。如表1所示,在黑暗条件下,Ir1和Ir2孵育的Hep-G2细胞的 IC50均很高(IC50>100 μmol·L-1),这表明在黑暗条件下,探针Ir1和Ir2对于Hep-G2细胞的生物毒性很小,能够用于活细胞的粘度进行成像。然而,在465 nm光源持续照射30 min后,Ir1和Ir2对Hep-G2细胞和A549细胞的IC50值分别达到0.75 和 1.24 μmol·L-1。我们采用光疗指数 PI值(IC50,dark/IC50,light)来衡量药物对细胞的光毒性,可以发现,Ir1对Hep-G2细胞和A549细胞的PI值分别达到了205和148,这和已报道的光敏剂相比具有相当的光治疗效果[4]。同时,Ir1和Ir2对相应的正常细胞的光毒性都较小,这可能是癌细胞中的细胞内粘度比正常细胞中的粘度高[37],导致Ir1和Ir2在癌细胞中的荧光更强。我们的实验结果也证明了配合物Ir1和Ir2在肝肿瘤细胞Hep-G2中的荧光更强,而在肝正常细胞LO2中的荧光更弱(图9)。更强的荧光的光敏剂可能会导致产生单线态氧更多,因此对癌细胞的光毒性更强而对正常细胞的光毒性较弱。
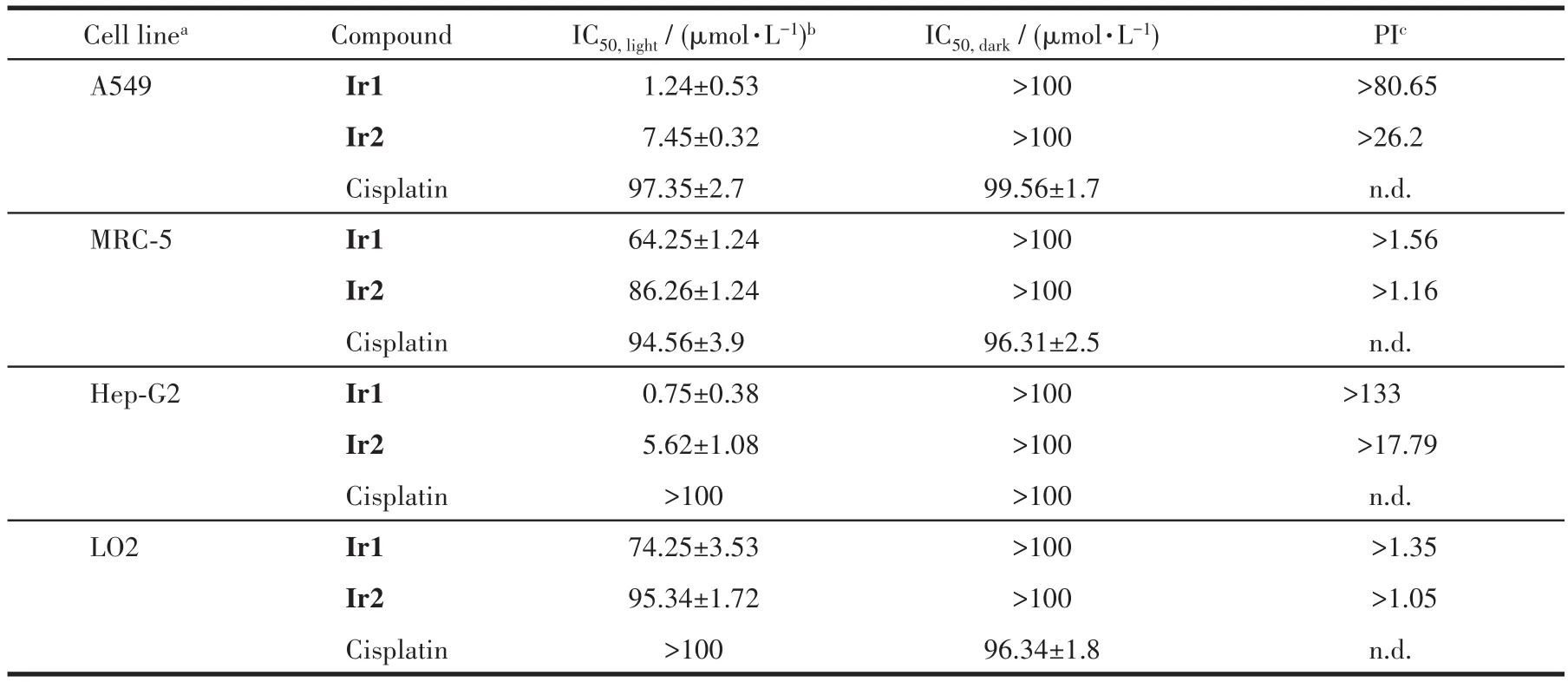
表1 Ir1和Ir2对不同细胞的光/暗毒性Table 1 Photo/dark toxicity of Ir1 and Ir2 towards different cells

图9 Ir1或Ir2在肝肿瘤细胞Hep-G2和肝正常细胞LO2中的共聚焦图像(a、b)以及它们荧光强度的相对值(c)Fig.9 Cellular microscopy images(a,b)and luminescent intensities(c)of Hep-GG2 and LO2 cells incubated with Ir1 or Ir2
2.8 EPR检测1O2
对于光敏剂尤其是金属配合物类光敏剂而言,1O2是其杀死肿瘤细胞的关键性物质。我们首先通过电子顺磁共振仪检测配合物Ir1和Ir2在光照下产生1O2的情况,采用2,2,6,6-四甲基哌啶(TEMP)作为1O2的捕获剂,每隔5 min光照一次(465 nm,50 mW·cm-2)。如图10所示,在没有光照时(0 min)并没有检测到1O2的特征峰信号,而在开启光照后,在3 480~3 530 G范围内出现了相对强度为1∶1∶1的1O2的特征峰信号,并且信号强度随光照时间的增加而增强,表明铱配合物Ir1和Ir2在光照下与氧气作用最终产生了1O2。
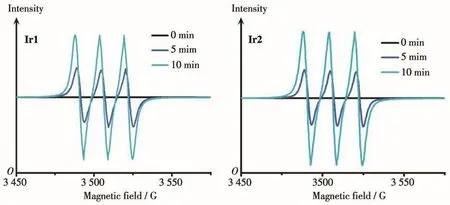
图10 Ir1和Ir2在光照下产生1O2的EPR谱图Fig.10 EPR spectra of1O2produced by Ir1 and Ir2 upon light irradiation
在此基础上,为了进一步研究Ir1和Ir2的1O2产生效率,我们利用RNO检测法测定了Ir1和Ir2的1O2量子产率,RNO检测法的基本原理如下:1O2与体系中的组氨酸(His)反应产生中间产物HisO2,此中间产物会与RNO反应,消耗体系中的RNO,而RNO含量的减少可通过紫外可见分光光度计进行定量检测,记录其在440 nm处特征吸收峰强度的衰减程度能够间接测得1O2的含量,从而得出1O2量子产率。如图11所示,随着光照时间的增加,RNO特征峰强度的衰减量不断增大,表明越来越多的1O2产生,我们通过衰减斜率来衡量配合物产生1O2的效率,并与[Ru(bpy)3]2+(Φref,1O2=0.22)进行对照[38],发现1O2的产生效率大小顺序为Ir1>[Ru(bpy)3]2+>Ir2,并且体系粘度越大,其1O2产生效率越大。如表2所示,经过进一步计算可以得出Ir1和Ir2的1O2量子产率分别为0.32和0.16。该实验结果也间接证明了Ir1和Ir2在高粘度的癌细胞中能产生更多1O2,从而光毒性更大。
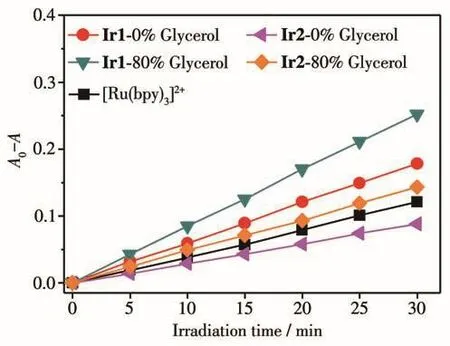
图11 Ir1和Ir2在光照下产生1O2的量子产率Fig.11 Quantum yield of producing1O2by Ir1 and Ir2 upon light irradiation
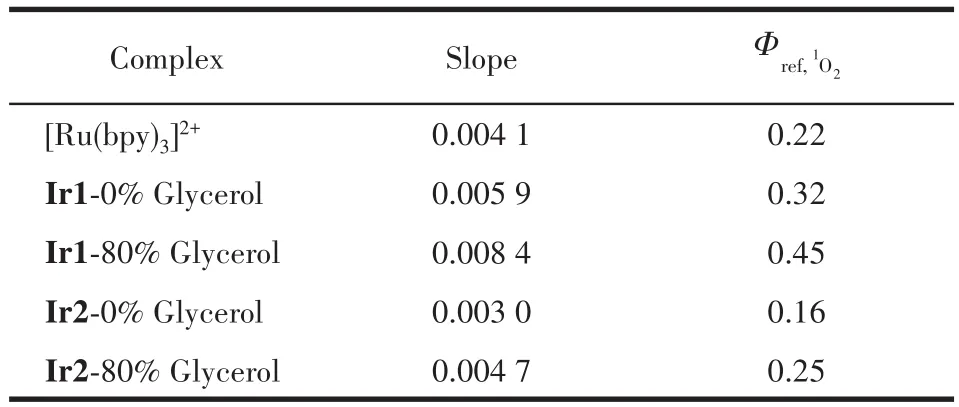
表2 Ir1和Ir2的1O2量子产率Table 2 1O2quantum efficiency of Ir1 and Ir2
2.9 细胞中1O2的检测
Ir1和Ir2在溶液中能够产生1O2使其有望成为光敏剂,因此,我们进一步采用商用1O2探针SOSG(single oxygen sensor green)检测细胞中1O2产生情况。相比于其他活性氧探针,SOSG不会与其他活性氧如羟基自由基、超氧阴离子和一氧化氮等发生化学反应,且可以特异性地与1O2进行结合,是1O2的专一性检测探针。SOSG未与1O2反应前,呈现出微弱的绿色荧光,而与1O2反应后,其产物呈现强绿色荧光。如图12所示,可以清晰地观察到,黑暗时没有观察到SOSG的绿色荧光,表明此时没有1O2产生,而光照一定时间后细胞中呈现出了明显的绿色荧光,表明细胞中的Ir1和Ir2在光照下产生了大量的1O2。同时,对于预先加入了NaN3(1O2清除剂)的对照组,其绿色荧光大部分被猝灭,进一步表明Ir1和Ir2在细胞中产生了1O2。经过ZEN软件分析,可以计算出荧光图中的平均荧光强度,配合物孵育下的光照组细胞中SOSG的强度明显高于黑暗组的,这进一步表明在光照条件下,配合物在细胞中高效地产生了1O2。
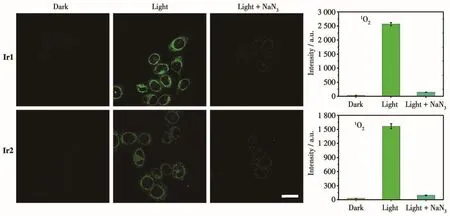
图12 在黑暗下和蓝光照射5 min后,Ir1或Ir2(5 μmol·L-1,1 h)与1O2探针SOSG(5 μmol·L-1,30 min)共孵育Hep-G2细胞及加入NaN3(5 mmol·L-1,1 h)前后的激光共聚焦图像Fig.12 Confocal microscopy imaging of Hep-G2 cells colabeled with Ir1 or Ir2(5 μmol·L-1,1 h)and1O2probe SOSG(5 μmol·L-1,30 min)in the absence or presence of NaN3(5 mmol·L-1,1 h)in the dark and under blue light irradiation for 5 min
3 结 论
设计、合成了2种新颖的铱配合物Ir1和Ir2,并系统研究了Ir1和Ir2分子的荧光强度和荧光寿命与体系粘度之间的关系。结果表明,探针的荧光强度和荧光寿命均随着体系粘度的增大而显著增大,这是由于Ir1和Ir2结构中的单键在水溶液中可以自由旋转,导致荧光猝灭;而在粘度较大时,旋转受阻,从而使荧光上升和荧光寿命延长,而具有强荧光特性的光敏剂是光动力治疗的前提条件。有趣的是,配合物还可以高效地靶向聚集于细胞中的线粒体,作为优异的粘度探针对线粒体内粘度进行成像检测。重要的是,在光照条件下,2种配合物能很好地引发癌细胞发生凋亡,其IC50值均处于极低的水平,2种分子均具有非常好的光动力治疗效果。因此,Ir1和Ir2有望开发成为联合检测细胞器内粘度和高效光动力治疗的金属药物。
致谢:感谢深圳大学测试中心提供的仪器平台。