维生素B12协同纳米Fe/Cu双金属对2,4-二氯苯酚的催化还原
毕 越,邱春生,张婷婷,潘 煜,孙力平
(天津城建大学环境与市政工程学院,天津300384)
2,4-二氯苯酚(2,4-DCP)是有机合成中重要的中间产物,被广泛用于木材防腐剂、杀菌剂及除草剂的生产[1-2],具有致畸、致癌、致突变的生物毒性.当其因不合理排放和意外泄露进入地下水中,会对人类及生物构成持久性威胁[3-4].同时因其具有苯环结构稳定不易被降解[5-6],目前已被我国列入到水环境优先控制污染物名单,同时也是美国环境保护局优先控制的126种污染物之一[7].
零价铁(ZVI)技术作为一种经典的还原脱氯技术,已经被报道能够去除四氯化碳[8]、氯仿[9]、四氯乙烯[10]、三氯乙烯[11]等多种含氯有机物[12],并且因其绿色经济无毒性的优良特性得到了广泛应用[13-14].然而由于低氯有机物和芳香族含氯有机物C—Cl键的键能高[15],芳香族含氯有机物含有苯环与氯原子具有共轭的电子效应,使得芳香族含氯有机物中C—Cl键电子云比较不易被还原,所以ZVI对这两类含氯有机物的还原能力都不足,研究表明,在ZVI的基础上添加另一种电极电势更高的金属(如Pd、Ni、Cu、Ag),与ZVI构成双金属体系能够提高脱氯速率[16-17].铜是一种价格相对低廉的过渡金属,其电极电势高于铁,并且有研究发现,纳米零价铜颗粒可降低打开C—Cl键所需要的活化能,在脱氯加氢反应中存在很大的潜力.另外有研究指出,可以通过添加电子介体来增强还原脱氯效果,如维生素B12、血色素、醌类都能作为电子介体提高脱氯速率[18].维生素B12是一种水溶性的金属辅酶,其中心金属钴具有很强的变价能力,3种价态的维生素B12能够在变价过程中完成释放和再生[19-20],提供了电子传递的新路径,并且维生素B12的特殊空间构型能降低反应过程中的能垒,从而能够加快还原脱氯速率.有研究证明,在还原体系中维生素B12的添加能够大大提高含氯有机物的还原速率[21].
该实验制备了纳米Fe/Cu双金属颗粒,并添加维生素B12,构成Fe/Cu-B12催化还原体系,研究其对以2,4-二氯苯酚为代表的低氯芳香族有机物的还原性能,并且同时考察了影响因素及其催化还原机理,以期为地下水中低氯代芳香族有机物的降解提供参考.
1 材料与方法
1.1 试剂与仪器
主要试剂:NaBH4、FeSO4·7H2O、CuSO(4分析纯,天津光复精细化工研究所);2,4-二氯苯酚(GC,≥99.99%,上海阿拉丁生化科技股份有限公司);苯酚(色谱纯,天津光复精细化工研究所);2-氯苯酚(GC,≥99.8%,上海阿拉丁生化科技股份有限公司);4-氯苯酚(GC,≥99.5%,上海阿拉丁生化科技股份有限公司);维生素B12(≥98%,SIGMA-ALDRICH,中国);甲醇(色谱纯,天津光复精细化工研究所).
主要仪器:高效液相色谱仪(Agilent 1100 Series,美国安捷伦公司);水浴恒温振荡器(WE-2型,天津市欧诺仪器仪表有限公司);紫外-可见分光光度仪(UV-2250,日本岛津);阴离子色谱仪(ICS-1500型,美国戴安公司);AAnalyst 800型原子吸收光谱仪(美国Perkin-Elmer公司);雷磁实验室pH计(PHS-3C,上海精密科学仪器有限公司).
1.2 纳米Fe/Cu双金属的制备
无氧水的制备:将超纯水分别装入多个500 mL的试剂瓶,每个试剂瓶通氮气10 min,盖上瓶盖密封,以备制材料时使用.
纳米零价铁(NZVI)的制备:将三口烧瓶提前通N25 min,随后将一定质量的FeSO4·7H2O用无氧水溶解后,缓缓倒入三口烧瓶中,迅速将三口烧瓶用橡胶塞密封,并且打开电机以一定转速进行搅拌.将一定质量的NaBH4用无氧水溶解后,转移至安装在三口烧瓶上的恒压漏斗中,然后控制NaBH4以2滴/s的速度加入到FeSO4·7H2O中与之反应,反应方程式如下

反应在持续通N2的环境中进行,反应结束后用去离子水将制备好的NZVI洗涤3次,以去除多余离子,置于无氧水中密封保存.
Fe/Cu双金属颗粒的制备:同NZVI的制备方式相同,将制备好的NZVI悬浮液加入三口烧瓶中,将一定质量的CuSO4溶液溶解后转移至恒压漏斗中,然后控制CuSO4溶液以2滴/s的速度加入到NZVI悬浮液中与之反应,反应方程式如下

反应结束后,将新制的Fe/Cu双金属用去离子水充分洗涤3次,以去除多余离子,最终将得到的悬浮液置于无氧水中密封保存.
1.3 Fe/Cu-B12体系催化还原实验
实验方法:向10个50 mL的血清瓶中,各加入5 mL初始质量浓度为120 mg/L的二氯苯酚溶液、一定体积的初始质量浓度为600 mg/L维生素B12溶液(2,4-二氯苯酚和维生素B12的最终反应质量浓度分别为20 mg/L和40 mg/L),将每个小瓶通N25 min后,随即加入一定质量新制备的纳米Fe/Cu悬浊液,然后迅速用瓶盖密封,置于恒温振荡器中振荡,转速为130 r/min,温度为30℃,依次在0,0.25,0.5,1,2,4,6,8,10 h处用注射器取样,并经0.22μm有机系微孔滤膜过滤后进仪器分析.
分析方法:通过对反应时间为t时的Cl-浓度的测定,计算出2,4-二氯苯酚的脱氯率,从而反应Fe/Cu-B12体系对该污染物的还原效能.
1.4 检测方法
水样中的底物2,4-二氯苯酚及其产物由高效液相色谱仪测定.色谱柱为Agilent SB-C18柱(4.6 mm×250 mm,5μm);流动相为甲醇/水(70∶30);流量为1.0 mL/min;进样量为20μL;检测波长为280 nm.
Cl-浓度采用离子色谱仪分析.分离柱为AS18阴离子交换分离柱(4 mm×250 mm);发生器为EG40;KOH梯度洗脱;柱加热温度为30℃;进样量为3 mL;流速为1.0 mL/min;抑制器电流为57 mA.
污染物脱氯率定义如下

式中:η为污染物脱氯率,%;CCl-,0为2,4-二氯苯酚完全脱氯所得Cl-理论质量浓度,mg/L;CCl-,t为反应时间为t时的Cl-质量浓度,mg/L.
维生素B12的分析扫描采用UV2250紫外-可见分光光度仪,扫描速度为3 200 nm/min,分辨率为0.1 nm,测试波长为190~900 nm.
2 结果与讨论
2.1 Fe/Cu双金属颗粒的表征
2.1.1 扫描电子显微镜分析
图1为纳米Fe/Cu双金属颗粒的扫描电子显微镜图.所制备的双金属材料单个粒径均在1~100 nm之间,纳米双金属颗粒呈现球状,但因为纳米颗粒的表面能非常大以及ZVI具有磁性,部分颗粒之间发生聚集呈现链条状[22].

图1 纳米Fe/Cu双金属的扫描电子显微镜图
2.1.2 X射线衍射分析
纳米Fe/Cu双金属(铜负载率10%)的X射线衍射结果如图2所示,通过与PDF标准数据卡片比对,图2中2θ=45.1°和2θ=65.1°处的衍射峰分别为Fe0的110(44.673°)和200(65.021°)的特征峰;2θ=43.3°处的衍射峰为Cu0的111(43.297°)的特征峰,说明纳米铜成功负载在纳米铁表面上.图2中未出现零价铜和ZVI的氧化物的特征峰,说明材料在制备过程中无氧条件控制良好,纳米Fe/Cu双金属并未被氧化.

图2 纳米Fe/Cu双金属的X射线衍射图谱
2.1.3 比表面积分析
图3为纳米Fe/Cu双金属的氮气吸附脱附等温线与孔径分布图.由图3a的氮气吸附脱附等温线,可以看出相对压力较高的范围内(P/P0>0.5)出现了明显的滞后环,表明材料中存在大量孔隙结构[23].这种等温线与国际理论与应用化学联合会(IUPAC)分类的6种物理吸附等温线的IV型曲线很好地契合[24].由图3b材料的孔径分布情况可知,孔隙呈现不均匀分布,但孔径主要分布于2~6 nm的范围内.
5种不同Cu负载率的双金属的比表面积如表1所示.可以看出,比表面积与负载率呈正相关,由于双金属的还原脱氯反应是表面反应,脱氯反应发生在金属表面的活性位点上,而活性位点的数量随金属的表面积增大而增加,双金属的比表面积是ZVI比表面积的1.44~2.54倍,所以与ZVI相比,双金属表面的活性位点数量增多,为反应提供更多的反应场所,加速了脱氯反应的进行.
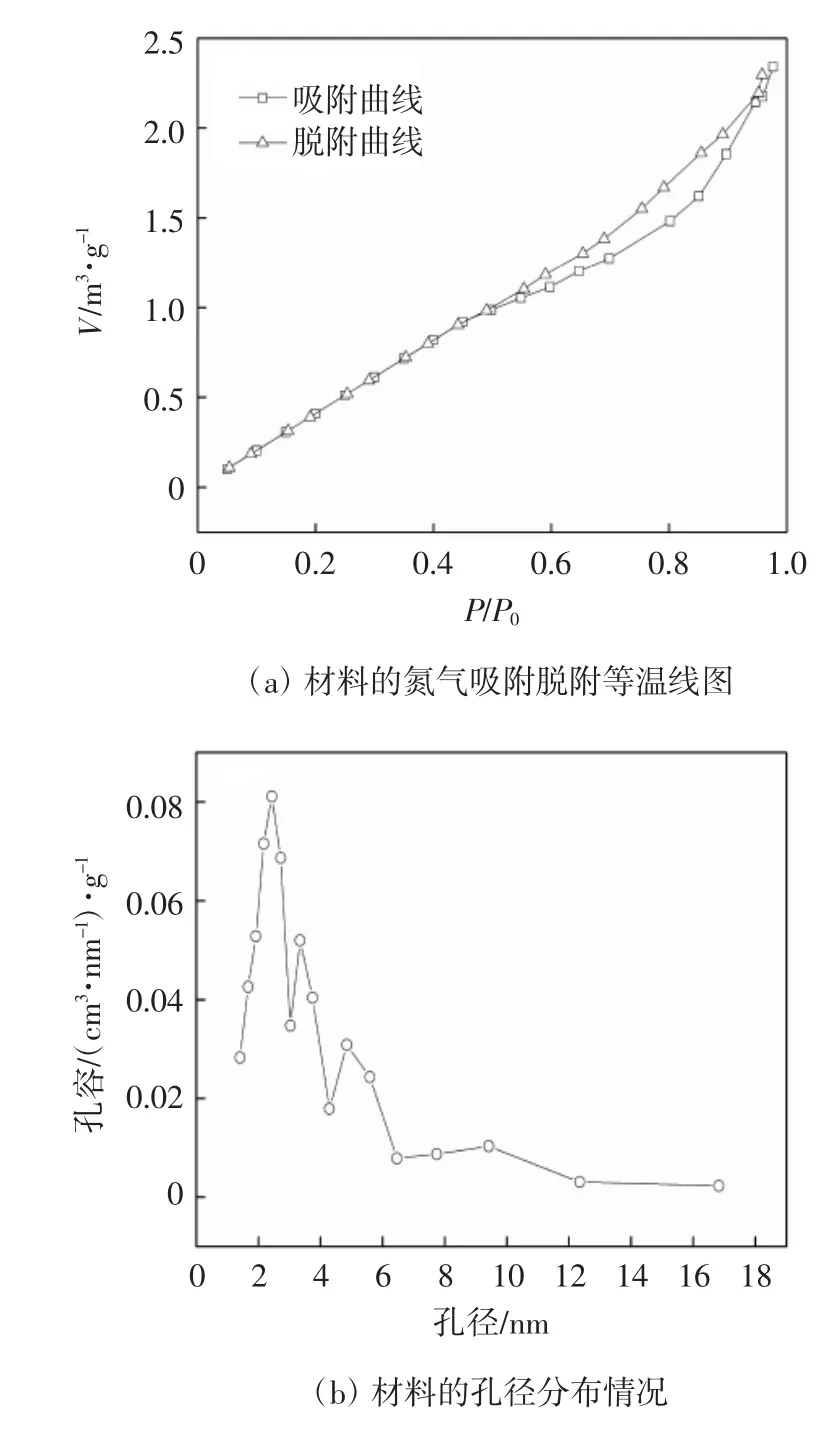
图3 纳米Fe/Cu双金属的氮气吸附脱附等温线与孔径分布图

表1 5种不同Cu负载率的双金属的比表面积
2.2 不同体系对2,4-二氯苯酚的还原效能对比
为了考察维生素B12和纳米零价铜对ZVI体系还原能力的强化作用,设计了Fe/Cu-B12、Fe/Cu、Fe-B12、Fe、B12共5种不同体系对2,4-二氯苯酚还原的对比实验(见图4),该实验的条件是:2,4-二氯苯酚的初始质量浓度为20 mg/L,Fe/Cu投加量为20 g/L,维生素B12的质量浓度为40 mg/L,pH为8.5.
由图4可以看出,Fe体系对2,4-二氯苯酚的还原效果比较差,反应10 h后去除率仅为21.63%,反应10 h后,Fe体系对2,4-二氯苯酚的反应速率常数Kobs为0.025 7 h-1,反应速率很低.而向Fe体系中分别加入维生素B12和纳米零价铜之后,Fe-B12体系和Fe/Cu体系的反应速率常数分别是0.056 h-1和0.084 5 h-1,相对于Fe体系反应速率有所提升.同时加入维生素B12和纳米零价铜之后,2,4-二氯苯酚基本被完全降解,反应速率常数为0.303 6 h-1,反应速率得到大幅度提升.

图4 不同体系对2,4-二氯苯酚的还原效能对比
从脱氯程度的角度分析,对离子色谱仪测定结果进行分析可知,Fe体系的反应产物的脱氯率仅为5.95%,反应产物只检测到了一氯苯酚.所以推测Fe体系对2,4-二氯苯酚的去除主要是物理吸附作用.在体系中分别加入纳米Cu和维生素B12后,脱氯程度有所加深,Fe/Cu体系和Fe-B12体系对应的脱氯率分别为27.91%和19.35%;在Fe体系中同时引入纳米Cu和维生素B12后,2,4-二氯苯酚在Fe/Cu-B12体系中的降解产物是苯酚和一氯苯酚,脱氯率也高达70.12%.
图5为2,4-二氯苯酚在Fe/Cu-B12体系中的还原产物高效液相图谱.在Fe体系中同时添加纳米Cu和维生素B12后,由图5可知:2,4-二氯苯酚在Fe/Cu-B12体系中的降解产物是苯酚和一氯苯酚,脱氯率也高达70.12%,体系的脱氯能力得到大幅度提升.

图5 2,4-二氯苯酚在Fe/Cu-B12体系中的还原产物高效液相图谱
不论是从反应速率方面还是脱氯程度方面分析,单独零价铜和单独维生素B12都能有效增强ZVI体系的还原能力,原因是零价铜能够降低碳氯键的键能并且铜与铁组成Fe/Cu原电池,ZVI在电势差的促进下更容易给出电子,体系的还原能力从而得到提升;而单独维生素B12体系的反应速率常数和脱氯率都为零,说明单独的维生素B12对2,4-二氯苯酚没有还原能力.它之所以能够增强ZVI还原能力的原因是维生素B12作为电子介体能够引发一系列链式反应,从而改变电子传递链,提高电子传输的速率.
另外发现,Fe/Cu-B12体系的反应速率常数大于Fe/Cu体系和Fe-B12体系的反应速率常数之和,同样脱氯率也是如此.说明不论从反应速率还是脱氯程度方面分析,纳米铜和维生素B12在Fe/Cu-B12体系中的作用并不仅仅是其单独作用的简单叠加,两者之间存在协同作用.
2.3 不同因素对Fe/Cu-B12体系还原性能的影响
2.3.1 铜负载率对Fe/Cu-B12体系还原性能的影响
图6为铜负载率对Fe/Cu-B12体系还原2,4-二氯苯酚的影响,由图6可知,当铜负载率小于10%时,随着铜负载率增加,体系对于2,4-二氯苯酚的还原速率是逐渐上升的;当铜负载率达到10%时,继续增大铜负载率,体系的反应速率反而下降.这是因为铜在Fe/Cu-B12体系中的作用,一是与ZVI构成Fe/Cu原电池[25],其电势差促进ZVI给出电子;二是纳米铜表面具有活性位点[26],能够催化维生素B12的一系列链式反应,降低反应的活化能,与维生素B12共同提供高效的催化作用.但是当铜负载率达到最佳负载率时,继续增大铜负载率会使得铜颗粒的分散性变差发生聚集[27],一方面减少了原电池数目,减弱了NZVI的给电子能力;另一方面纳米铜颗粒的聚集会造成铜颗粒活性位点减少,从而减弱其催化性能,降低了还原速率.

图6 铜负载率对Fe/Cu-B12体系还原2,4-二氯苯酚的影响
2.3.2 pH对Fe/Cu-B12体系还原性能的影响
图7为pH对不同体系还原2,4-二氯苯酚反应速率常数的影响,由图7可以看出,Fe/Cu体系的速率常数在4.5~10.5 pH范围内随pH的增加持续减小,原因是随着pH的增加,双金属颗粒表面的钝化层增厚[28],阻碍了2,4-二氯苯酚与双金属表面活性位点之间的有效接触和电子转移,还原脱氯速率从而降低.

图7 pH对不同体系还原2,4-二氯苯酚的影响
Fe-B12体系和Fe/Cu-B12体系的反应速率常数在4.5~10.5的pH范围内变化趋势是相似的,当pH<7时,反应速率常数随pH的增大而减小,原因是双金属颗粒表面的钝化层随着pH的增加而增厚阻碍传质,降低还原速率.当7<pH<9.5时,反应速率常数随pH的增大而迅速增大,Fe/Cu-B12体系在pH=9.5时的速率常数(1.367 8 h-1)是pH=7时的速率常数(0.112 5 h-1)的12.16倍,原因是在碱性条件下还原态的维生素B12r与溶液中OH-络合成的羟维生素B12r数量增多,羟维生素B12r具有更强的亲核性,可以更强烈地进攻与氯原子相连的碳原子,提高还原脱氯速率.然而当pH超过9.5后,反应速率迅速下降,原因是强碱条件下维生素B12结构被破坏.
2.3.3 维生素B12的质量浓度对Fe/Cu-B12体系还原性能的影响
图8为维生素B12质量浓度对Fe/Cu-B12体系还原2,4-二氯苯酚的影响.如图8所示,反应速率常数随着维生素B12质量浓度的增大而增大,维生素B12质量浓度为60 mg/L的反应速率常数(0.467 6 h-1)是不添加维生素B12反应速率常数(0.084 5 h-1)的5.53倍,平均每10 mg维生素B12能使得反应速率常数提高0.064 h-1.因为随着维生素B12浓度的增加,体系的供电子效率增强,所以还原脱氯速率随之升高.

图8 维生素B12质量浓度对Fe/Cu-B12体系还原2,4-二氯苯酚的影响
2.3.4 Fe/Cu双金属的投加量对体系还原性能的影响
图9为Fe/Cu双金属投加量对Fe/Cu-B12体系还原2,4-二氯苯酚的影响.如图9所示,随着Fe/Cu双金属投加量的增加,反应速率常数增加.随着Fe/Cu双金属投加量的增加,暴露在溶液中的金属表面积增加,而2,4-二氯苯酚在Fe/Cu-B12体系中的脱氯还原反应属于固液两相的表面反应[29],即反应发生的场所是金属表面,所以反应速率随之提高.

图9 Fe/Cu双金属投加量对Fe/Cu-B12体系还原2,4-二氯苯酚的影响
2.4 反应机理
目前,ZVI还原脱氯机理存在3种反应机理[30-31],其中直接电子传递机制被大多数学者所认可,即ZVI作为电子供体提供电子进攻与氯原子相连的碳原子,对含氯有机物进行亲核还原,反应结果是脱氯加氢,氯原子以氯离子的形式被释放到溶液中.总体上本研究中Fe/Cu-B12体系脱氯还原机理也属于此机制,只是由于添加纳米零价铜和维生素B12,电子传递的途径和传递的效率发生改变,从而增强了还原脱氯效果.
零价铜在Fe/Cu-B12还原体系中的作用一是与ZVI构成Fe/Cu原电池,促进ZVI给出电子;二是纳米铜表面的活性位点能够催化脱氯过程中的一系列链式反应,降低反应的活化能,与维生素B12协同提供催化作用.
维生素B12是一种过渡金属配位化合物,通过中心钴离子(Co3+)的变价能力以及其特殊的空间构型扮演着电子媒介的角色,从而完成对还原反应的催化.
图10是维生素B12在纯水溶液和Fe/Cu-B12体系中的紫外-可见光光谱图.如图10所示单独维生素B12体系的主要表现形态为B12(Co3+),在Fe/Cu-B12体系中B12(Co3+)浓度降低并且有大量B12r(Co2+)生成,推测是ZVI将B12(Co3+)还原成B12r(Co2+),呈还原态的B12r(Co2+)再继续将电子传递下去.

图10 单独的维生素B12体系和Fe/Cu-B12体系中维生素B12的紫外-可见光光谱图
结合以上分析,Fe/Cu-B12体系中2,4-二氯苯酚的还原脱氯机理是维生素B12(Co3+)接受来自ZVI的电子被还原为B12r(Co2+),B12r(Co2+)在弱碱性的反应溶液中与羟基结合形成更具亲核性的羟维生素B12r,有利于对C—Cl键进行亲核取代,形成RCln-1-B12(Co3+)过渡配合物,氯原子以离子的形式脱离含氯有机物进入溶液中,随之质子化,B12(Co3+)也完成再生.在此过程中过渡金属配合物维生素B12所进行的一系列链式反应是在零价铜表面的活性位点上进行的,降低了反应的活化能,与维生素B12协同提供更高效的催化作用.
3 结论
(1)Fe/Cu-B12体系是降解低氯代芳香族有机物的高效还原体系,维生素B12和纳米零价铜的同时添加使得反应速率常数由Fe体系的0.025 7 h-1提高到Fe/Cu-B12体系的0.303 6 h-1,脱氯率由5.95%提高到70.12%.
(2)铜负载率是Fe/Cu-B12体系的重要技术参数,存在最佳铜负载率,当铜负载率超过最佳铜负载率时,还原速率会随铜负载率的增加而下降,Fe/Cu-B12还原2,4-二氯苯酚的最佳铜负载率为10%.
(3)pH是影响Fe/Cu-B12体系还原能力的重要因素,体系在弱碱性的pH范围内还原能力最高,最佳pH为9.5,这与维生素B12能够与羟基形成更具亲核性的过渡配合物有关.
(4)Fe/Cu-B12体系具有高效还原能力的关键机理是零价铜和维生素B12存在协同作用.零价铜表面的活性位点能够催化维生素B12在电子传递过程中引发的链式反应,加快还原速率.

