聚乳酸-羟基乙酸共聚物载脑源性神经生长因子纳米粒的构建及生物学活性评价
李洋,余江南,徐希明
(江苏大学药学院,江苏 镇江 212013)
脊髓损伤是常见的中枢神经系统损伤疾病,对患者身心均造成严重创伤。其发病率高、继发反应复杂、治愈率低,一直是全世界范围内急需攻克的医学难题[1]。目前的治疗策略主要是抑制胶质瘢痕的产生、促进神经细胞再生以及重构创伤部位的微环境[2-3]。已有报道脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)对脊髓损伤有明显的修复作用[4-5]。BDNF通过作用于全长型酪氨酸受体激酶B发挥神经保护、炎性因子调节等作用[6-7]。然而BDNF在体内易失活从而难以发挥持续滋养受损部位的作用,因此构建BDNF缓释释药体系有利于药物应用。聚乳酸-羟基乙酸共聚物[poly(lactic acid-glycolic acid),PLGA]是组织工程领域中应用广泛的生物材料[8],具有良好的生物相容性[9],PLGA纳米粒可提高生长因子的稳定性以及实现药物的缓释[10]。
本研究采用复乳化溶剂挥发法制备BDNF-PLGA纳米粒,利用正交试验设计优化制备工艺,最后对制得样品进行表征及生物相容性评价。
1 材料和方法
1.1 主要试剂及仪器
PLGA(75∶25)相对分子质量为24 000~38 000(济南岱罡生物科技有限公司);聚乙烯醇,相对分子质量13 000~23 000(日本可乐丽公司);甘露醇、蔗糖(国药试剂);超高速离心机(美国 Beckman公司);冷冻干燥机(德国CHRIST公司);动态光散射及Zeta电位测定仪(德国Bruke公司);透射电镜(日本日立公司);BCA蛋白定量试剂盒及BDNF-ELISA试剂盒(南京福麦斯生物技术有限公司);BDNF(美国Peprotech公司);酶标仪(美国BioTek公司)。
1.2 BNDF-PLGA纳米粒的制备
配制二氯甲烷/丙酮=3∶1(体积比)混合溶液,称取PLGA粉末,溶解于上述溶液中,获得PLGA溶液。精密称取蛋白药物,加入1 mL灭菌水配制成水溶液,按蛋白溶液/PLGA溶液=1∶5(体积比),缓慢将蛋白水溶液滴加入PLGA的混合溶液中制得初乳,滴加过程中磁力搅拌使之分散均匀,然后100 W超声2 min,然后搅拌转移至聚乙烯醇溶液中,超声分散至溶液显乳白色。敞口磁力搅拌4 h挥干有机溶剂。离心清洗3次,将微球分散于20 mL超纯水中,冷冻干燥后备用。
1.3 正交试验优化BNDF-PLGA纳米粒的制备条件
以牛血清白蛋白(BSA)为模型药物,选取4个对PLGA纳米粒制备结果影响较大的因素:A为制得初乳与聚乙烯醇溶液的体积比;B为投药量与PLGA用量质量比;C为外水相聚乙烯醇溶液的质量浓度(g/L);D为超声时间(min)。以载药率(S1)、包封率(S2)作为指标,优化制备工艺。正交设计见表1。

表1 正交试验因素水平
1.4 BNDF-PLGA纳米粒的表征
1.4.1 平均粒径、粒径分布和Zeta电位的测定 将制备的纳米粒加入双蒸水中,分散均匀至无明显浑浊,置于动态光散射及 Zeta 电位测试仪测定粒径大小和Zeta电位。
1.4.2 纳米粒的形态考察 将稀释好的样品滴于铜网上,用质量浓度为30 g/L的磷钨酸溶液负染3 min,室温干燥后于透射电镜下观察PLGA纳米粒的内部结构。
1.5 PLGA纳米粒中药物包封率、载药率和回收率的测定
1.5.1 包封率测定 收集制备过程中离心的上清液,按“1.5.3”所述方法测量其中未包载的药物量,计算出纳米粒的包封率。系统中上清液中的药物含量记作W1,投入药物总量记作W0,则包封率=(W0-W1) / W0×100%。
1.5.2 载药量测定 称取5 mg的纳米粒,加入1.0 mL二氯甲烷溶解纳米粒释放药物,再用1.0 mL灭菌水萃取纳米粒中的蛋白质,加入0.5 g无水硫酸钠颗粒,离心萃取上清液3次,收集3次的萃取液。测定其中蛋白的含量。
1.5.3 样品含量的测定 采用BCA法检测BSA含量。配制系列浓度蛋白标准品溶液,96孔板中加入稀释好的待测样品和标准品溶液,加入测定工作液后混合均匀,避光37 ℃孵育30 min,于波长562 nm处检测光密度(D)值。以D值(Y)对标准品浓度(X)作线性回归,得标准曲线并计算样品对应浓度。配制浓度为 5、30、100 μg/mL的BSA溶液各3份,按照BCA法相同步骤操作,于562 nm测定D值,计算回收率。
BDNF含量采用ELISA试剂盒检测,在包被有BDNF抗体的酶标板中加入标准品和样品,设空白对照孔,于37 ℃孵育30 min,洗板后除空白孔外,均加入酶标试剂置于37 ℃孵育30 min,再次洗板拍干,加入显色液A瓶、B瓶,避光37 ℃孵育15 min,最终加入终止液,测定波长450 nm处D值。以D值对标准品浓度(C)作线性回归,得标准曲线并计算样品对应浓度。
1.6 PLGA纳米粒体外释放度的测定
精密称取制备的PLGA纳米粒2 mg,用PBS稀释后,置于透析袋中进行体外释放试验。恒温水浴振荡器设定为37 ℃,100 r/min,于4、6、12、24、48、72、168、240、288、360 h等时间点取样,并补回等量缓冲盐溶液。BSA-PLGA纳米粒和BDNF-PLGA纳米粒按照“1.5.3”中操作步骤测定含量,并作累积释放曲线图。
1.7 PLGA纳米粒细胞相容性测定
1.7.1 细胞培养 将大鼠外胚层间充质干细胞(ectomesenchymal stem cells,EMSCs)按 3×105个/瓶培养于含有5 mL细胞培养液、10%胎牛血清的D/F12培养液中,置于CO2培养箱(饱和湿度95%、5%CO2、37 ℃)孵育。根据细胞生长状况以及培养液pH 值变化,1~2 d换液1次,待细胞培养至对数生长期时进行传代。
1.7.2 细胞增殖实验 细胞于96孔板中贴壁培养后,更换为含有PLGA纳米粒的新鲜培养基,在规定的时间点,孔中细胞用PBS洗涤2次,在37 ℃下用含10% Alamar Blue的新鲜培养基避光孵育4 h。在波长590 nm处测量上清液的D值,以第1天的D值为基础计算相对增殖速度。
1.8 统计学方法
2 结果
2.1 正交试验设计结果
以制备纳米粒的包封率(S1)和载药量(S2)为指标,S=S1+S2。运用L9(34)正交表进行实验设计,结果如表2所示。由极差分析可知,各因素的影响大小为B>C>A>D,且由表3中方差分析的结果可知,影响因素A、B、C对制备结果有显著影响(P<0.05),而D因素影响不显著。最佳的制备条件为A3B3C1D3,即制备初乳和外水相的体积比为1∶15,投药量与PLGA用量质量比为6∶100,聚乙烯醇溶液的质量浓度为10 g/L,超声时间为5 min。
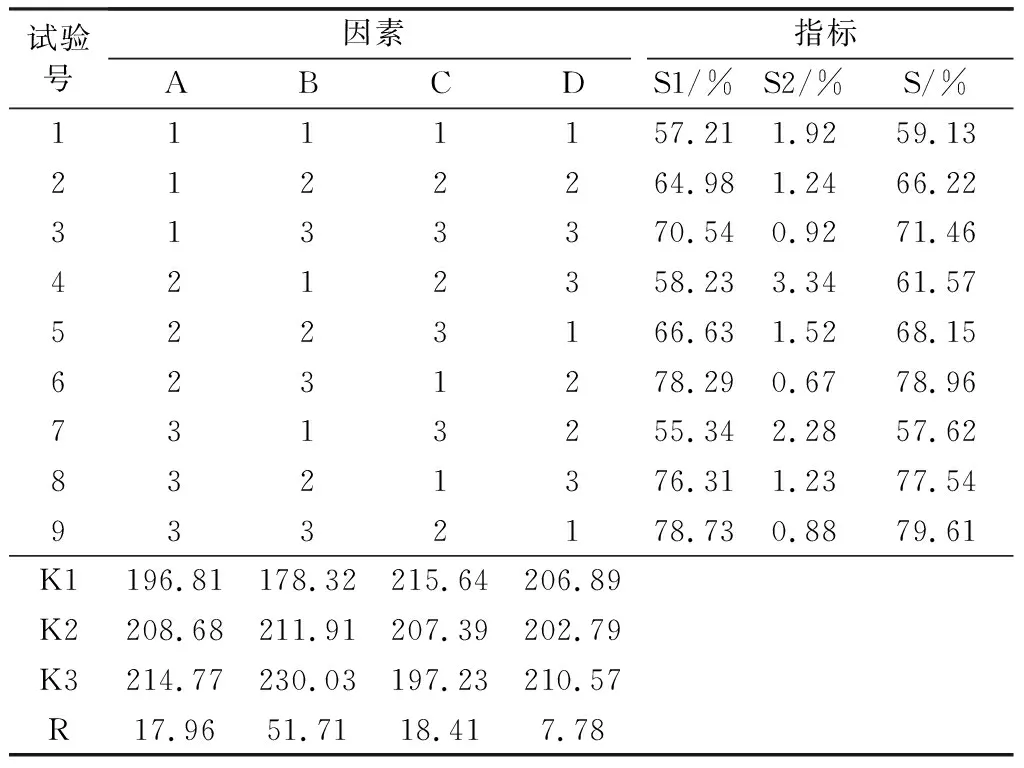
表2 正交试验设计和结果
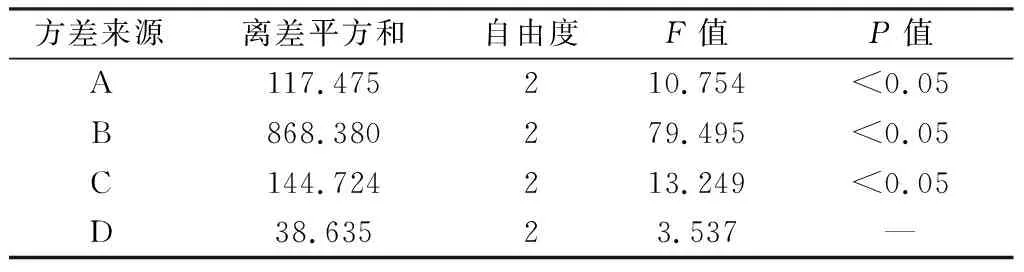
表3 方差分析
2.2 最佳工艺验证
按2.1项中优化的最佳处方工艺平行制备3批BSA-PLGA纳米粒,按照BSA试剂盒中蛋白含量的测定方法,得标准曲线为Y=0.000 2X+0.068(R2=0.992 1),计算出包封率为(78.65±3.18)%,载药量为(3.25±0.71)%,回收率为(98.48±0.20)%。
2.3 BDNF-PLGA纳米粒表征结果
透射电镜结果显示BDNF-PLGA纳米粒形状规整,呈均匀球形包载药物,如图1(A)所示;经动态光散射及Zeta电位仪测定,BDNF-PLGA纳米粒粒径为(205±0.18)nm,粒径分布图见图1(B),多分散系数为(0.132±0.02),电位为-23.51 mV。BDNF含量测定标准曲线为D=0.042 2C+0.090 5(R2=0.990 4),计算得出纳米粒的包封率为(79.65±2.14)%,载药量为(0.002 381±0.000 253)%。
2.4 载药纳米粒的体外释放曲线
BSA-PLGA纳米粒和BDNF-PLGA纳米粒的释放结果如图2所示。前4 h两种纳米粒的累积释放率分别为(18.23±2.31)%、(17.48±2.22)%,未出现突释效应;在6~72 h内,BSA-PLGA纳米粒和BDNF-PLGA纳米粒每小时药物释放率为0.60%和0.50%,表现为缓慢释放;72~360 h时纳米粒释放趋近平缓,最终两者累积释放率分别为(82.15±1.23)%和(88.32±1.23)%。
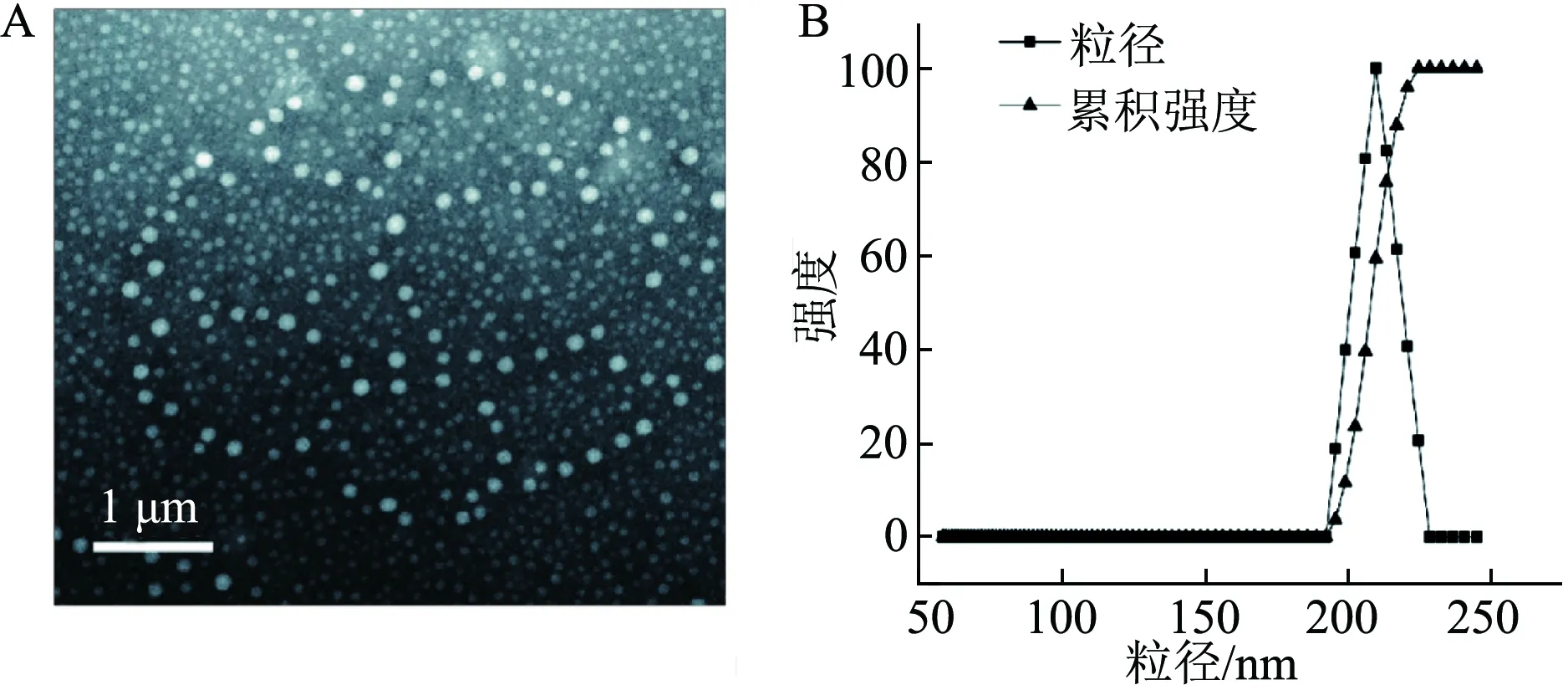
A:BDNF-PLGA透射电镜图;B:BDNF-PLGA纳米粒粒径分布
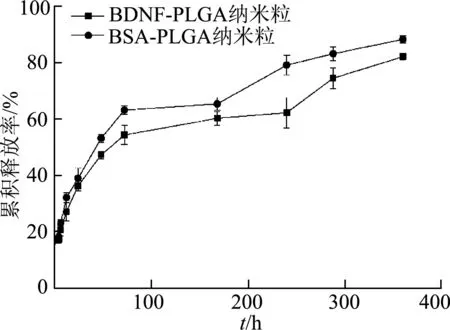
图2 载药纳米粒体外累积释放曲线
2.5 纳米粒的细胞增殖实验
如图3所示,前24 h内BDNF-PLGA纳米粒组、BDNF溶液组及空白对照组细胞增殖速率无显著性差异(P>0.05);随后BDNF-PLGA纳米粒和BDNF溶液均显示出促进细胞增殖的作用,与对照组相比有统计学意义(P<0.05),但纳米粒组与BDNF溶液组无显著差异。结果表明BDNF-PLGA纳米粒能促进EMSCs增殖。
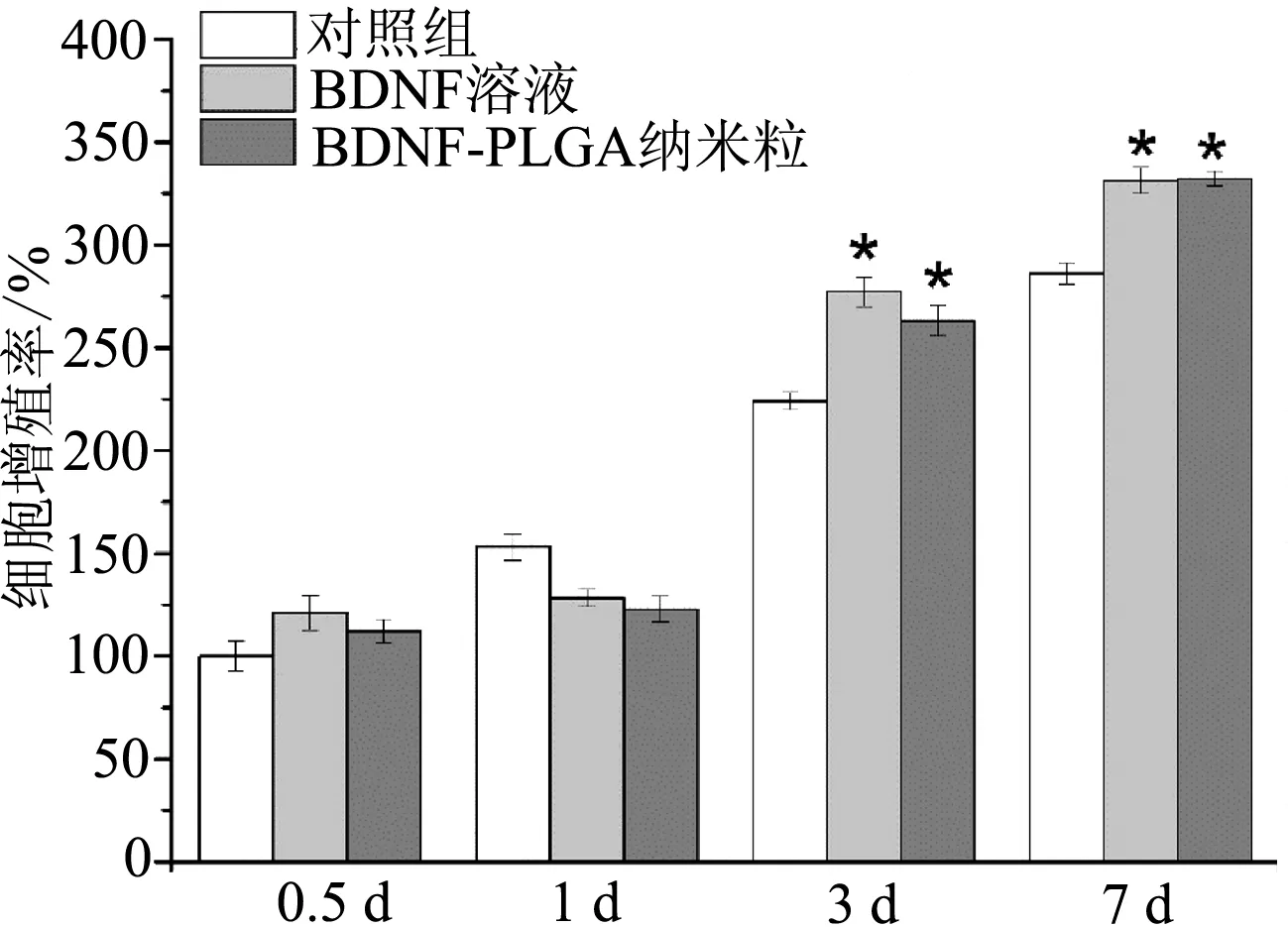
*:P<0.05,与对照组比较
3 讨论
BDNF具有促进干细胞向神经元分化、抑制炎症反应、促进神经元存活和改善轴突再生的作用[11-12]。已有不少报道其用于修复动物脊髓损伤模型[13-14]。然而蛋白类的药物易失活,稳定性差,不利于在损伤处长期而持续地发挥疗效[15]。PLGA是常见的生物可降解材料,其应用形式主要有薄膜、多孔支架、微球及纳米粒等。PLGA的降解产物二氧化碳、水和羟基乙酸无毒害作用,可排出体内,并且可通过对材料的改性和修饰[16],达到缓释[17]、控释药物[18]的目的,是构建新型药物递送系统的理想材料。
目前,制备PLGA纳米粒的常用方法有单/复乳溶剂挥发法、同轴静电喷雾法、纳米沉淀法等。其中复乳化溶剂挥发法操作简便,易于重复,可用于亲水性药物如蛋白质类药物的制备[19]。本实验采用复乳化法制备BDNF-PLGA纳米粒,可减少蛋白质类药物的失活。
本研究通过正交试验设计优化PLGA纳米粒的制备工艺,以药物包封率和载药量为评价指标,方差分析结果显示,初乳和外水相的体积比、投药量与PLGA用量质量比、聚乙烯醇溶液浓度是影响纳米粒制备的主要因素,超声时间对结果的影响不显著。根据正交试验结果显示,投药量与PLGA用量质量比对药物的包封率和载药量影响较大。一方面PLGA占比越大,可增加有机相的黏度从而抑制药物弥散;另一方面,增加PLGA用量加速微球的固化,可减少包载药物的流失[20]。外水相聚乙烯醇溶液的作用主要是固化制备的初乳,沉淀出粒径均一的纳米粒。聚乙烯醇浓度不足可能导致乳液破相而使载药量降低。此外,已有报道证明[21],调节初乳/外水相的比例对制备样品的载药量和包封率有显著影响,并可降低药物的突释现象。提高外水相的比例,可起到稀释溶剂的效果[22]。综合极差分析与方差分析所得最优制备条件为初乳和外水相的体积比为1∶15,投药量与PLGA用量质量比为6∶100,聚乙烯醇溶液质量浓度为10 g/L。
通过对优化条件进行验证,实验所制备的BDNF纳米粒形态粒径均一,有较高的包封率,满足后续实验要求。制得样品形态完整,在对纳米粒释放药物能力的研究中,前4 h未出现药物泄露而导致突释效应;中期随着外层载体PLGA的逐渐溶解,内层药物BDNF逐渐扩散至介质中,直至最后平稳达到释放平衡,累积释放率为(88.32±12.3)%。乳化法制备PLGA纳米粒包载蛋白药物的包封率有限,不少研究者在制备该剂型时包封率不高,如赵莺歌[23]制备胰岛素的PLGA缓释纳米粒,包封率仅为36.61%;不仅如此,制备其他非蛋白类的药物如熊果酸[24]、磷酸二酯酶-4(PDE-4)抑制剂阿普斯特(Apremilast)[25]等,所获得的包封率也仅为约54%、61.1%。本实验通过考察影响纳米粒包封率的几个因素,进行正交设计优化后,最终制得包封率为79.65%的纳米粒,与以往的研究相比有较大的提升。
细胞增殖实验结果表明BDNF纳米粒对细胞的生长增殖无抑制作用,可维持EMSCs细胞的正常生长,说明BDNF纳米粒具有良好的生物相容性。
综上所述,本实验通过复乳化溶剂挥发法制备BDNF-PLGA纳米粒,并利用正交试验设计优化制备工艺,最终制得的样品性质稳定。经体外研究显示,BDNF-PLGA纳米粒具有缓释效果和良好的生物相容性。然而本研究仅对BDNF-PLGA纳米粒的制备工艺和性质进行了探讨,后续将进一步探讨其在干细胞分化以及脊髓损伤修复中的应用价值。

