H9N2亚型流感病毒光动力失活的超微结构
谷长维,胡 博,2*
(1.中国农业科学院 特产研究所,吉林 长春 130112;2.农业农村部经济动物疫病重点实验室,吉林 长春 130112)
光动力失活(photodynamic inactivation,PDI)可用于杀灭病原微生物,包括细菌、病毒、真菌和原生动物[1-3],这些对于病毒相关病变的治疗[4]、水的消毒[5]、血液制品处理[6]具有实际的应用价值。PDI技术是将微生物暴露在光敏剂中,在光敏剂相对应的特定吸收波长下,进行激光照射,使微生物吸收的光敏剂受到激发,激发态的光敏剂又把能量传递给周围的氧,生成活性很强的单态氧,单态氧和相邻的生物大分子发生氧化反应,产生细胞毒性作用,导致病原微生物失活。
包膜病毒(如流感病毒、免疫缺陷病毒、单纯疱疹病毒等)可被多种光敏剂失活,包括亚甲蓝[7]、花青素540[8]、金丝桃素、玫瑰红[9]、卟啉[10]和酞菁[11-12]等。尽管所有的病毒成分都可以作为活性氧(reactive oxygen species,ROS)的潜在分子靶点,但最容易受到损伤的是病毒包膜中的蛋白质和不饱和脂肪[ 13]。COSTA 等[14]认为光动力破坏哺乳动物病毒薄膜的主要类型包括:改变蛋白质交联,蛋白质构象的变化、相对分子质量和电荷的改变。这些病毒粒子的损伤形式可以阻止病毒的吸附和对宿主的渗透,进而抑制膜融合,降低感染性。病毒失活的速率取决于光敏剂浓度、单线态氧的产率以及激光照射参数[9,14]。ZARUBAEV等[15]研究表明,尿囊液中用 0.5 g/L光敏剂、5 h激光照射可使H1N1流感病毒表面糖蛋白损失和细胞膜分裂;然而病毒是否因为糖蛋白损失和病毒膜氧化破坏而失活,目前尚不清楚。同时,在尿囊液长时间激光照射是否会引起其他不良反应尚未确定。本试验用不同浓度(2,4 μmol/L)光敏剂A01,激光照射20 min进行光动力失活高致病性H9N2流感病毒,通过电镜对流感病毒的相关形态学的变化进行观察。
1 材料与方法
1.1 主要试剂与仪器超滤浓缩离心管,购自Sartorius;细胞培养所用的培养基、胰酶、胎牛血清均购自GIBCO;光敏剂A01购自常熟吉化有限公司,纯度大于95%(高效液相色谱检测),绿色粉末;激光器购自南京来创激光科技有限公司。
1.2 病毒的产生和纯化A型鸭流感病毒/家鸭/苏州/103/2015 (H9N2)接种10日龄的鸡胚。37℃孵育3 d后,收获尿囊液储存-80℃备用。所有的H9N2流感病毒试验都按照BSL3实验室标准进行。标准操作规程不包括纯化步骤,只是尝试观察PDI对非纯化的尿囊液的影响。由于尿囊液含有高浓度的蛋白质和其他生物分子,可能掩盖了病毒颗粒。将尿囊液通过一个0.22 μm的过滤器过滤,PBS稀释5倍,装入超滤浓缩离心管(“Vivaspin 6”MWCO 300 kDa)混悬,4 000×g离心5 min,PBS加到6 mL,收集混悬液,以上步骤重复5次。第5次离心后,从浓缩器中收集悬浮液(大约每管1 mL分装)。
1.3 细胞培养和病毒滴定37℃、5%CO2温箱中培养MDCK细胞,病毒接种后,细胞培养要补充0.2% 的牛血清白蛋白、50 mg/L的庆大霉素和2 mg/L 的胰酶。试验中设没有感染病毒的细胞作为对照。当96孔板中的MDCK细胞生长到90%融合时进行病毒滴定。首先用PBS洗涤细胞,病毒进行10倍系列稀释(10-1~10-8)后感染MDCK细胞,37℃孵育30 min,弃掉上清,加200 μL的病毒生长培养基,37℃、5%CO2培养5 d。病毒滴度测定采用TCID50法。为防止样品(包括光敏剂)意外照射,96孔板用锡箔纸包裹。
1.4 光动力失活光敏剂A01给药浓度设置为 2,4 μmol/L,分别加入到2瓶病毒悬液中进行失活,每瓶1 mL。激光照射剂量均为12 J/cm2,照射时间20 min,测量的电表容量是10 MW/cm2。装有病毒悬浮液的小瓶随后被放入一个装满水的塑料盒中,以防止过热。此外,设置2个对照治疗组:暗(光敏剂在黑暗中孵育)和激光(没有光敏剂照射)组。
1.5 电镜成像将病毒悬液滴加到覆盖有Formvar膜的200目铜网上,吸附5 min,然后用滤纸将铜网上的病毒悬液吸去,待Formvar膜干燥后滴加 20 g/L磷酸钨进行负染,染色时间1 min,然后用滤纸将磷酸钨吸干,待铜网干燥后,用JEM-1400 电镜进行观察。所有的样品制备都在黑暗的房间进行。
2 结果
2.1 纯化和非纯化尿囊液电镜检测结果加有2 μmol/L 光敏剂未纯化的尿囊液,很难观察到任何结构变化,这可能是因为尿囊液里含有高浓度蛋白质和其他生物分子掩盖病毒粒子。然而对于纯化的尿囊液,电镜照片显示大大提高了病毒粒子结构的可见性,并且病毒粒子呈典型的流感病毒形态,直径100~130 nm(图1)。基于病毒浓度纯化技术和经典的超速离心法病毒纯化技术相比较,本试验使用方法既快又容易。因此,非纯化的尿囊液不能用于光动力失活后的流感病毒超微结构检查,一定需要纯化的病毒悬液,才能精确的可视化。

A.比例尺200 nm;B.100 nm
2.2 H9N2流感病毒光动力失活电镜检测结果用透射电镜对5个不同条件处理的H9N2流感病毒进行观察,结果表明没有处理的病毒(图1)、光对照组病毒(图2)和暗对照组病毒(图3)之间,病毒在形态学上没有差异。用2 μmol/L光敏剂失活的病毒粒子保持正常的近球形形状,其膜结构保持了较好的完整性,但病毒粒子表面变的“光秃”,病毒粒子表面被涂上了一层“光环”,这可能意味着病毒粒子表面膜糖蛋白受到了不完全的氧化破坏(图4)。用4 μmol/L光敏剂失活后的病毒悬液中包含3种形式的“秃”病毒粒子:光滑球形病毒颗粒(25%),膜结构部分破坏的病毒粒子(60%),细胞膜完全破坏的病毒粒子(15%)(图5,6),表明经过长时间用高浓度光敏剂激光照射可破坏所有的病毒粒子。

图2 光对照组(未加光敏剂的激光照射组)
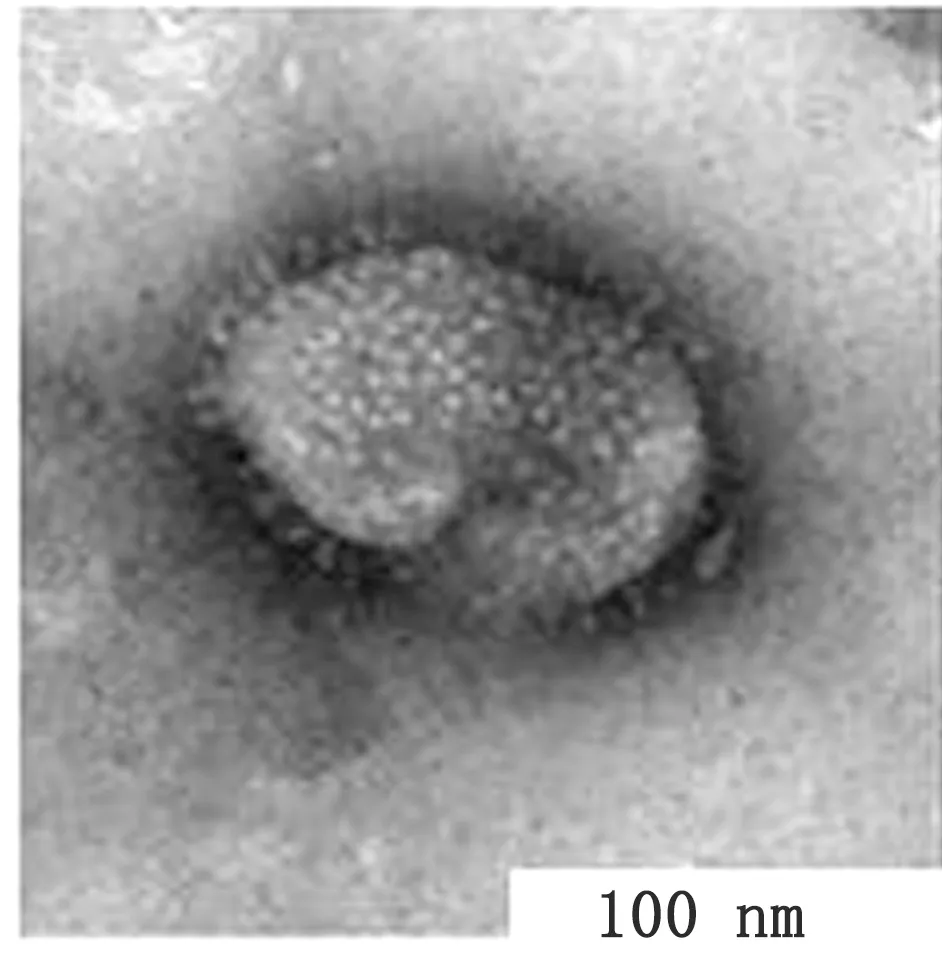
图3 暗对照组(光敏剂浓度4 μmol/L,未激光照射)
2.3 H9N2流感病毒光动力失活感染性检测结果不同条件处理的H9N2流感病毒采用MDCK细胞测定滴度,结果如表1所示,没有经过纯化处理的病毒滴度和对照相近,而含有2种浓度光敏剂的病毒样品经激光照射后,均达到完全失活。
3 讨论
本试验考察了PDI后H9N2流感病毒的超微结构属性,论证了PDI诱导病毒粒子失去表面糖蛋白,甚至破坏病毒粒子表面膜结构,从而导致病毒粒子丧失感染性。由于蛋白质很容易被单线态氧所氧化[13],H9N2流感病毒膜表面的血凝素糖蛋白、神经氨酸酶糖蛋白易受到PDI产生的单线态氧的影响。此外,对PDI导致病毒膜结构损伤的另一种解释是:PDI所产生的胆固醇的氢过氧化物可破坏其他脂质[16]。总的来说,4 μmol/L光敏剂(A01)激光照射后出现的3种不同损害形态的病毒粒子均是由病毒粒子受PDI引起的,其感染性亦完全丧失;而2 μmol/L 光敏剂(A01)激光照射组出现的“光秃”样病毒粒子虽然具有较为完整的膜结构,但是其病毒粒子缺乏感染性,同时无法观察到流感病毒表面的血凝素糖蛋白、神经氨酸酶糖蛋白,病毒粒子表面被涂上了一层“光环”。在本研究中,光敏剂A01(2,4 μmol/L)的处理激光照射H9N2流感病毒20 min可有效失活流感病毒,同时研究表明在其他参数相同的条件下,光敏剂对病毒粒子膜结构的破坏随光敏剂浓度的提高而逐渐加剧,即呈现正相关。事实上,在黑暗中化学反应所产生的高活性ROS[17]和免疫细胞在氧化过程中[18]也表现出杀死病毒的性能,产物可攻击病毒粒子的膜蛋白和不饱和脂质,从而引起膜蛋白的光氧化,导致膜结构的损伤。

A.球形囊泡S表示球形囊泡;B,C.病毒粒子表面有类似球形囊泡样结构;V表示保持结构完整性的病毒粒子;箭头所示光环可能存在糖蛋白

A.比例尺1 μm,黑框区域为放大区域;B.比例尺200 nm,“3”表示光滑的球形病毒粒子,“1”和“2” 箭头表示病毒粒子的膜结构部分受到破坏

A1~A3.膜结构保持完整,膜损伤轻微,箭头标记;B1~B3.部分病毒粒子膜被破坏;C1~C3.膜被破坏,病毒粒子解体

表1 MDCK细胞病毒滴定法测定病毒滴度
经光敏剂处理的病毒电镜观察结果表明,处理后光失活流感病毒粒子发生不同程度破裂,对照组病毒粒子完好无损,这些结果为光敏剂导致病毒光失活提供了可靠的实验依据。从电镜观察光敏剂失活的病毒脂膜发生破损,推测本病毒光敏失活的可能机制是由光敏剂A01同流感病毒脂蛋白囊膜的亲水区结合,经光照射后,光敏剂被激发到三线态,然后与基态氧作用产生激发态单线态氧分子,对流感病毒囊膜造成不可逆转的损伤。

