羊源肺炎克雷伯菌的分离鉴定及毒力基因检测
范培超,史量全,温树波,霍晓伟,薛江东,马德慧
(内蒙古民族大学 动物科学技术学院,内蒙古 通辽 028000)
克雷伯菌属肠杆菌科,有肺炎克雷伯菌、产酸克雷伯菌、植生克雷伯菌和土生克雷伯菌4 个种[1]。其中,肺炎克雷伯菌(Klebsiellapneumoniae)广泛分布于动物的消化道以及水、土中[2],作为一种人畜共患菌与条件致病菌,该菌在医院临床感染上的报道十分常见,症状表现为肺炎、腹膜炎、子宫炎以及腹泻,甚至发生败血症[2]。畜禽以及野生动物亦有相当数量的感染情况。近年来,高毒力肺炎克雷伯菌(hypervirulentKlebsiellapneumoniae,HVKP)的出现及流行,且其多样的荚膜血清型(常见如K1、K2、K5、K20、K54、K57)成为了研究热点。高毒力与耐药性曾被认为不重叠出现[3],但在亚洲的一些HVKP流行国家,关于耐抗菌药物的HVKP分离株报道越来越多,尤其是HVKP获得性碳青霉烯耐药情况的出现,正在对HVKP的临床用药造成威胁。SHON等[4]预测HVKP超毒力和广泛耐药可能会趋同,使药物治疗变得越来越困难,如果不加以干预,HVKP将会变为继耐甲氧西林金黄色葡萄球菌等后的“超级细菌”。
1 材料与方法
1.1 主要试剂与仪器MH肉汤培养基购自青岛高科园海博生物技术有限公司;细菌基因组提取试剂盒购自天根生化科技有限公司;抗菌药物药敏纸片购自杭州微生物制品有限公司;革兰染色液购自北京奥博星生物技术有限责任公司;DL1000 DNA Marker、DL2000 DNA Marker、PCR Mastermix、6×DNA Loadding Buffer购自日本TaKaRa公司;VeritiTMDx 梯度PCR仪购自赛默飞世尔科技有限公司;SPF级昆明小鼠购自郑州大学实验动物中心。
1.2 病死羊剖检内蒙古通辽市开鲁县一羊场病死送检羊,剖检3只,并观察脏器病理变化。
1.3 细菌的分离与培养无菌取病死羊心脏、肝脏、脾脏、肺脏涂片,并接种于血琼脂平板,37℃培养18 h后可见肺脏组织接种的区域长出多个单菌落,挑取单菌落革兰染色后镜检,并对单菌落进行分离、MH肉汤固体平板培养基纯化。
1.4 分离菌株生化及药物敏感性试验使用BD PhoenixTM100全自动微生物分析系统对菌株进行生化特性鉴定。用无菌棉签从纯培养18 h的MH肉汤固体平板培养基上挑取单个菌落,在鉴定肉汤管中制成0.6麦氏比的菌悬液,将制备好的肉汤倒入革兰阳性鉴定药敏复合检测板,再将检测板放入仪器中,反应结束后仪器自动读卡并显示结果,重复3次。吸取50 μL 1×107CFU/mL菌液,均匀涂布于MH肉汤固体平板培养基平板上,间隔放置抗菌药物药敏纸片,37℃培养12 h后观察结果,重复3次。
1.5 分离菌株小鼠致病性试验将小鼠分为试验组和对照组,其中试验组分为2个小组,每组5只鼠,试验组2个小组的小鼠分别腹腔注射106,108CFU/mL 分离菌液,0.5 mL/只;对照组的5只小鼠分别腹腔注射0.5 mL生理盐水,注射后每2 h观察并记录小鼠临床状态。无菌将死亡小鼠的肺脏、肝脏横截面涂片,接种于血琼脂平板,37℃培养18 h,挑取单个菌落,再次进行16S rDNA PCR 扩增测序鉴定。
1.6 分离菌株的16S rDNA PCR鉴定按照细菌基因组DNA提取试剂盒说明书提取分离菌DNA。PCR扩增引物使用16S rDNA扩增通用引物,由上海生物工程有限公司合成。其中上游引物27f序列为5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物1492r序列为5′-ACGGCTACCTTGTTACGA-CTT-3′。PCR扩增反应的总体系为25 μL:PCR Mastermix 12.5 μL,ddH2O 8.5 μL,DNA模板 2 μL,上、下游引物各1 μL。反应条件:95℃ 4 min;95℃30 s,55℃30 s,72℃30 s,30个循环;72℃ 10 min。PCR产物部分经2%琼脂糖凝胶电泳检测,部分进行16S rDNA测序和BLAST分析。
1.7 分离菌株部分毒力基因PCR检测通过魏丹丹等[5]和曹敬荣等[6]研究可知,不同荚膜血清型的肺炎克雷伯菌所含毒力基因存在重复。根据文献[7-8]合成引物(表1),引物由上海生工生物公司合成。
2 结果
2.1 病死羊剖检结果可见气管、支气管内及咽口部有泡沫样液体(图1),肺脏充血且伴有气肿样病变(图2),十二指肠黏膜有点状出血。
2.2 分离菌株分离培养结果病死羊脏器组织划线平板培养16 h后,仅肺脏组织划线的平板上有菌落生长,且菌落不溶血。挑取单个菌落接种于LB液体培养基中,200 r/min,37℃振荡培养16 h。吸取菌液 5 μL于无菌载玻片上,革兰染色,镜检为红色阴性菌,两端较钝,呈单一或成对的粗短球杆状(图3)。分离菌在中国蓝琼脂上的菌落呈蓝紫色(图4),在血琼脂平板上呈乳白色,未发现溶血现象(图5),在麦康凯琼脂平板上呈粉红色(图6)。将分离菌命名为“TLKL1”。

表1 毒力基因引物信息

图1 病死羊剖检咽口部有泡沫样液体
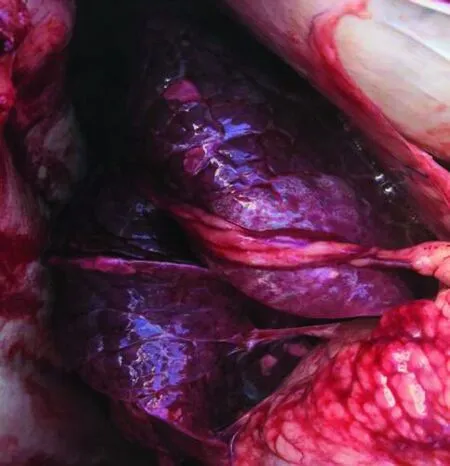
图2 病死羊剖检肺部充血及气肿样病变

图3 分离菌革兰染色形态(×1 000)
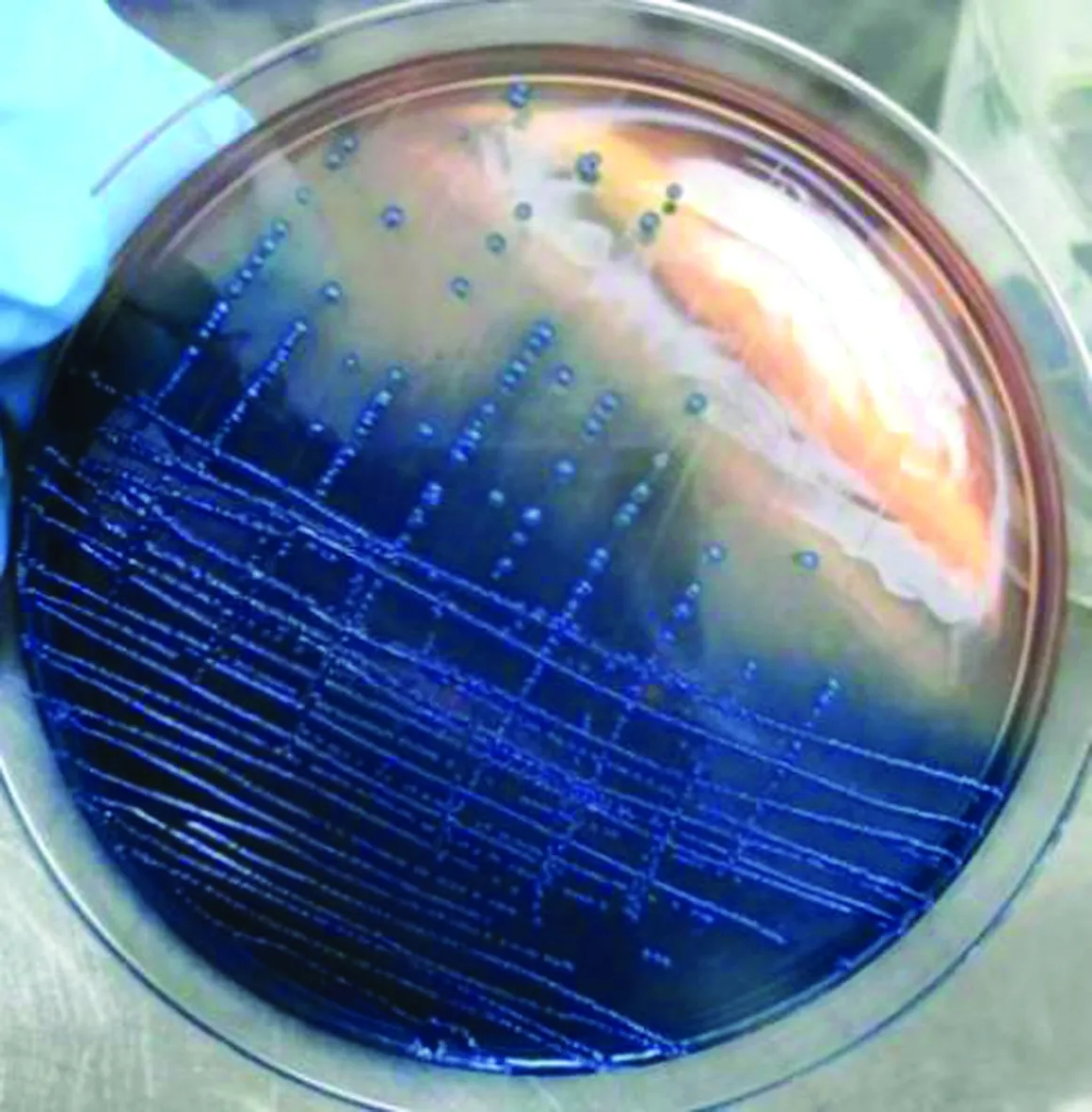
图4 分离菌在中国蓝琼脂上菌落形态
2.3 分离菌株生化及药物敏感性试验结果BD PhoenixTM100全自动微生物分析系统生化特性鉴定结果显示,该菌可以分解D-果糖、右旋糖、蔗糖、麦芽糖等,可产柠檬酸,不产尿酸、多黏菌素B、黏杆菌素等(表2),符合肺炎克雷伯菌的生化特性。
药敏试验以抗菌药物的抑菌环直径大小作为判定依据,结果表明分离株对诺氟沙星、环丙沙星、氧氟沙星、多西环素等药物高度敏感;对复方新诺明、卡那霉素等中度敏感;对庆大霉素、头孢哌酮、头孢氨苄等耐药(表3)。
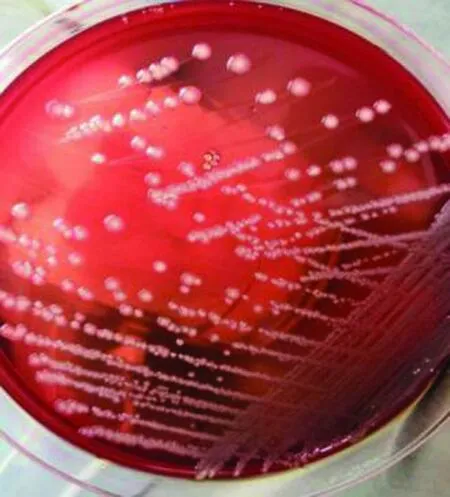
图5 分离菌在血平板上菌落形态

图6 分离菌在麦康凯平板上菌落形态

表2 分离菌生化试验结果
2.4 分离菌株对小鼠致病性试验结果对照组小鼠在试验期内精神状态良好。试验组中,注射0.5×106CFU组的小鼠6 h后出现食欲废绝、精神萎靡的现象,12 h时死亡3只。注射0.5×108CFU组的小鼠12 h全部死亡。剖检死亡小鼠,对肺脏及肝脏涂片镜检,均观察到短粗革兰阴性杆菌(图7,8)。小鼠致病性试验结果表明,本研究中分离到的短粗革兰阴性杆菌具有较强致死性。
2.5 分离菌株的16S rDNA PCR鉴定琼脂糖凝胶电泳结果可见约为1 500 bp的高亮目的条带(图9)。将分离菌株与死亡小鼠脏器分离菌的测序序列分别命名为“TLKL1”、“TLKL2”,测序结果在NCBI网站进行BLAST比较分析,结果两序列均与序列号为KJ803912.1(中国江南株)肺炎克雷伯菌同源性最高,达99.59%。

表3 分离菌株药敏结果
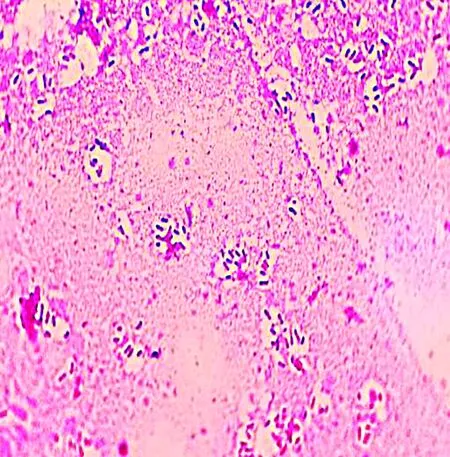
图7 死亡鼠肝脏涂片 (1 000×)

图8 死亡鼠肺脏涂片(1 000×)
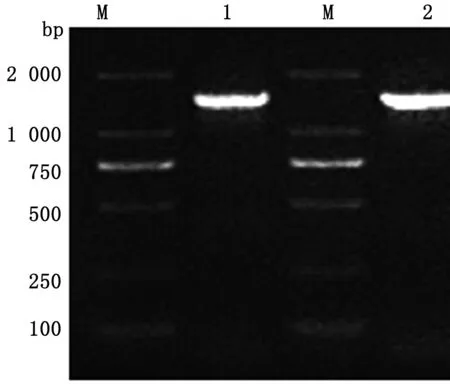
M.DL2000 DNA Marker;1.TLKL1 PCR产物;2.TLKL2 PCR 产物
2.6 分离菌株部分毒力基因PCR检测结果分离株毒力基因PCR结果显示,fimH、ureA、Uge、wabG、ybtA有高亮且单一的目的条带(图10)。
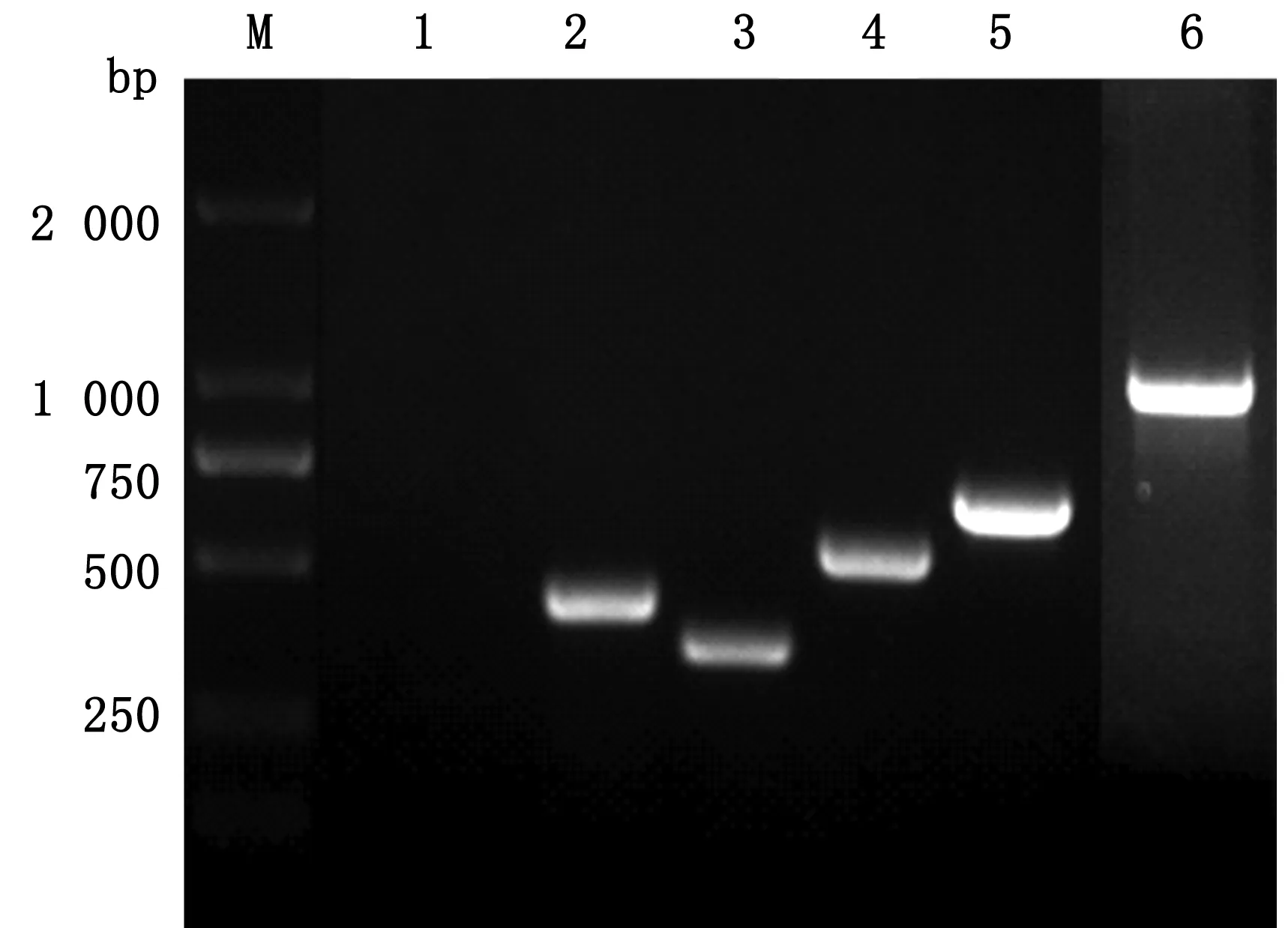
M.DL2000 DNA Marker;1.rmpA;2.wcaG ;3.fimH;4.ureA;5.Uge;6.wabG;7.ybtA
3 讨论
2016年11月发布的全国细菌耐药性检测报告显示,革兰阴性菌中,肺炎克雷伯菌的临床检出率仅次于大肠埃希氏菌,排名第二[9],并且呈逐年增高趋势。该菌可引起人的多种并发症,例如化脓性肝脓肿、脑膜炎、眼内炎和重症肺炎。畜禽肺炎克雷伯菌致病多为散发,常引起肺泡壁和肺组织坏死,临床特点为突然起病,有高热、咳嗽,并伴有消化道症状。该菌可利用多种毒力因子,特别是胶囊多糖、脂多糖、菌毛、外膜蛋白等因子,用于感染期间的存活和免疫逃避[10]。本研究中所采用的BD PhoenixTM100全自动微生物分析系统和16S rDNA检测法较传统细菌鉴别方法更加专业和快捷,其中16S rDNA具有高度的保守性和特异性,普遍应用于细菌鉴定,是细菌种属鉴定的分子生物学基础[11]。药物敏感性试验结果显示,对多种抗菌药物敏感或高度敏感,对少部分头孢类药物耐药,这可能与该羊场长期或多次使用该类药物有关。
该分离菌株在小鼠致病性试验中所显示出的强致死力使得对其进行毒力基因检测显得尤为必要,且毒力基因检测结果显示,5种毒力基因fimH、ureA、Uge、wabG、ybtA均呈阳性,且不排除还有其他毒力基因的可能。肺炎克雷伯菌主要有Ⅰ 型菌毛、Ⅲ型菌毛。其中Ⅰ型菌毛是甘露糖敏感型,由fim(B、E、A、I、C、D、F、G、H)的基因群表达,菌毛的尖端黏附素 fimH 与宿主糖蛋白中的含甘露糖的三糖结合,来介导细菌黏附并侵入宿主的细胞[12];ureA为尿素酶基因座[13],尿素酶在水解尿素时对组织有损伤作用。REGUE等[14]和MIETHKE等[15]证明,在小鼠试验中,uge基因的突变株不能引起尿路感染,而且在其他两个动物模型( 败血病和肺炎)中呈现完全无毒的现象,然而将uge野生型基因再次引入相应突变株中,野生菌的表型则完全恢复,感染小鼠后,小鼠患有尿路感染、败血病和肺炎等。wabG毒力基因的作用是使菌体分泌细胞黏附式荚膜多糖,KARAMA等[16]发现,该基因的突变会使外核心脂多糖(包括O抗原)的合成受阻。
本试验结果与魏丹丹等[5]、曹敬荣等[6]及李花等[17]研究中所得到的rmpA和aerobactin2种毒力基因在该菌中的高检出率有所不同,因此猜测,人源肺炎克雷伯菌与动物源毒力基因携带情况存在较大差异。目前,肺炎克雷伯菌的分型及相关毒力基因的所属关系,以及毒力基因的表达能力尚不明确。且高毒力肺炎克雷伯菌的出现给临床用药带来巨大压力。根据菌株可能携带的毒力基因对其可能导致的疾病做出推测,以及如何快速有效缓解该菌在临床上的感染情况是急需要解决的问题。

