2016-2019年我国部分地区鸡滑液囊支原体分离株vlhA基因遗传进化分析
谢 迪,马 爽,楚电峰,孙通行,陈梦瑶,何吉鑫, 吴艳涛,杜元钊,范根成,张小荣,*
(1.扬州大学 兽医学院/江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;2.青岛易邦生物工程有限公司 动物基因工程疫苗国家重点实验室,山东 青岛 266114)
滑液囊支原体(Mycoplasmasynoviae,MS)是感染鸡和火鸡的重要病原体之一,可引起急性或慢性传染性滑膜炎或气囊炎,导致病死率和用药成本增加,给养殖业造成了巨大的经济损失[1]。MS可以通过直接接触横向传播,也可以通过种蛋垂直传播[2]。MS感染在我国鸡群中广泛流行,尤其是在近5年间,MS的严重感染对我国的养鸡业造成了严重的经济损失[3]。MS目前只有1种血清型,但通过对不同毒株基因序列的差异分析可以分为不同的基因型,虽然基因型与毒株的抗原性和致病性无显著相关性,但可以用于进行流行株的溯源分析。目前已报道的区分MS基因型的方法有多种,其中BENCINA等[4]和JEFFERY等[5]建立的根据可变脂蛋白血凝素A(vlhA)基因5′端片段的序列进行基因型划分的方法应用最为普遍。本研究从江苏、安徽、山东、河南、河北、宁夏、黑龙江、湖北等8个省份的临床发病鸡群中进行MS的分离鉴定,通过vlhA基因测序分析来确定我国流行的MS优势基因型,同时也为研制适合我国的MS疫苗提供科学参考。
1 材料与方法
1.1 病料来源样品采集自江苏、安徽、山东、河南、河北、宁夏、黑龙江、湖北等8个省份疑似发生MS感染的鸡场,共78个鸡群255只病鸡的样品。
1.2 主要试剂支原体培养基购自OXOID公司;精氨酸和半胱氨酸购自Sigma-aldrich公司;β-NAD和葡萄糖购自上海生工生物工程有限公司;细菌基因组DNA试剂盒购自北京康为世纪生物科技有限公司;AceQ®qPCR Probe Master Mix购自诺维赞公司;TransTaq®DNA Polymerase High Fidelity(5 U/μL)购自北京全式金生物技术有限公司。
1.3 菌株的分离、纯化及鉴定用棉拭子无菌擦取病鸡上颚裂隙的黏液及关节液,放入含有1 mL已加热至37℃的支原体液体培养基的2 mL离心管中,37℃生化培养箱中培养3~4 h后,用0.45 μm滤器过滤置于12 mL一次性试管中,加入1倍体积的无菌支原体培养基,继续放入37℃生化培养箱中培养,直至培养基颜色改变。
取200 μL菌液于支原体固体培养基上37℃涂布培养3~7 d,观察菌落生长情况;用灭菌小刀切取含有单个煎蛋样典型菌落的琼脂块,移入支原体液体培养基中压碎进行培养,至培养基颜色改变后,用支原体液体培养基按照1∶10 000稀释培养物,再取200 μL稀释后的培养物于支原体固体培养基上37℃培养,如此反复2~3次,获取纯化的支原体[6-7]。通过MS特异性qPCR进行分离株的鉴定[8],来自同一鸡群病鸡的分离株不重复统计。
1.4 分离株基因分型根据文献[5]报道的方法克隆分离株vlhA基因5′端保守区序列,构建遗传进化树,确定基因型。
1.4.1DNA模板的制备 将-70℃冻存的MS菌株放入37℃水浴锅迅速融化,接种至装有5 mL支原体培养基的一次性试管,置于37℃恒温摇床培养12~24 h;取培养液100 μL至1.5 mL离心管中,加入1 mL PBS,12 000 r/min离心10 min;弃掉1 000 μL上清液,收集菌体,按照细菌基因组DNA提取试剂说明书进行MS基因组的提取,提取后的模板置于-20℃保存备用。
1.4.2引物合成 参照文献[5]所设计的MSvlhA基因分型引物MS Link-F: 5′-TACTATTAGCAGCTAGTGC-3′;MS Cons-R: 5′- AGTAACCGATCCGCTTAAT-3′,引物由南京金斯瑞生物科技有限公司合成。
1.4.3vlhA基因的PCR扩增 PCR反应体系参照TransTaq®HiFi DNA Polymerase的说明书进行操作。反应条件:94℃预变性10 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环;最后72℃延伸5 min。PCR扩增产物经琼脂糖凝胶电泳鉴定,如与预期目的条带大小一致,则进行切胶回收。
1.4.4目的片段序列的测定及分析 将回收纯化的PCR产物送至南京金斯瑞生物科技有限公司进行测序,结果使用Lasergene 7.1进行编辑处理,用Mega 5.1软件构建系统发育树,其中Bootstrap值设定为1 000,观察遗传进化关系。构建遗传进化树时使用的MS参考菌株[9-13]信息见表1。
2 结果
2.1 菌株的分离鉴定根据在支原体固体培养基平板上形成的特征性煎蛋样菌落特征和qPCR鉴定结果,显示共分离到48株MS分离株,菌株信息见表2。
2.2 MS分离株vlhA基因的遗传进化分析及分型结果48株MS分离株vlhA基因PCR扩增产物大小均为约400 bp,经基因测序确认均为特异性扩增。所有分离株vlhA基因核苷酸序列均上传至GenBank,所获得序列登录号见表2。通过将分离株vlhA基因序列与24个参考菌株的基因序列一起构建遗传进化树(图1),结果发现,其中46个分离株属于K基因型,只有分离株Shandong/2019-1属于A基因型和Henan/2019-1属于E基因型(表2)。

表1 参考菌株信息

表2 48株MS分离株背景信息及分型结果
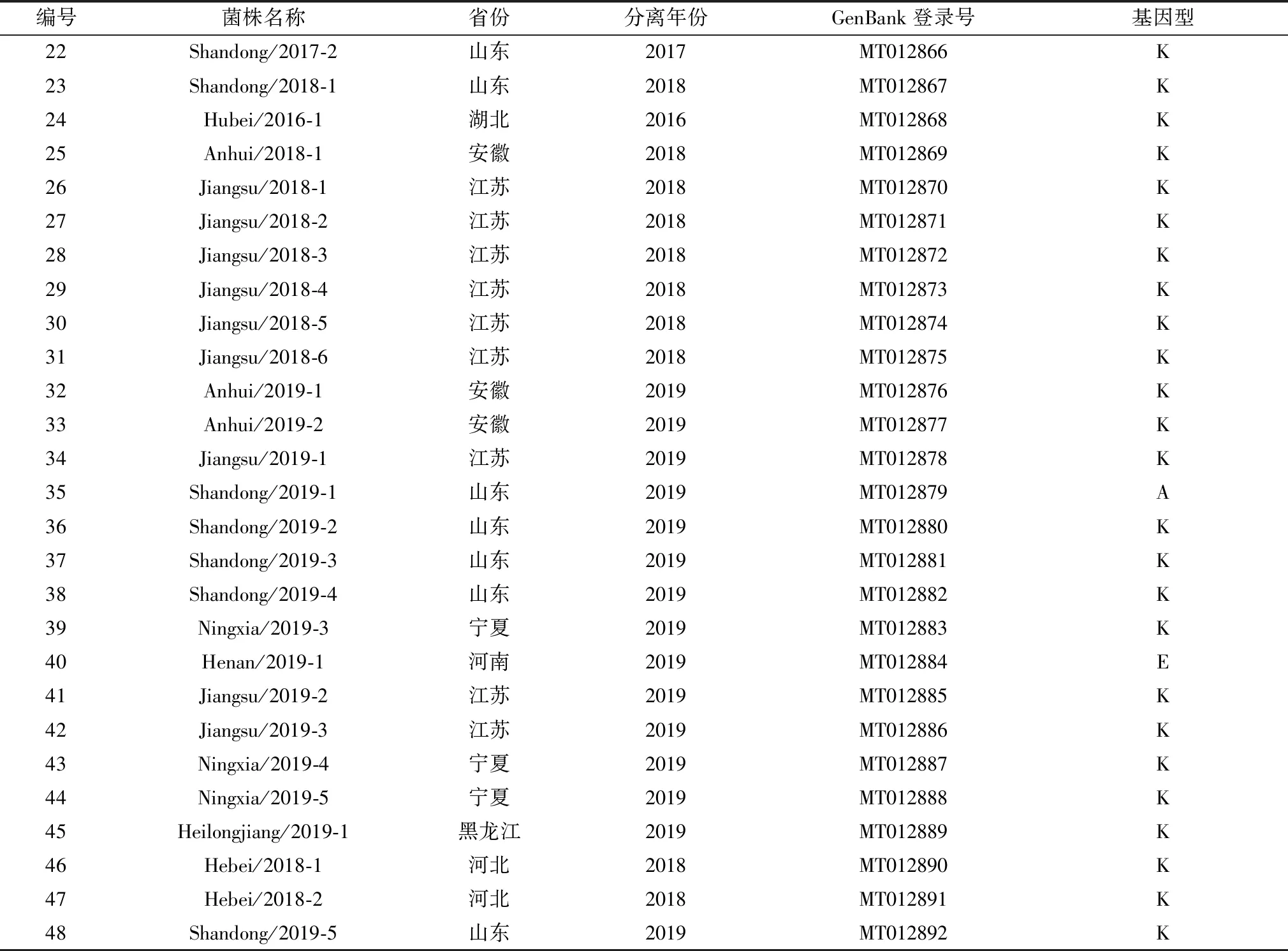
续表2
3 讨论
MS感染在大部分情况下均不表现明显的临床症状,因此长期以来在我国并未得到足够的重视。在2010年之前,国内关于MS感染的流行病学监测数据几乎就是空白。直到近年来才开始有一些学者对国内鸡群MS感染的状况做了较为系统的流行病学调查,如SUN等[3]对2010―2015年来源于国内16个省份的鸡血清进行检测,抗体阳性率高达63.2%;而XUE等[14]用ELISA方法对2010―2015年来自中国21个省的44 395只未接种疫苗鸡的滑液囊支原体血清阳性率进行了估算,总血清阳性率为41.19%。这些监测数据均表明MS感染在我国还是非常普遍的,但是长期以来,由MS感染所导致的传染性滑膜炎等典型病例仅仅呈现为零星发生,并未造成严重的经济损失。自2017年以来,我国主要养鸡地区几乎在同一时间开始出现了越来越严重的MS感染暴发,中国地方鸡种、白羽肉鸡、蛋鸡甚至很多种鸡群均也波及,典型的临床病例频繁出现,部分鸡群发病率甚至可高达30%以上,同群未发病的鸡整体生产性能也受到很大的影响。关于暴发的原因,业界存在不同的分析,有的专家认为跟从国外引进种鸡有关,尤其是近几年受海外禽流感疫情的影响导致的封关政策而频繁变换引种来源可能是重要的原因。也有专家认为跟我国最近几年养鸡行业的快速发展导致养殖规模扩张太快有关。针对这种现状,引入分子分型的方法对流行菌株进行溯源分析,将有助于阐明MS在我国的传播和流行的真实状况。
根据对不同来源MS的vlhA基因5′末端序列进行分析,目前已经发现存在16种不同的基因型(A~K)[4-5,15-18],其中A~J基因型均由国外研究发现,K基因型为在我国首先发现。根据SUN等[13]对2013―2014年从中国16个省份分离出110株MS菌株的分型结果,所有新分离株均属于一种独立的新基因型即K亚型。而本研究对近3年从国内8个省份分离鉴定的48株MS分离株进行分子分型的结果同样也显示,其中有46株均属于K基因型,这说明我国流行的MS优势基因型仍为独有的K基因型,并未发生明显的变化。该研究结果也提示我们,我国近年来发生的MS暴发并非由于引种等因素而造成的输入型感染,其传染来源仍在国内,需要从传播途径、饲养模式、药物使用等多个不同角度进一步深入研究控制MS感染的有效措施。

