猪源奇异变形杆菌的分离鉴定、耐药性分析及毒力基因检测
黎娜铭,王彬,舒正强,曾智勇,黄涛,汤德元,吴学祥
(1. 贵州大学动物科学学院,贵州 贵阳 550025;2. 贵州省独山县麻尾镇人民政府,贵州 独山 558206;3. 贵州省黔西南州农业农林局,贵州 兴义 562400)
奇异变形杆菌是广泛分布于自然界、动物粪便、临床标本以及人和动物肠道内的重要条件致病菌,主要以其在琼脂平板上成群分化的模式以及与尿路感染患者肾结石的发展相关而闻名,可引起人和动物尿路感染、胃肠炎和败血症等[1-2]。奶牛、羊、火鸡、鹅和虎等多种动物被奇异变形杆菌感染,可引起肺炎、腹泻、关节炎等症状[3-7]。奇异变形杆菌能引起猪腹泻、败血症等[8-10],给养猪业造成较大的经济损失。本试验对病死猪内脏分离菌进行形态特征、生化特性鉴定,初步鉴定该分离菌为变形杆菌,通过16S rRNA基因序列分析,从分子水平确定该分离菌为奇异变形杆菌,并对其进行耐药性分析、毒力基因检测和小鼠攻毒试验,旨在为该苏感染的防治及其分子流行病学研究提供参考。
1 材料与方法
1.1 病料来源及实验动物
病料来源于贵州某屠宰场突发死亡猪的心、肝、脾、肺和肾等内脏器官;实验动物为6~8周龄SPF昆明小鼠,购自辽宁长生生物技术股份有限公司。
1.2 主要试剂
细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;PremixTaq(TaKaRaTaqVersion 2.0 plus dye)购自宝生物工程(大连)有限公司;DL2000 plus DNA Marker购自南京诺唯赞生物科技有限公司;鲜血培养基购自广东环凯微生物科技有限公司;麦康凯培养基、胰蛋白胨大豆琼脂(TSA)和胰蛋白胨大豆肉汤(TSB)购自海博生物技术有限公司;水解酪蛋白琼脂(MH琼脂)、细菌微量生化反应管和药敏片购自杭州微生物试剂有限公司;质控菌株为大肠埃希菌(ATCC 25922),购自广东环凯微生物科技有限公司。
1.3 引物合成
根据相关参考文献引物序列[9],由上海生工生物工程股份有限公司合成(见表1)。
1.4 细菌分离与纯化
用接种环无菌穿刺病死猪心、肝、脾、肺和肾等病料,接种于含血清和NAD的TSA培养基、麦康凯培养基和鲜血培养基,37 ℃恒温培养24 h,挑取典型菌株进行划线和摇菌纯化,观察菌落在培养基上生长形态,对纯化菌进行革兰染色镜检。
1.5 生化试验
将生化管在超净工作台中用齿轮割开,无菌接种纯化菌液于6.5%高盐肉汤、马尿酸钠、七叶苷、甘露醇、山梨醇、乳糖 、菊糖、绵实糖、海藻糖、水杨苷等生化管中,37 ℃恒温培养18~24 h,记录试验结果。
1.6 16S rRNA基因序列测定及分析
按照细菌基因组DNA提取试剂盒说明书抽提细菌基因组DNA,用上述16S rRNA基因引物进行PCR扩增,将PCR产物送华大基因有限公司进行测序。测序结果于GenBank上BLSAT进行同源性比较,选取同源性较高的9个菌株16S rRNA基因序列,用DNASTAR Megalign软件对选取的菌株序列建立进化树并进行分析。

表1 引物序列
1.7 药物敏感试验
吸取纯化菌液100 μL 均匀涂布于MH琼脂培养基上,待培养基上菌液稍干,用无菌镊子夹取药敏片平放在培养基上,每个培养基均匀放置5种药敏片。将培养基放置于37 ℃恒温培养箱中16~18 h,观察并测量该菌抑菌圈大小,并参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)推荐的纸片扩散法标准进行判定。
1.8 毒力基因检测
挑取单个菌落接种于TSB液体培养基中,37℃摇床培养18 h,用移液枪吸取1.5 mL菌液于无菌EP管中12 000 r·min-1离心1 min,后用细菌基因组DNA提取试剂盒提取细菌基因组DNA,测定浓度,并置于-20 ℃保存备用,用毒力基因引物扩增细菌基因组DNA毒力基因。
1.9 小鼠攻毒试验
将SPF小鼠随机分2组,每组5只。试验组小鼠每只腹腔注射菌液0.2 mL(通过平板计数法计算原菌液浓度,测定LD50后,调整攻毒菌液浓度为1×108CFU·mL-1),对照组小鼠每只注射灭菌TSB液体培养基0.2 mL,每8 h对小鼠发病及死亡情况进行一次观察记录,将死亡小鼠解剖观察并对其内脏器官中分离菌进行鉴定。
2 结果
2.1 细菌分离培养
分离菌株在TSA培养基、LB培养基和麦康凯培养基上呈圆形透明湿润菌落,当培养基水分较充足时,分离菌在培养基上呈“雾蔓”式生长,形成厚薄交替层层波状的同心环样菌苔(图1)。革兰(图2)染色镜检呈细小或中等短杆状或丝状革兰阴性杆菌。
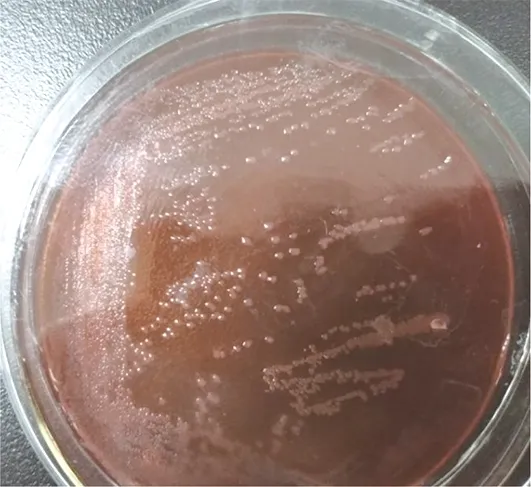
图1 分离菌株在麦康凯培养基上的生长情况
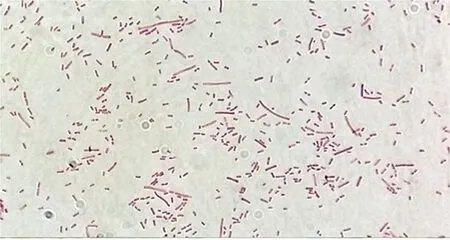
图2 分离菌株镜下呈短杆状或丝状(1 000×)
2.2 细菌生化鉴定
生化试验结果(表2)显示,分离株能分解尿素和硫化氢,能利用棉子糖、山梨醇、血清菊糖、覃糖、木糖,动力试验阳性,不能发酵乳糖、甘露醇、马尿酸,精氨酸水解和七叶苷水解为阴性,与奇异变形杆菌的生理生化特性基本一致。

表2 分离株的生理生化特征
2.3 分离菌株16S rRNA 基因序列的测定与分析
分离菌株用细菌16S rRNA基因通用引物扩增后,获得1 401 bp目的条带(如图4)。经测序,在NCBI上进行BLAST,发现该菌株与奇异变形杆菌同源性高达100%,选取同源性较高的9个菌株16S rRNA基因序列:KR133627.1(中国四川株)、MH396765.1(尼日利亚株)、KF471509.1(巴基斯坦株)、KX495210.1(印度株)、MH532480.1(中国北京株)、KF811051.1(中国黑龙江株)、KJ190018.1(日本株)、MH643694.1(中国江苏株)、KC456549.1(中国云南株),用DNASTAR Megalign软件建立进化树,结果显示,该菌株与奇异变形杆菌KR133627.1(中国四川株)在同一分支(如图5),亲缘关系最近,从分子层面确定分离菌株为奇异变形杆菌,命名为GZ2-2。
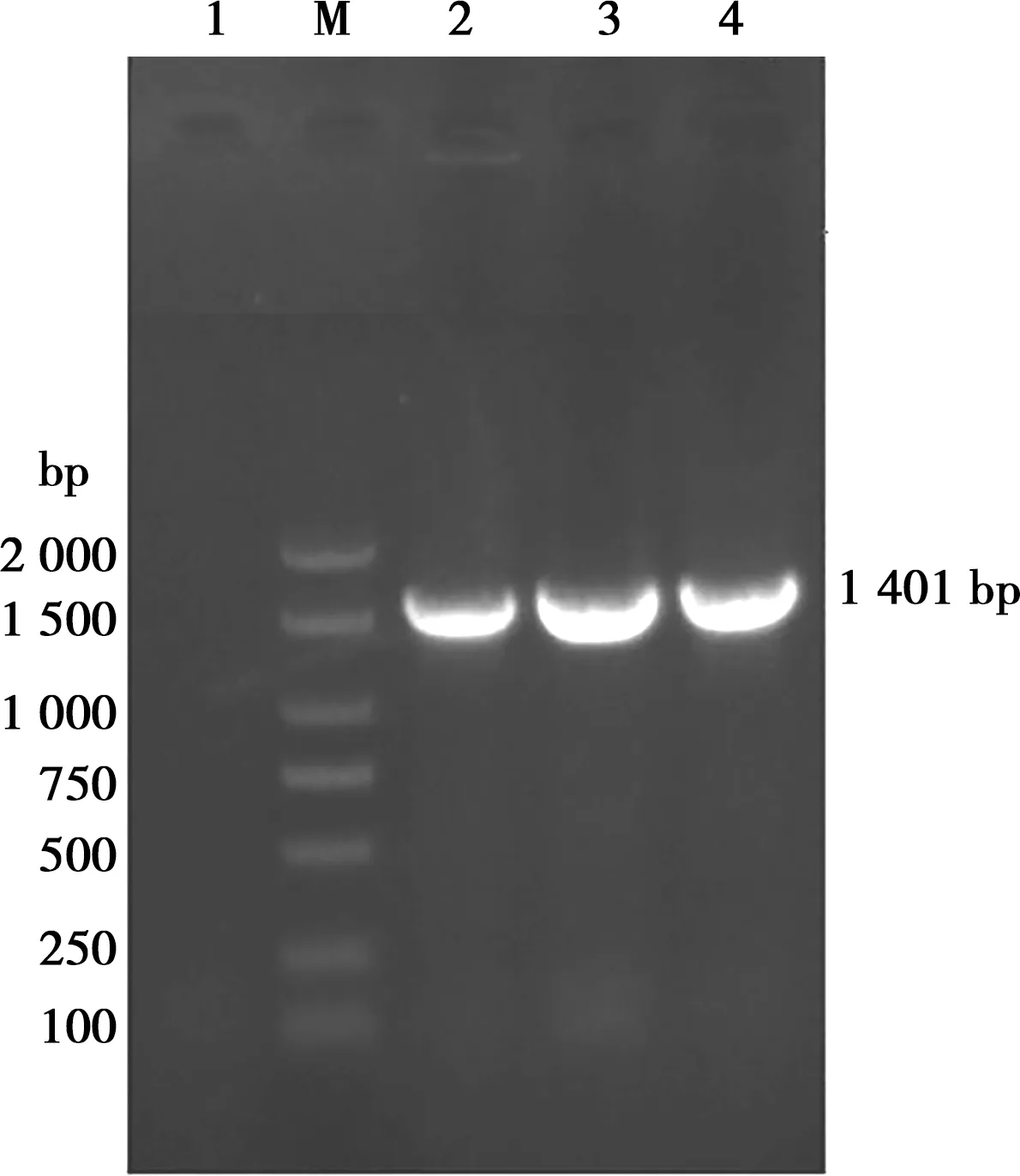
M. DNA标准 DL2000 plus;1. 阴性对照;2~4. 样品
2.4 药敏试验
药敏试验结果(表3)表明,该分离菌株对氨苄西林、头孢唑林、头孢拉定、四环素、多西环素、呋喃唑酮等6种药物耐药,对卡那霉素和米诺环素2种药物中敏,对哌拉西林、头孢呋辛、头孢他啶、头孢曲松、头孢哌酮、丁胺卡那、庆大霉素、诺氟沙星、氧氟沙星、环丙沙星、氯霉素,共11种药物敏感。
2.5 毒力基因检测
扩增细菌基因组DNA毒力基因,结果显示8种毒力基因均能被扩增出目的条带(如图5),表明该分离菌株携带rsbA、atfA、pmfA、mrpA、zapA、ureC、atfC、ucaA基因。

•本试验分离菌珠
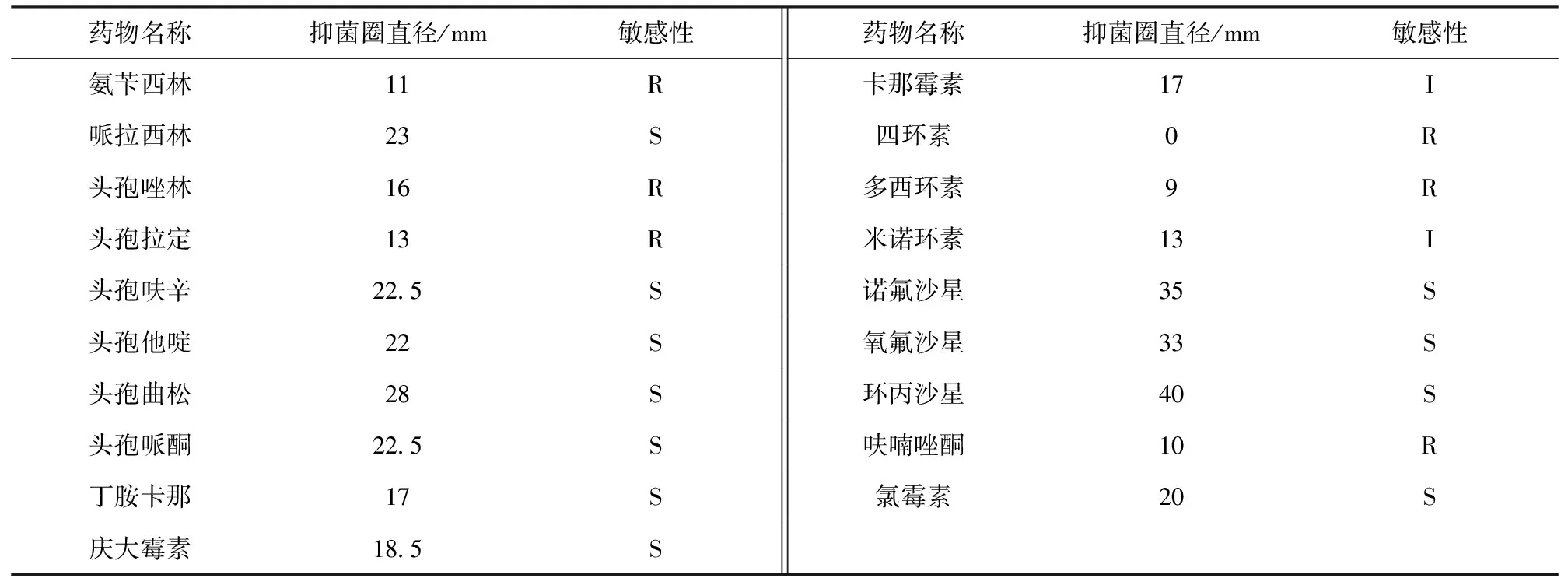
表3 分离菌株药敏试验结果
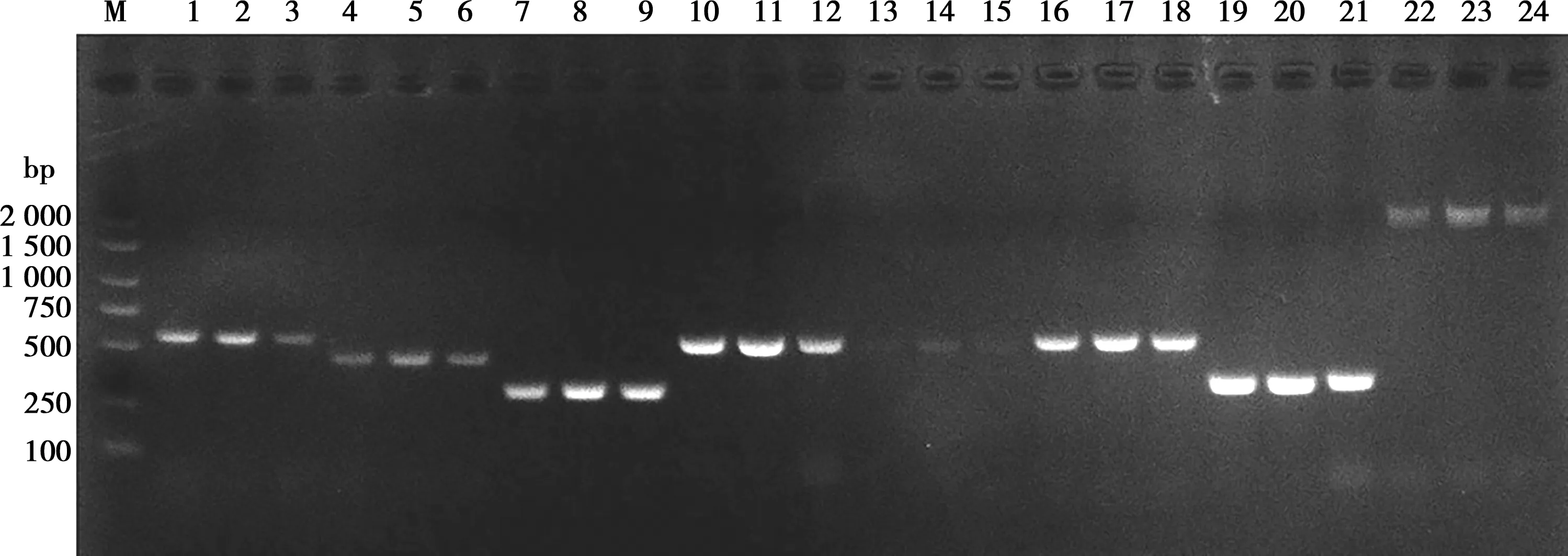
M. DNA标准 DL2000 plus;1~3. ucaA基因;4~6. atfC基因;7~9. ureC基因;10~12. zapA基因;13~15. mrpA基因;16~18. pmfA基因;19~21. atfA基因;22~24. rsbA基因
2.6 小鼠攻毒试验
试验组小鼠腹腔接种分离菌株培养液12 h后,出现精神萎靡,喜呆角落,并将头钻进垫料中等现象,18 h后小鼠陆续死亡,72 h内小鼠全部死亡,部分死亡小鼠肛门沾有稀便,将死亡小鼠剖检,发现肺充血、出血,胸腔和腹腔中的器官均有不同程度纤维素性炎,肠黏膜充血,并从死亡小鼠体内分离到奇异变形杆菌,而对照组小鼠无明显症状及死亡。
3 讨论
奇异变形杆菌隶属肠杆菌科变形杆菌属,形态为短杆状、球杆状、长线状,运动活泼,在湿润琼脂表面可呈游散生长[11-12]。本试验从病死猪组织器官中分离出一株奇异变形杆菌,在鲜血培养基中呈白色圆形菌落,在TSA培养基和麦康凯培养基上呈半透明、圆形湿润菌落,在湿润LB培养基中长出一圈一圈的波纹状菌苔,与其他学者的研究结果相同[13-15]。
近年来,奇异变形杆菌耐药越来越严重。谢秀兰等[16]研究发现,羊源奇异变形杆菌分离株对氨基糖苷类抗生素(阿米卡星、卡那霉素、链霉素)、氟苯尼考及头孢菌素类抗生素敏感,而对大环内酯类(红霉素和克林霉素)、复方新诺明、恩诺沙星全部耐药;对青霉素类(哌拉西林、氨苄西林、阿莫西林)、喹诺酮类(环丙沙星、氧氟沙星、诺氟沙星)、四环素、万古霉素、庆大霉素呈现不同程度的耐药。刘娜等[3]研究表明,分离出的鸡源奇异变形杆菌仅对氨基糖苷类耐药。Hadjer等[17]研究表明,166株奇异变形杆菌分离株中的14株(8.43%)对以下主要抗生素耐药,包括阿莫西林、克拉维酸、头孢噻肟、庆大霉素和环丙沙星。
本试验中,分离菌株对氨苄西林、头孢唑林、头孢拉定、四环素、多西环素、呋喃唑酮等6种药物耐药,对卡那霉素和米诺环素2种药物中敏,对哌拉西林、头孢呋辛、头孢他啶、头孢曲松、头孢哌酮、丁胺卡那、庆大霉素、诺氟沙星、氧氟沙星、环丙沙星、氯霉素,共11种药物敏感;说明该分离菌株与其他研究者有所区别,可能由于不同地区、不同养殖场的用药制度、用药方法不同,导致不同分离菌株的耐药情况不一样。 Wasfi等[18]研究表明,在MIC以下浓度的抗菌剂中,环丙沙星在减少奇异变形杆菌生物膜形成方面最有效,头孢曲松和环丙沙星对部分清除预先形成的生物膜生物量有效,当尿液中达到高抗菌浓度时,环丙沙星在杀死细菌细胞方面更有效。这解释了本试验分离菌对头孢曲松、环丙沙星敏感的这一结果。
由于碳青霉烯酶是指能分解包括碳青霉烯类抗生素在内的几乎所有β-内酰胺类抗生素的一大类β-内酰胺酶,产肺炎克雷伯菌碳青霉烯酶(KPC)的分离株引起的感染是当今世界范围内的主要公共卫生问题。 Cabral等[19]研究发现,使用质粒DNA的PCR试验证实了blaKPC-2存在于质粒中,而由于转座子是可移动的遗传元件,blaKPC-2可以存在于检测到的5个质粒中的任何一个中(>150,150,120,90和70 kb),同时其数据证实,携带blaKPC-2的奇异变形杆菌株正在巴西出现,表明blaKPC在细菌属之间连续转移。因此,各养猪场应更加合理使用药物,避免多重耐药菌株的出现。
变形杆菌感染的最常见临床表现是尿路感染,其通过使用多种毒力因子来进入和定殖宿主尿路,包括尿素酶和结石形成,菌毛和其他黏附素,铁和锌的获取,蛋白酶和毒素,生物膜的形成以及发病机理的调节[20]。同时,像其他革兰阴性细菌一样,变形杆菌在侵入血液时会释放内毒素,从而引发其他宿主炎症反应,最终导致败血症或全身性炎症反应综合征(SIRS),死亡率为20%~50%[21]。本试验的死亡猪有肚子胀气现象,剖检发现血液呈黑褐色且凝固不良,内脏器官均有不同程度发黑,腹腔鼓气,散发恶臭;攻毒试验中,试验组小鼠均在72 h内全部死亡,其剖检胸腔器官有不同程度的纤维素性炎,各脏器不同程度的充血、出血、有恶臭气味等与前人研究结果相符[13, 22],说明该菌能在动物体内产气,并能够引起动物体内脏器官不同程度的病变,引起全身性炎症反应,产生菌血症,最终导致死亡。
奇异变形杆菌主要毒力基因有rsbA、atfA、pmfA、mrpA、zapA、ureC、atfC、ucaA,其中,ureC为尿素酶的功能亚单位,mrpA为MRP菌毛主要结构亚单位,ucaA为尿道上皮黏附素结构亚单位,rsbA为“雾蔓”迁徙能力的调节基因,pmfA为奇异变型杆菌菌毛(PMF)主要结构亚单位,atfA为适温菌毛结构亚单位,atfC为适温菌毛合成的分子引物,zapA为金属蛋白酶结构亚单位[23]。Mobley等[2]的研究中,脲酶和鞭毛对毒力的贡献最大,而菌毛则起着更微妙的作用,溶血素似乎对致病性没有明显的作用;并且,奇异变形杆菌产生的抗甘露糖变形菌样菌群(MR/P),在Zunino等[24]的研究中,通过采用不同的试验方法对一株奇异变形杆菌临床分离株和一株不能表达MR/P的等基因突变体进行了检测,结果发现突变株比野生型菌株更不容易在上、下泌尿道上定殖,其试验数据证实了MR/P菌毛在奇异变形杆菌尿道感染中的重要性,说明脲酶、鞭毛、菌毛对是奇异变形杆菌的重要毒力基因。在Sun等[25]的研究中,大约92.05%的分离株有生物膜,而7.95%的分离株没有生物膜;有生物膜菌株的致病力显著高于无生物膜菌株,同时,生物膜的产生与ureC、zapA、rsmA、hmpA、mrpA、atfA和pmfA的表达显着相关,说明携带ureC、zapA、rsmA、hmpA、mrpA、atfA和pmfA等毒力基因的奇异变形杆菌对动物致病性较强。本试验分离株携带rsbA、atfA、pmfA、mrpA、zapA、ureC、atfC、ucaA基因,说明本分离株具有一定的致病性。尹有勤等[26]的研究报道不同来源的奇异变形杆菌对小鼠的致病力存在较小的差异, 且对小鼠有致病力的基因表型与该毒力基因的分布可能存在一定的相关性。结合毒力基因检测和小鼠攻毒试验,表明本试验离菌具有较强致病性。本研究为奇异变形杆菌病的防治及其分子层面的探讨提供了基础。

