长顺绿壳蛋鸡SFRP5基因外显子1的SNPs鉴定及其与常规肌肉品质的关联性分析
游敏芳,廖朝美,吴磊,张依裕*,刘若余,蒋会梅,张义玲,向程举,杨远清
(1. 贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025;2. 贵州大学贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025;3. 贵州大学动物科学学院,贵州 贵阳 550025;4. 毕节市畜禽遗传资源管理站,贵州 毕节 551700)
分泌型卷曲相关蛋白-5(secreted frizzled-related protein 5, SFRP5)属于SFRP家族成员,它是脂肪组织分泌的一种炎症反应脂肪因子和Wnt/β-连环蛋白信号通路的拮抗物,还参与胚胎发育、炎症发生和免疫等多种生物学过程[1-2]。SFRP5含有与卷曲半胱氨酸结构域同源性的类网肽功能域和富含半胱氨酸的结构域,是参与膜卷曲受体竞争的核心区[3]。小鼠白色脂肪组织信号通路中,SFRP5介导表观遗传沉默可能强化脂肪生成,增加对饮食诱导肥胖的易感性[4]。SFRP5能抑制慢性炎症,提高胰岛素敏感性,强化其作为2型糖尿病(T2DM)的一个风险因子以及在维持葡萄糖稳态中发挥重要作用[5]。研究发现,脂肪组织中SFRP5-Wnt5a调节轴可能是调控脂质代谢紊乱的一个靶标,SFRP5能够调控Wnt5a信号的稳定,在慢性轻度炎症中,SFRP5对Wnt5a表现出中和作用[6]。SFRP5能够加强脂肪细胞脂质的累积[7],肥胖小鼠和人类脂肪组织中SFRP5表达水平升高,在白色脂肪细胞和棕色脂肪细胞分化过程中,SFRP5缓慢诱导表达,成熟脂肪细胞中表达水平最高[8]。SFRP5表达缺乏的小鼠将发生严重的巨噬细胞浸润,引起葡萄糖耐受不良、胰岛素抵抗以及炎症性脂肪组织[9]。然而,关于SFRP5对肥胖影响在不同研究中存在着争议。Hu等[10]报道肥胖者的SFRP5表达水平低于非肥胖者,且与肥胖指标体质指数(BMI)、腰臀比(WHR)、体脂率和血脂相关。Schulte等[11]指出在肥胖和瘦弱人群中SFRP5表达变化明显。尽管SFRP5在人类和啮齿类动物上的研究广泛,但有关SFRP5在家禽中的生物学功能研究极为缺乏。Li等[12]研究显示,SFRP5基因mRNA表达水平与藏鸡(Gallus gallus domesticus)肌肉脂肪密切相关。本试验选用的长顺绿壳蛋鸡已成为国家级畜禽遗传资源保护的地方家禽,也是全国唯一国家级绿壳蛋鸡地方保护品种,因其在贵州的特定自然生态坏境下,经过长期的自然选择和人工选育,具有抗病力强、耐粗饲等特点,是肉蛋兼用型鸡品质。潘周雄等[13]对20只长顺绿壳蛋鸡公鸡和20只母鸡进行屠宰性能测定,结果显示胸肌的占比分别为16.07%、17.79%,且鸡胸肉因其肉质细嫩,含有较高的蛋白质含量,容易被人体消化吸收等特点而被人们喜爱。覃媛钰等[14]在SFRP5 基因外显子3上发现2个突变位点,且结果显示SFRP5 基因的遗传变异能影响长顺绿壳蛋鸡胸肌脂肪沉积,然而有关长顺绿壳蛋鸡SFRP5 基因外显子1上的遗传变异对其胸肌常规肌肉品质的影响的研究较为鲜见,使用本试验以长顺绿壳蛋鸡为材料,检测SFRP5基因外显子1的SNPs位点,探讨其对长顺绿壳蛋鸡胸部肌肉品质的调控效应,为进一步深入研究SFRP5基因在家禽中的分子效应机理提供参考资料。
1 材料与方法
1.1 试验材料
同批出雏的200只长顺绿壳蛋鸡母鸡饲养于贵州大学科研鸡场,按照1994年NRC颁布的鸡营养需要和第28版《中国饲料成分及营养价值表》配制日粮,饲养管理条件一致的条件下饲养至120日龄,淘汰不健康的个体后,随机抽取165只进行屠宰,取胸肌2份,一份用于基因组DNA提取,一份用于肉质测定。动物组织基因组DNA提取试剂盒购自大连TaKaRa公司,离心柱型琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司, PCR Master Mix、无水乙醇、琼脂糖、PCR管等常规试剂及耗材均购自生工生物工程(上海)股份有限公司。
1.2 常规肉质指标测定
对采取的胸肌于45 min内完成肉质指标的预处理,按照《猪肌肉品质测定技术规范》(NY/T821—2004)测定长顺绿壳蛋鸡胸肌常规肉质指标pH值、嫩度、蒸煮损失、失水率和粗脂肪含量。
1.3 DNA提取、引物设计和PCR扩增
按照动物组织基因组DNA提取试剂盒抽提肌肉中基因组DNA,琼脂糖凝胶电泳结合核酸浓度测定仪进行检测,稀释成终浓度100 ng/μL备用。根据鸡SFRP5基因序列(NC_006093.5)设计扩增外显子1的特异引物,F:5′-CAGCAGCCAGAGCAGATTG-3′,R:5′-CGGTGCTTGTCCCACTTAC-3′,扩增区域位于基因组g.23251540-23252193。20 μL的PCR反应体系:PCR Master Mix 8.0 μL,RNase-Free Water 9 μL,10 μmol/L正、反向引物各1.0 μL,模板DNA 1.0 μL。PCR扩增程序:95 ℃预变性6 min;94 ℃ 变性30 s,58.5 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃延伸8 min,10 ℃保存。
1.4 SNPs鉴定
采用1.5%琼脂糖凝胶电泳检测PCR产物,离心柱型琼脂糖凝胶DNA回收试剂盒回收PCR产物,送生工生物工程(上海)股份有限公司进行测序,采用DNAStar软件MegAlign程序结合测序峰图筛查鉴定SNP位点。
1.5 统计分析
运用SHEsis网上在线软件(http://analysis.bio-x.cn/)计算SNP位点的基因型频率、等位基因频率、单倍型频率、基因型分布卡方值(χ2)、连锁不平衡的D′值和r2值;PopGen32 V1.31软件计算观察杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC);SPSS 19.0软件中的广义线性模型(GLM)分析SNP位点基因型或双倍型与所测定性状指标的相关性,模型为Y=μ+G+H+e,Y为性状观测值;G为基因型效应;H为双倍型效应;μ为群体均值;e为随机残差,最小显著性差异法(LSD)多重比较,结果用“平均值±标准误”表示。
2 结果与分析
2.1 SNPs筛查与鉴定
对PCR产物进行直接测序,序列比对结果见图1。结果表明,共发现3个SNP变异位点:g.23251706 C>T、g.23251882 C>T和g.23252056 C>T,均处于SFRP5基因外显子1的CDS区;通过蛋白翻译分析结果表明,3个SNP位点均未能导致编码的氨基酸发现改变,均为同义突变。
图1 序列比对峰图
2.2 SNPs的遗传特性分析
对SFRP5基因外显子1的3个SNP位点在长顺绿壳蛋鸡群体中的遗传信息进行分析,结果见表1。结果显示,g.23251706 C>T位点的属于低度多态位点,而g.23251882 C>T和g.23252056 C>T位点则为中度多态位点,3个位点的等位基因C和基因型CC均处于优势地位,等位基因C的频率均大于0.780,基因型CC的频率均大于0.640,基因型Hardy-Weinberg平衡检验结果表明3个SNP位点的基因型分布均未偏离平衡状态(P>0.05),揭示3个SNP位点未受到突变、选择、遗传漂变等的影响,或者是受到影响而由于长期的人工选择并进行大规模扩群后又重新处于一种新的平衡状态。
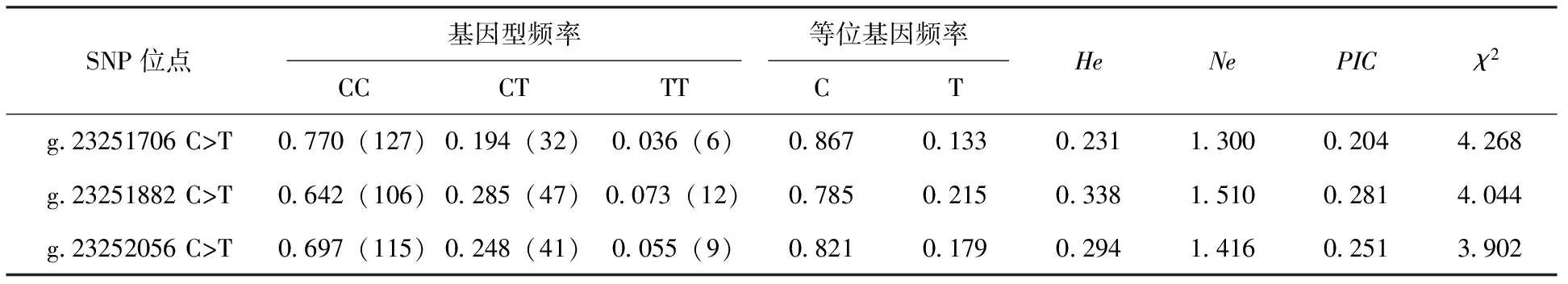
表1 长顺绿壳蛋鸡SFRP5基因外显子1的SNP位点群体遗传信息分析
2.3 SNPs连锁不平衡、单倍型和双倍型分析
对长顺绿壳蛋鸡SFRP5基因外显子1中发现的3个SNP位点进行连锁不平衡分析,结果见表2。结果显示,3个SNP位点之间的D′值处于0.994~0.999之间,大于0.800;r2值处于0.033~0.060之间,小于0.330。根据Ardlie等[15]和Slatkin[16]的报道,当|D′|>0.8和r2>0.33时认为SNPs位点间存在强连锁不平衡,揭示了本研究发现的3个SNP位点间不存在强连锁不平衡。
对3个SNP位点进行单倍型和双倍型分析,结果见表3。结果显示,SFRP5基因外显子1中发现的3个SNP位点长顺绿壳蛋鸡群体中共检测到4种单倍型和10种双倍型,单倍型H1的频率最高,其频率为0.473,为优势单倍型,H4的频率最低,其频率为0.133,为劣势单倍型;双倍型H1H1的频率最高,为0.285,为优势单倍型,H4H4的频率最低,为0.036,为劣势双倍型。

表2 SFRP5基因外显子1的SNPs连锁不平衡分析
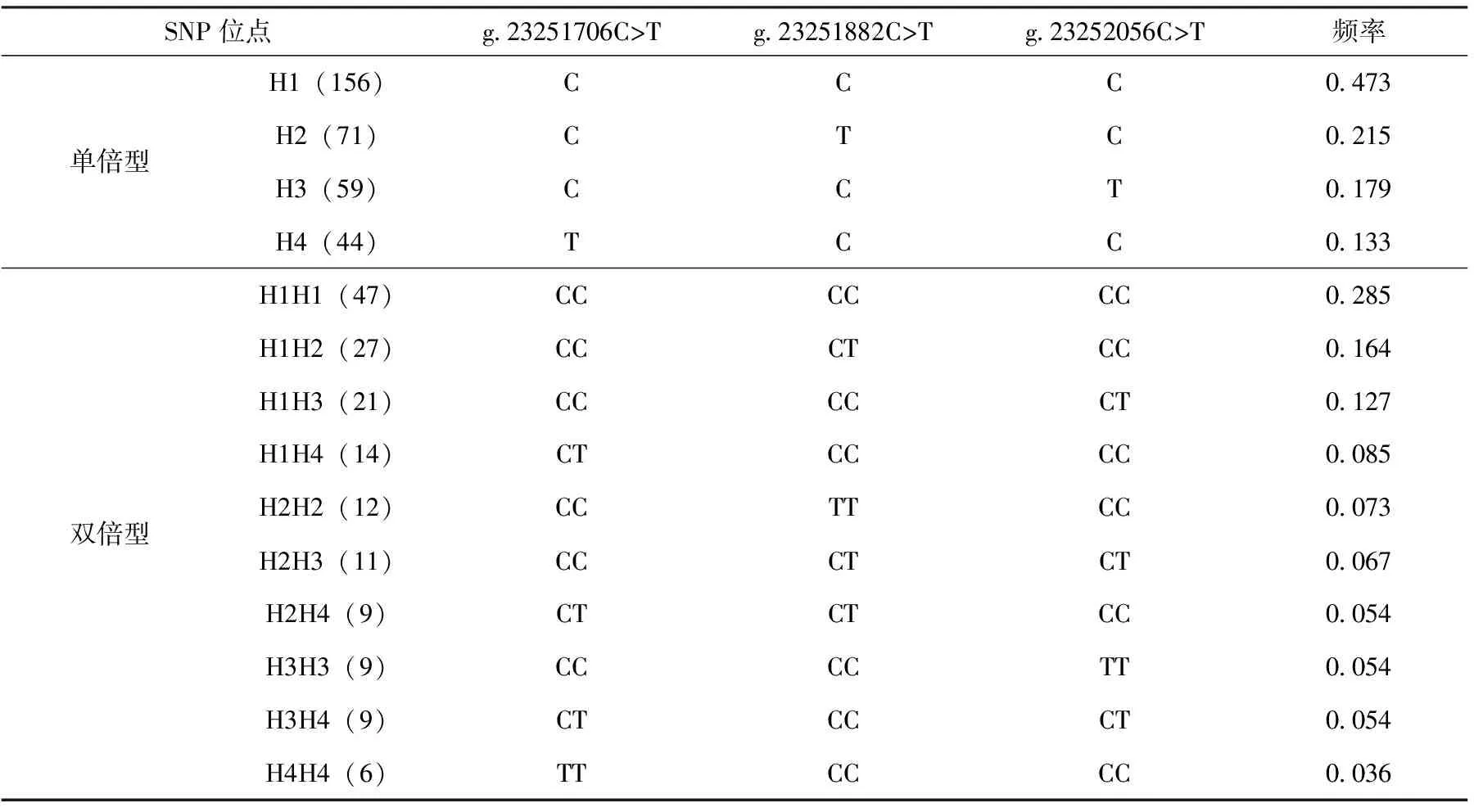
表3 长顺绿壳蛋鸡SFRP5基因外显子1的SNPs的单倍型和双倍型分析
2.4 SNPs与胸肌常规肉质指标的相关性分析
对长顺绿壳蛋鸡SFRP5基因外显子1中发现的3个SNP位点与胸肌常规肉质指标进行关联性分析,结果从表4可知,g.23251706C>T位点对长顺绿壳蛋鸡胸肌蒸煮损失的影响达到显著水平(P<0.05),CC和CT基因型个体显著高于TT基因型个体(P<0.05);g.23252056C>T位点则对失水率的影响达到显著水平(P<0.05),TT基因型个体显著低于CC和CT基因型个体(P<0.05);其他各位点对长顺绿壳蛋鸡胸肌肉质指标的影响未能达到显著性差异(P>0.05)。
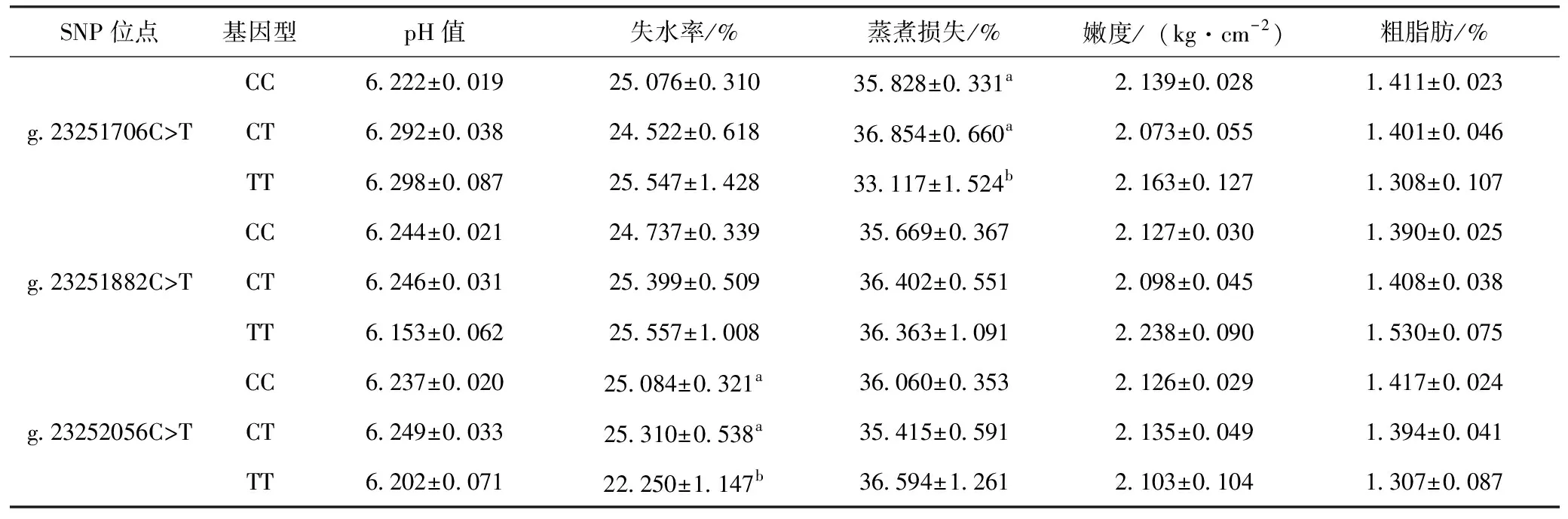
表4 长顺绿壳蛋鸡SFRP5基因外显子1的SNP位点与肉质指标的关联性分析
2.5 SNPs双倍型与胸肌常规肉质指标的相关性分析
对长顺绿壳蛋鸡SFRP5基因外显子1中发现的3个SNP位点组成的双倍型与胸肌常规肉品质指标进行关联性分析,结果从表5可知,双倍型H3H4和H2H4个体的pH值均显著高于双倍型H2H2和H2H3个体(P<0.05),双倍型H3H3个体的失水率显著低于双倍型H1H2、H1H3、H2H3、H2H4和H4H4个体(P<0.05),双倍型H4H4个体的蒸煮损失显著低于双倍型H1H2、H1H4和H2H4个体(P<0.05),双倍型H2H3个体的嫩度显著高于双倍型H2H4个体(P<0.05),双倍型H2H2个体的粗脂肪含量显著高于双倍型H3H3和H4H4个体(P<0.05),共他各指标各双倍型间的差异未达到显著水平(P>0.05)。

表5 SFRP5基因外显子1的SNPs位点双倍型与长顺绿壳蛋鸡常规肉质指标的关联性分析
3 讨论
脂肪是影响畜禽肌肉品质的关键因素,直接影响肉质的滋味、口感和风味,也与肌肉水分含量、失水率、蒸煮损失和嫩度密切相关。通过遗传标记选择具有优良肌肉品质的种质资源群体生产优质肉是当前乃至今天重要的攻关方向。SFRP5在调控生脂基因过程中发挥重要作用,对畜禽肌肉品质有重要影响[17],但报道缺乏。Li等[12]报道藏鸡胸肌、腿肌和脂肪组织中SFRP5 mRNA 表达水与IMF显著相关,揭示SFRP5参与鸡胸肌IMF的沉积。覃媛钰等[14]在长顺绿壳鸡SFRP5基因外显子3中发现2个SNP突变位点:g.23253254 G>A和g.23253269 T>G,g.23253254 G>A位点对胸肌粗脂肪含量有显著影响,2个SNPs位点组成双倍型对胸肌粗脂肪含量的影响达到显著水平,揭示g.23253254 G>A和 g.23253269 T>G变异位点可能作为提高长顺绿壳蛋鸡胸肌脂肪的分子标记。本研究对长顺绿壳蛋鸡SFRP5外显子1的SNP进行检测,发现3个SNP同义突变位点:g.23251706 C>T、g.23251882 C>T和g.23252056 C>T,3个SNP位点的基因型分布均处于Hardy-Weinberg平衡。在任何有限的群体中,基因在配子中的随机分离和在合子里的随机重组都会导致一定的误差,引起基因频率的变化,即随机漂变引起基因频率偏离Hardy-Weinberg平衡[18]。因此,从本研究结果看,3个SNP位点未受到突变、选择、遗传漂变等的影响,或者是受到影响而由于长期的人工选择并进行大规模扩群后又重新处于一种新的平衡状态。
畜禽基因组的变化特别是功能结构基因的突变会影响其生产性能,其SNP变异位点的连锁关系决定群体遗传结构的变化。本研究通过对3个SNP进行连锁不平衡分析,表明SNP间不存在强连锁不平衡,发现4种单倍型和10种双倍型。关联分析表明g.23251706C>T对长顺绿壳蛋鸡胸肌蒸煮损失有显著影响,TT基因型有利于降低蒸煮损失,是有利基因型;g.23252056C>T位点对失水率有显著影响,TT基因型有利于提高肌肉的保水力;3个SNP位点联合组成的双倍型对胸肌的5个常规肉品质指标均有不同程度的影响,H3H4个体的pH值最高,H1H2的失水率最高,H1H4的蒸煮损失最高,H2H3嫩度值最大,H2H2粗脂肪含量最高。综合所有指标在双倍型之间的差异,认为双倍型H2H2是对长顺绿壳蛋鸡肌肉品质最有利的双倍型,3个SNP共同对肉质的影响效应明显大于单个SNP的影响。前人的研究表明,基因碱基突变可能引起构象变化,增加或降低熵值,影响基因的复制速度、转录过程中的剪接过程和蛋白质翻译的速度甚至影响其半衰期[19]。由此推测,本研究发现的3个SNP共同联合引起基因结构变化强于单个SNP对基因结构变化的影响,其对肉质的调控作用可能更有效。但是,在双倍型与肉质性状的关联分析中,部分双倍型个体数还是相对较少,如H2H4、H4H4 、H3H3和H3H4等双倍型个体数不超过10,统计分析结果还需要进一步增加测试样本,进一步验证本研究的结果。同时需进一步在开展该基因变异是否引起构象变化的研究,深入挖掘更有育种价值的SNP位点或单倍型,推动家禽的育种进展。

