鸭疫里氏杆菌OmpA基因真核表达载体构建及免疫效果初步评价
余波,李婷,徐景峨,张亚楠,姜玲玲,周思旋,卜仕金
(1. 扬州大学兽医学院/江苏省动物重要疫病与人畜共患病防控协同创新中心,江苏 扬州 225009;2. 贵州省农科院畜牧兽医研究所,贵州 贵阳 550005)
鸭疫里氏杆菌病是由鸭疫里氏杆菌(Riemerellaanatipestifer,RA)感染引起的一种急性、败血性传染病[1]。鸭、鹅等水禽易通过呼吸道和皮肤伤口途径感染,该细菌通过侵入血液,产生毒素,造成组织器官损伤。细菌的荚膜还能侵染幼龄动物的脑组织,引起神经性症状。RA主要导致的病变特征为肝周炎、气囊炎和纤维素性心包炎,统称为“三炎”,还伴有干酪性输卵管炎、关节炎和脑膜炎等[2-3]。引起雏鸭的发病率和死亡率高,严重危害水禽养殖业的发展[4]。
RA血清型多且各血清型之间缺乏交叉保护,使得不同地区、同一地区的不同时段存在多种血清型或亚型的混合感染[5-6]。目前主要通过地区流行的优势血清型分离株所研制的灭活疫苗来防控RA感染。由于临床长期使用抗生素,致使RA易产生多重耐药性,给该病的防治带来很大困难[7]。鉴于处膜蛋白A(OmpA)在分离的RA菌株间具有高度保守性,不同血清型菌株OmpA蛋白之间存在交叉免疫原性,可制成一种针对多血清型的RA疫苗[8]。本研究旨在构建OmpA真核表达质粒,同时验证其在DF-1细胞中的表达及其对雏鸭的免疫保护效果,为进一步开发和研制RA新型基因工程疫苗奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 试剂
阳性质粒pUC57-OmpA由上海生工生物公司构建;pVAX1真核表达载体由贵州大学动物科学学院鲜思美老师馈赠;DF-1细胞购自丰晖生物公司;DNA胶回收试剂盒、质粒小量提取试剂盒购自OMEGA;DNA Ligation Kit、DNA Marker Ⅲ、DNA限制性内切酶XhoⅠ和BamHⅠ购自TaKaRa;大肠杆菌DH5α、DL2000、HiFiScript cDNA第一链合成试剂盒、无内毒素质粒提取试剂盒均购自天根生化科技;羊抗兔IgG-FITC购自北京博奥森公司。鸭传染性浆膜炎三价灭活疫苗(1型ZJ01株+2型HN01株+7型YC03株)购自齐鲁动物保健品有限公司。HRP标记羊抗鸭IgG购自美国KPL公司。RA抗体阴性雏鸭购自贵州千里山生态食品股份有限公司种鸭场。
1.1.2 兔抗OmpA原核重组蛋白多抗血清的制备
将RAompA基因构建入pET32a+原核表达载体,将重组表达质粒pET32a+-RA -OmpA转化感受态细胞BL21 (DE3)进行诱导表达,IPTG 诱导蛋白表达后,经 12% SDS-PAGE 分析,目标蛋白主要存在于沉淀中为包涵体,将重组蛋白尿素溶液装入透析袋中进行复性,Ni+柱亲和纯化重组蛋白,将纯化好的重组蛋白与弗氏完全佐剂混合,免疫3只新西兰白兔(2~2.5 kg),皮下免疫0.5 mg/次,以后每间隔14 d加强免疫1次,加强免疫使用弗氏不完全佐剂乳化重组蛋白。通过间接ELISA方法检测抗血清对PA OPMA重组蛋白的效价,结果3免后,效价为1∶12 800,采血分离血清制备成多抗血清。
1.2 引物设计及合成
根据GenBank中ompA基因序列,结合pVAX1真核表达载体多克隆位点,利用Primer premier 5.0设计ompA基因的特异性引物。选用XhoⅠ和BamHⅠ作为酶切位点,引物由上海生工生物公司合成,上游引物:5′-GGATCCATGTTGATGACTGGACTTGGT-3′,下划线为XhoⅠ酶识别位点;下游引物:5′-CTCGAGTTATTTTCTTTTCTTTTTTACTACT-3′,下划线为BamHⅠ酶识别位点。
1.3 ompA基因真核表达质粒的构建
将阳性质粒pUC57-OmpA及载体质粒pVAX-1分别经限制性内切酶XhoⅠ和BamHⅠ双酶切,连接后转化DH5α感受态细胞,涂布于含卡那霉素抗性LB平板,37 ℃培养过夜,从转化的卡那霉素 LB平板上挑选单个白色菌落,接种至含卡那霉素的LB液体培养基中培养过夜。采用小量质粒提取试剂盒提取质粒,进行双酶切鉴定,同时以提取重组质粒进行PCR鉴定,将质粒送往上海生工生物有限公司进行序列测定。
1.4 ompA基因真核表达质粒转染DF-1细胞
1.4.1 无内毒素质粒的提取
使用无内毒素质粒提取试剂盒,抽提经鉴定正确的真核表达质粒pVAX1-OmpA和空载体质粒pVAX1测定浓度及纯度,选择OD260与OD280比值为1.8~2.0对应的质粒。
1.4.2 质粒转染DF-1细胞
将DF-1细胞接种于6孔细胞培养板中,用含10%胎牛血清的DMEM营养液培养细胞长至80%~100%单层时,弃掉上清,PBS缓冲液清洗2~3次,按脂质体转染试剂说明书,将重组质粒pVAX1-OmpA和空质粒pVAX1分别转染DF-1细胞,空白组不作任何处理。37 ℃,5% CO2培养箱中培养5 h后更换新的含有5%胎牛血清的DMEM培养液继续培养至48 h。
1.5 RT-PCR方法检测ompA基因在DF-1细胞中的转录
采用RNA提取试剂盒提取细胞总RNA,参照HiFiScript cDNA第一链合成试剂盒说明书,进行cDNA合成。以cDNA为模板,进行PCR 扩增。PCR反应体系为25 μL,取2×PCR MiX 12.5 μL,模板2 μL,上、下游引物(10 mol/μL)各1 μL,ddH2O补至25 μL。PCR反应条件:94 ℃预变性3 min,94 ℃变性45 s,52 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。取6 μL PCR产物于含核酸染料(Gold View)的1.2%琼脂糖凝胶上进行电泳检测。
1.6 间接免疫荧光(IFA)检测ompA基因表达
收集转染后48 h的DF-1细胞,用预冷PBS洗3遍;加入4%多聚甲醛室温固定20 min,弃去固定液,用预冷PBS洗3遍;加入0.3% TritonX-100室温透化20 min,弃去TritonX-100,用预冷PBS洗3遍;加入一抗(兔抗ompA原核表达蛋白血清),37 ℃孵育1 h,弃去一抗,用预冷PBS洗3遍;加入二抗(FITC标记的羊抗兔IgG),37 ℃孵育1 h,弃去二抗,用预冷PBS洗3遍;加入细胞核染料DAPI,室温作用4 min,用预冷PBS洗3遍;于荧光显微镜下观察结果。
1.7 Western blot检测重组蛋白的表达
收集转染后48 h的DF-1细胞进行裂解,12% SDS-PAGE后,转印至PVDF膜,以兔抗OmpA原核表达蛋白血清(1∶500)为一抗,羊抗兔 HRP-IgG(1∶2 000)为二抗,采用ECL显色。
1.8 pVAX1-OmpA DNA疫苗的免疫保护试验
采用无内毒素质粒大提试剂盒提取重组质粒pVAX1-OmpA和pVAX1空质粒,并测定核酸浓度。将1日龄RA抗体阴性健康雏鸭120只饲养至10日龄以适应环境,将其随机分成4组,30只/组,分别为100 μg/只pVAX1-OmpA质粒免疫组、100 μg/只pVAX1质粒空白对照组、0.2 mL灭活疫苗对照组、0.2 mL生理盐水对照组。采用颈部皮下免疫接种,免疫7 d后对雏鸭进行二次免疫。首免疫后7、14、21、28、49、63 d,随机抽取各组10只雏鸭,采血分离血清。
采用间接ELISA检测雏鸭RA抗体,ELISA板每孔包被5 μg OmpA原核表达蛋白,雏鸭血清1∶100稀释,37 ℃孵育1 h,PBS洗3次,加入HRP标记羊抗鸭IgG(1∶2 000),37 ℃孵育45 min,PBS洗涤3次,TMB室温显色15 min,2 mol/L硫酸终止反应,测定OD450值。
攻毒保护试验,对二免后14 d的试验鸭,每组随机抽出10只,采用菌液浓度为4×107CFU/mL(2倍LD50剂量) 1型RA菌悬液菌珠编号为GZSH001,来源于贵州三穗县鸭场,使用RA分型血清鉴定为RA1型、通过腿部肌肉注射接种测定攻毒保护率,观察记录攻毒后1周内的发病或死亡情况。
2 结果
2.1 ompA基因真核表达质粒的构建
通过质粒PCR(图1)、双酶切(图2)及测序鉴定,结果表明ompA基因与pVAX1载体连接正确,ompA基因片段大小约为1 149 bp,将双酶切与测序结果鉴定为阳性的重组真核表达质粒,命名为pVAX1-ompA。
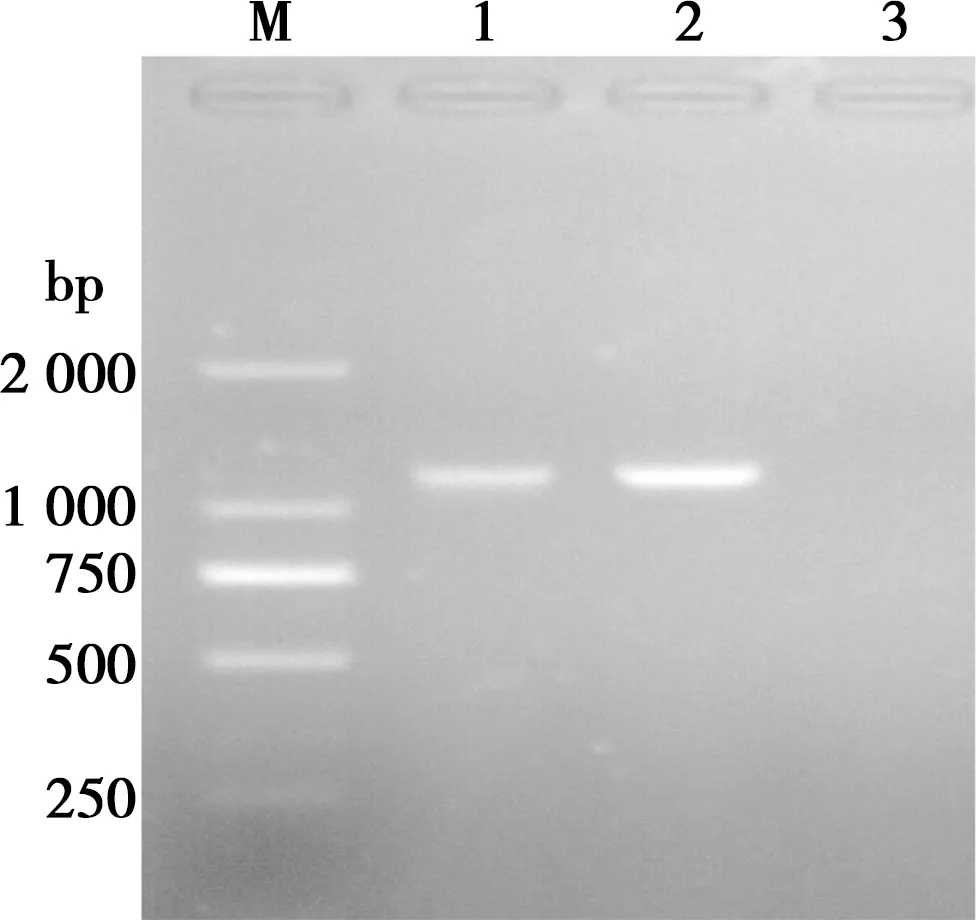
M. DL2000;1~2. pVAX1-OmpA;3. 阴性对照

M. DL5000;1. pVAX1-OmpA;2. pVAX1-OmpA双酶切
2.2 RT-PCR检测真核表达质粒瞬时表达结果
真核表达质粒pVAX1-OmpA和pVAX1转染DF-1细胞48 h后,提取细胞总RNA,通过RT-PCR方法检测到目的基因表达,见图3。
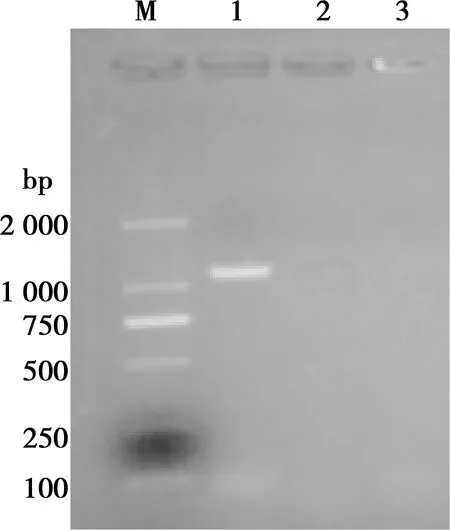
M. DNA Marker D2000;1. pVAX1-OmpA;2. pVAX1,3. 正常细胞对照
2.3 IFA检测真核表达质粒瞬时表达
IFA检测结果显示,真核表达质粒pVAX1-OmpA转染DF-1细胞48 h后,胞浆可见绿色荧光(图4A);pVAX1转染组未见绿色荧光,显示观察视野为黑色(图4B)。
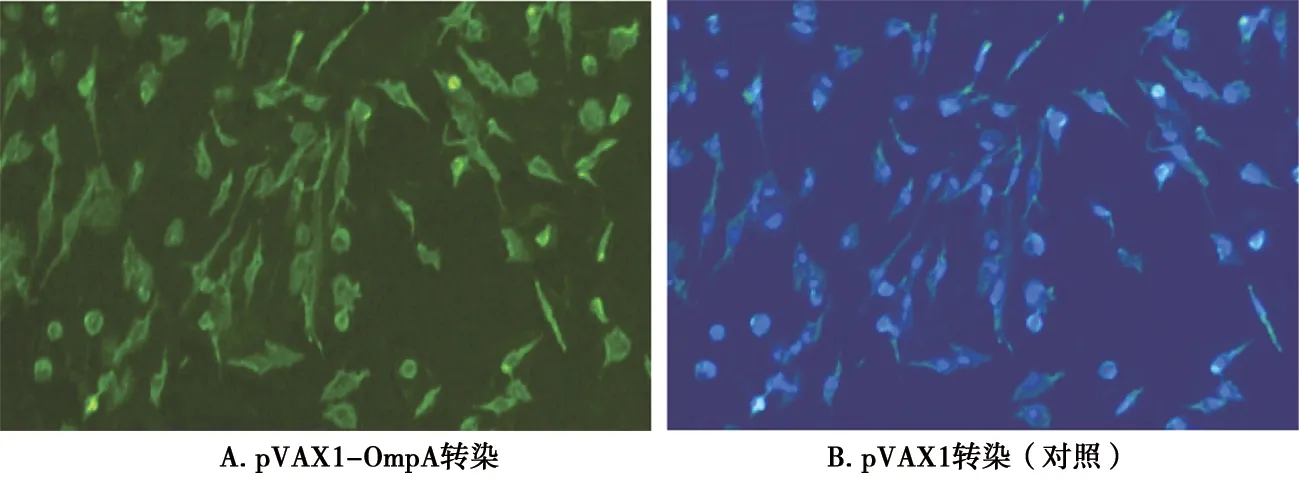
图4 重组质粒转染DF-1细胞后IFA检测结果
2.4 Western blot检测重组蛋白的表达
重组质粒pVAX1-OmpA转染DF-1细胞后48 h,收集细胞裂解后进行Western blot,结果显示细胞转染重组质粒在41 kDa左右出现条带,与预测结果大小一致,而空载体未出现该条带,见图5。
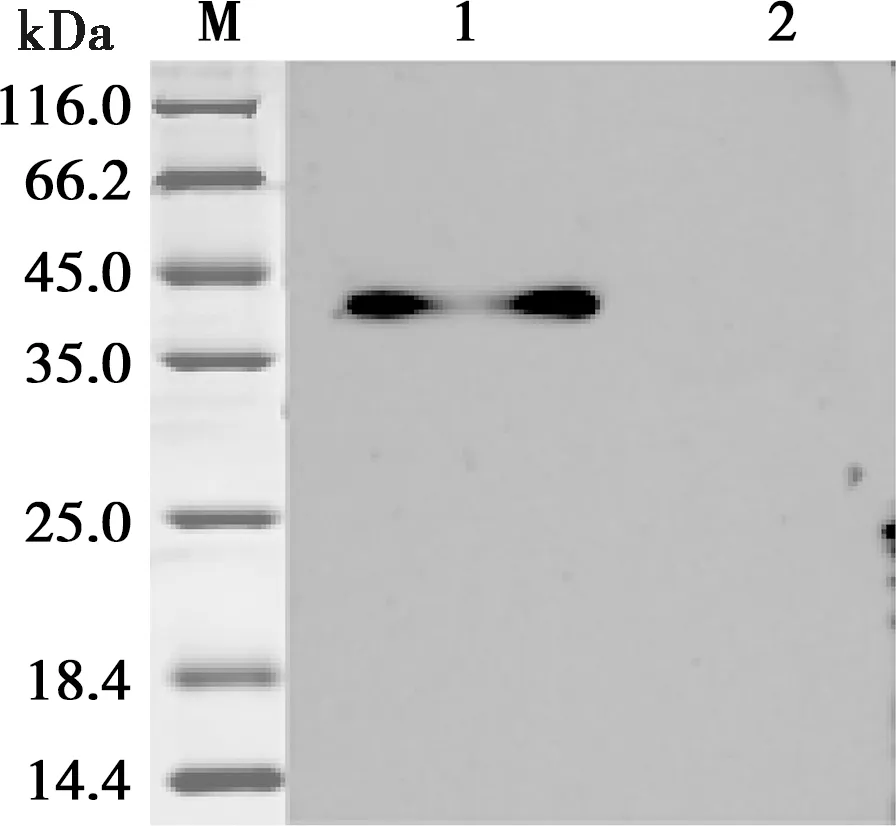
M. 蛋白Marker;1. pVAX1-OmpA转染DF-1细胞;2. pVAX1空载体转染DF-1细胞
2.5 pVAX1-OmpA DNA疫苗对雏鸭感染RA的保护试验
以100 μg/只重组质粒pVAX1-OmpA采用颈部皮下免疫接种,免疫7 d后对雏鸭进行二次免疫,用间接ELISA法检测免疫后RA抗体水平。结果,重组质粒pVAX1-OmpA试验组于7 d、21 d极显著(P<0.01)或显著(P<0.05)低于灭活疫苗对照组,而14、28、35、49、63 d差异不显著,见图6。
攻毒后7 d内的发病或死亡情况结果显示,重组质粒pVAX1-OmpA试验组21 d保护率达100%,灭活疫苗对照组21 d保护率达90%,pVAX1空载体对照和生理盐水对照组21 d保护率均为10%,见图7。
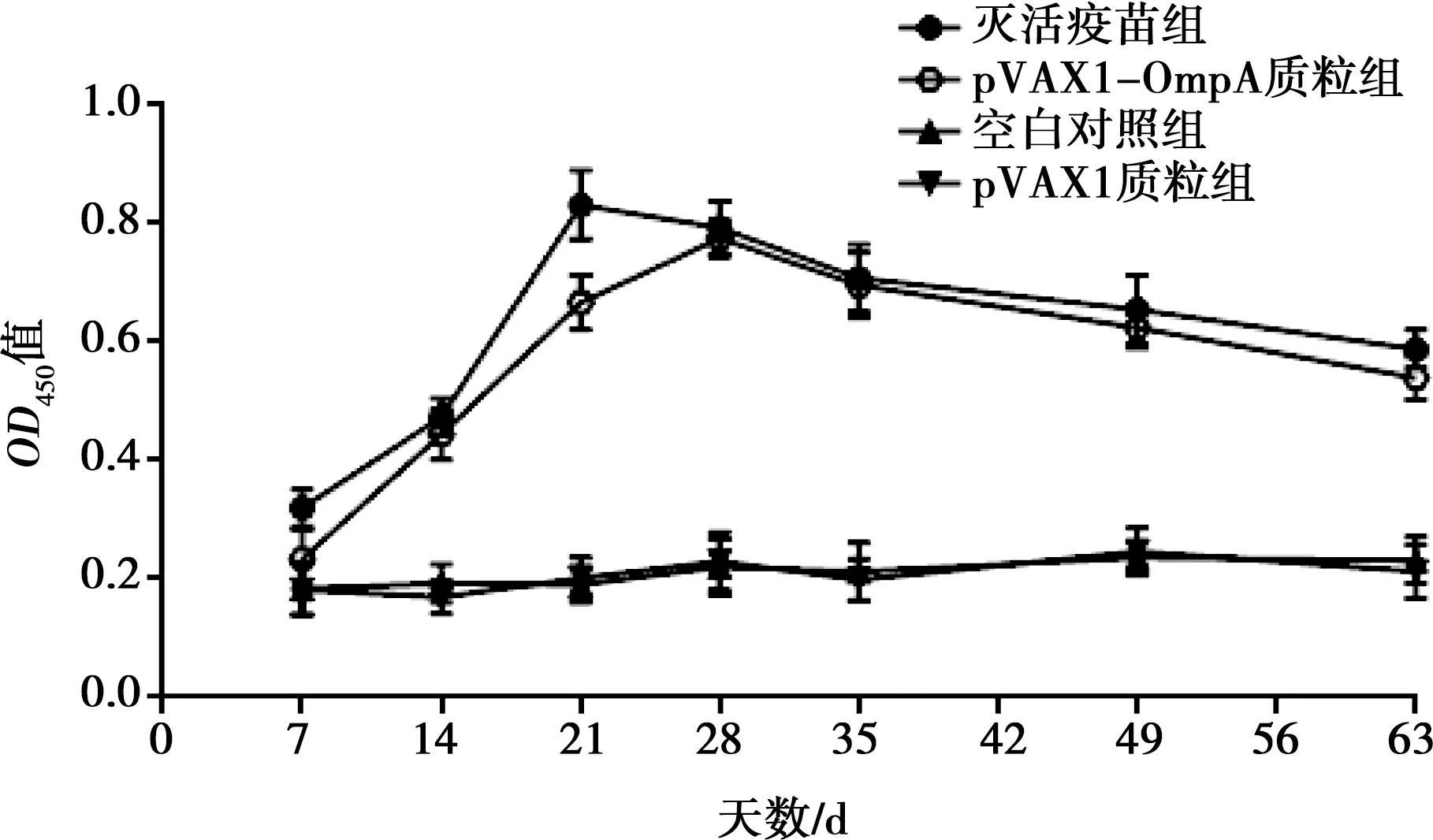
图6 不同免疫组抗体动态变化
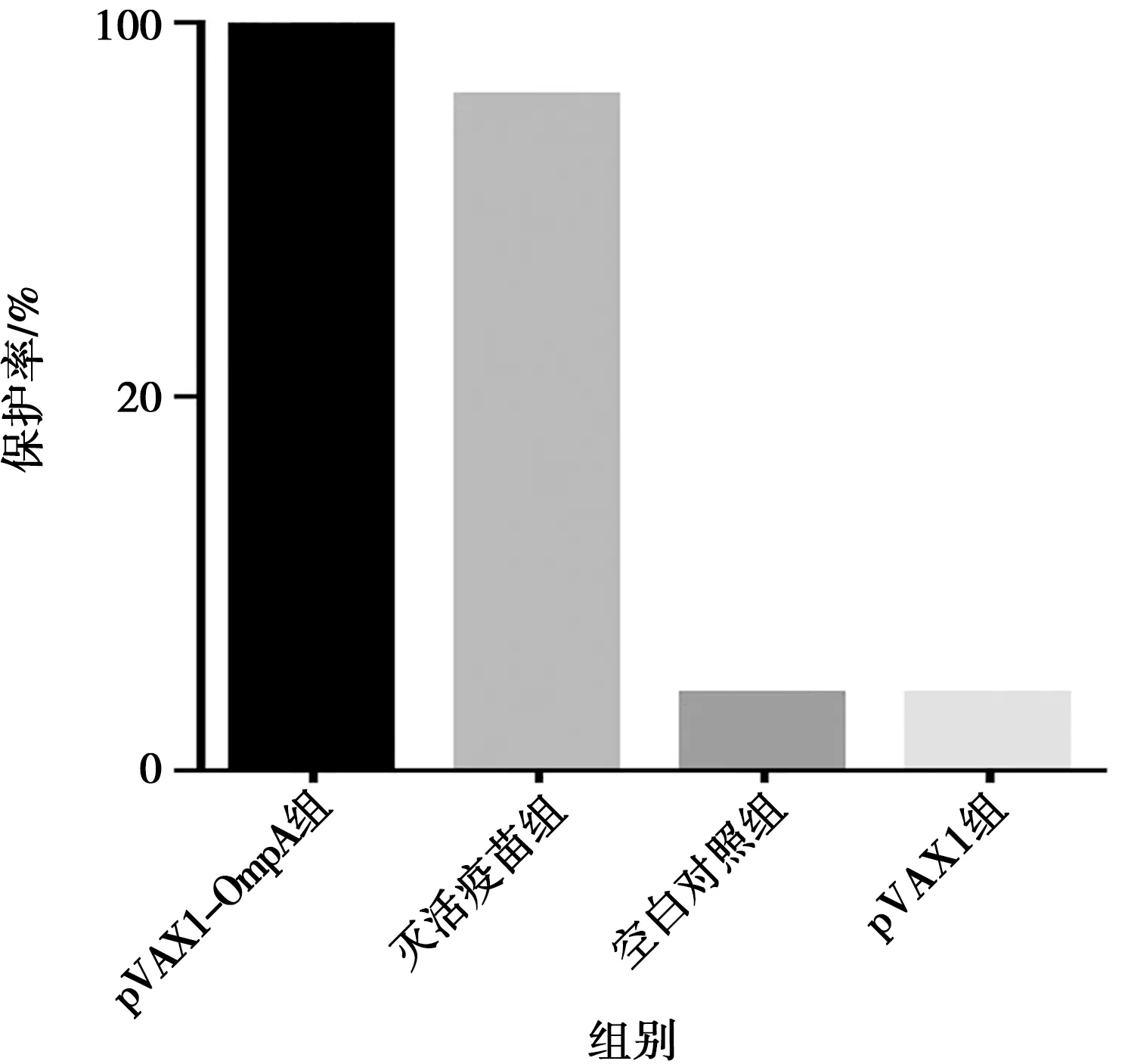
图7 雏鸭21 d攻毒保护试验结果
3 讨论
目前国内外学者均致力于研究出一种对各血清型RA均有保护作用的新型有效疫苗,其中DNA疫苗是较为理想的发展方向。DNA疫苗不仅可同时诱导体液与细胞免疫应答,产生持久性免疫应答,还能交叉保护不同血清型,具有易生产,稳定性强,贮存、运输方便等优点[9]。DNA疫苗研制的关键在于靶基因序列与表达载体的选择,选择一种或几种具有交叉保护性的抗原成分能提供更全面的保护[10]。OmpA作为RA的主要外膜蛋白,其基因序列高度保守,具有良好的免疫原性,不仅能激发特异性体液免疫和细胞毒性反应,辅助其他抗原交叉提呈,提高机体的免疫应答水平,且能对不同血清型RA起到免疫交叉保护的作用,是RA核酸疫苗研制的首选靶基因[11]。雷云[12]成功构建了ompA基因真核表达质粒pcDNA3.1(+)-OmpA,免疫雏鸭后证实该真核表达质粒能刺激鸭体内产生RA特异性抗体,对血清1型和2型RA均有一定的免疫保护作用。
真核表达质粒诱发机体产生的免疫效果与质粒载体表达抗原蛋白的能力呈正相关,因此构建DNA疫苗还应选择高效的质粒表达载体[13]。pVAX1作为哺乳动物细胞表达系统中高效表达目的基因的表达载体,大小为3.0 kb,是基于pcDNA3.1上重建得到的新型真核表达载体,用卡那抗性代替安苄抗性筛选基因,能有效降低人类基因组重组的可能,且pVAX1载体为非融合载体,其产生的蛋白在结构和功能上与天然存在的蛋白质几乎相同[14]。由于具有BGH poly A信号和强大的人巨细胞病毒启动子(CMV),表达容量大,分子量小等优点,pVAX1作为真核表达载体已用于构建多种传染病或寄生虫病的重组核酸疫苗[15]。龚丽贞等[16]构建了重组质粒pVAX1-Cal-SAG1和pVAX1-SAG1,免疫小鼠后,通过ELISA、CCK-8法和小鼠攻虫试验证明该DNA疫苗能够诱导小鼠机体产生体液和细胞免疫。张真等[17]构建重组质粒pVAX1-Hsp65-Ag85B和PVAX1-Hsp65-ESAT6,经体外转染验证其表达后,免疫小鼠证实均可激发较强的免疫反应。
本研究选择pVAX1作为真核表达载体,成功构建了ompA基因的真核表达质粒pVAX1-OmpA,通过脂质体转染至DF-1细胞,采用RT-PCR、IFA、Western blot试验证实了真核表达质粒pVAX1-OmpA能在DF-1细胞中瞬时表达。同时IFA试验中pVAX1-OmpA真核表达蛋白能够被OmpA基因原核表达蛋白免疫兔得到的多抗所识别,结合羊抗兔IgG-FITC,在细胞胞浆显示出绿色荧光,Western blot结果也显示重组质粒转染细胞后在41 kDa左右出现条带,表明该真核表达蛋白成功表达。对雏鸭感染RA的保护试验中,重组质粒pVAX1-OmpA组诱导体液免疫水平在28 d后与灭活疫苗组相当,而攻毒试验结果表明重组质粒pVAX1-OmpA组免疫21 d后可为雏鸭提供高于灭活疫苗组的免疫保护效果,这可能与该DNA疫苗同时产生细胞免疫有关。在后续研究中,需要测定细胞免疫水平,以研究其体液免疫和细胞免疫与RA攻毒保护率的相关性,以及探讨联合应用免疫增强剂以提高其体液免疫水平,以期能更好地对候选重组DNA疫苗进行全面的免疫效果评价。

