外源硼元素对喀斯特地貌先锋植物黄褐毛忍冬LfMYB基因表达的影响
蒋向辉,肖龙骞
(1 怀化学院 生物与食品工程学院,湖南怀化 418008;2 怀化学院 民族药用植物资源研究与利用湖南省重点实验室,湖南怀化 418008;3 怀化学院 湘西药用植物与民族植物学湖南省高校重点实验室,湖南怀化 418008)
黄褐毛忍冬(LonicerafulvotomentosaHsu et S. C. Cheng)为忍冬科忍冬属植物,主产于中国西南部的云南、贵州和广西等省[1],是喀斯特地貌地区重要的先锋植物,其花蕾或初开的花在民间被作为金银花原料使用,2015年版药典将其归属于山银花一类[2]。黄褐毛忍冬的花中主要含有绿原酸、皂苷类、醇类、酯类和类黄酮等多种化合物[3],其花蕾被广泛用于治疗关节炎、感冒、肠炎、发热、感染、疼痛和溃疡等疾病,特别是其中的类黄酮具有同时可以抑制HIV蛋白酶和HIV整合酶的双重抑制活性[4],有望开发出治疗抗逆转录病毒的先导化合物。中国喀斯特土壤肥力低、偏碱性和钙元素含量高[5],生态系统生产力低,在这一特定地理条件下孕育的黄褐毛忍冬具有耐矿质元素胁迫、耐旱和耐贫瘠等特有的生理代谢机制,进行黄褐毛忍冬响应非生物胁迫逆境生理机制的研究,对于中国西部地区喀斯特地貌的修复和特色药用植物的开发利用有十分重要的意义。
硼(B)是植物必需的一种独特的非金属微量元素,植物整个生命周期一直需要B。喀斯特土壤中的B主要以硼酸的形式存在,由于硼酸的高溶解性而易于被降雨溶出,所以喀斯特土壤中B元素含量较低。中国西南部、印度西北部、尼泊尔、日本、孟加拉国和巴西等地区是缺B危害最大的地区。但土壤中B缺乏和过量之间的范围很窄[6],Sun等[7]认为0.5~2.0 mg/kg是植物所需要的土壤中B含量的最佳范围,土壤中较低或较高的B含量将导致植物表现B缺乏或B过量胁迫,在不需要B的土壤中施加高比例的B将会导致植物发生B毒性而降低产量。植物非生物逆境胁迫相关基因的表达水平受转录因子的调节,包括MYB、bHLH和WDR等转录因子[8]。植物中大多数MYB蛋白属于R2R3-MYB亚家族,已有研究表明该亚家族的成员参与植物干旱和盐胁迫等非生物胁迫的基因表达调控[9]。
本研究在喀斯特土壤中对黄褐毛忍冬进行不同浓度的施加B肥处理,监测黄褐毛忍冬不同部位B元素含量变化及LfMYB表达量变化,研究黄褐毛忍冬LfMYB转录因子表达量与B浓度之间的关系,解析黄褐毛忍冬响应非生物胁迫逆境的生理机制,为中国西部地区喀斯特地貌的修复和特色药用植物的开发利用提供参考。
1 材料和方法
1.1 材 料
本实验中的黄褐毛忍冬采自贵州省兴义市安龙镇,经湖南省林业科学研究院王旭军研究员鉴定为忍冬属植物黄褐毛忍冬。
1.2 方 法
1.2.1 黄褐毛忍冬不同土壤栽培处理收集喀斯特土壤表层20 cm处的土壤,置80 ℃烘箱2 d烘干,过8 mm筛后,将此基质分成两份,一份直接用于栽培黄褐毛忍冬,另一份加1/3重量的腐化牛粪后再用于栽培黄褐毛忍冬,于开花期收集不同栽培条件下的黄褐毛忍冬顶端幼叶进行转录组差异分析,筛选表达量差异显著(P<0.05)的MYB基因序列。于开花前一个月开始,对喀斯特土壤基质下栽培的黄褐毛忍冬进行0.25、1.0 和2.5 mg/L不同浓度B的叶面喷施处理,每株喷施300 mL溶液,隔10 d喷1次,3次喷完。采用 ICP 等离子体原子发射光谱仪(Agilent 7500CE)测定土壤硼(B)元素含量。
1.2.2LfMYB全长CDS克隆与生物信息学分析分别采集喀斯特土壤基质和加牛粪基质下种植的黄褐毛忍冬顶端幼叶进行转录组差异分析,获得差异表达的MYB片段序列,采用RACE克隆的方法克隆MYB全长CDS序列。通过https://www.expasy.org/proteomics网站进行蛋白质理化性质分析,通过https://prosite.expasy.org网站进行蛋白功能结构域预测。通过http://kinasephos2.mbc.nctu.edu.tw网站进行蛋白磷酸化位点预测。
1.2.3LfMYB原核表达活性分析构建原核表达质粒pCold-LfMYB转化大肠杆菌BL21,采用不同浓度的IPTG进行BL21诱导培养,充分收取菌液,经超声破碎后吸上清,采用镍柱纯化法获得重组蛋白,对融合蛋白采用考马斯亮兰染色的方法进行检测。
1.2.4 LfMYB转录活性验证参照Wang等[10]方法进行LfMYB反式转录激活实验,转录因子LfMYB的全长CDS克隆进pGBKT7载体得到 pBD-LfMYB质粒,同时分别以pBD 为阴性载体、pGAL4为阳性载体,采用乙酰酸锂介导的方法将诱饵质粒转入质粒转化酵母菌YGR-2细胞,涂布于营养缺失的培养基(SD/-Trp)培养2 d,然后将阳性克隆转移到加有10 mmol/L 3-AT的SD/-Trp-His-Ade平板上生长,在30 ℃下培养3 d后统计生长情况,检验转录因子的激活活性。
1.2.5LfMYB表达量检测与B含量检测采用Invitrogen公司的TRizol 试剂盒分别提取不同浓度B处理后的黄褐毛忍冬不同器官总RNA,参照杨总应等方法[11]逆转录成cDNA后,进行实时荧光定量PCR(qPCR)检测,以actin基因为内参,引物为actin-F(5′-ATGATGCTCCCAGGGCAGTTT-3′)和actin-R(5′-TCCATGTCATCCCAGTTGCTG-3′)。LfMYB基因表达的定量PCR引物为LfMYB-Q-F (5′-CTGACTTAAAGAGCGGCAATA-3′)和LfMYB-Q-R(5′-GGAAGCGGTGGTTTAGTTT-3′)。应用比较Ct值法测定LfMYB相对表达量。参照蒋向辉等[12]采用原子吸收光谱仪法测定相应器官中B含量。
2 结果与分析
2.1 LfMYB 全长CDS克隆与生物信息学分析
对不同栽培条件下的黄褐毛忍冬顶端幼叶进行转录组测序,使用Trinity软件拼接得到78个MYB基因相关的重叠群(contigs),从中筛选出一个460 bp的差异表达片段,采用RACE克隆的方法成功获得了黄褐毛忍冬MYB全长CDS序列(将其命名为LfMYB),LfMYB编码序列为1 005 bp(图1),可编码334个氨基酸残基,GenBank登录号为MT424590。系统发育分析表明,LfMYB与忍冬属其他MYB成员聚集成一个进化枝(图2)。LfMYB蛋白质的分子量和等电点分别为37.92 kD和5.05。结构域预测显示,LfMYB编码序列与LjaMYB12序列相似度为97.6%(图3),在氨基末端有3个MYB重复。与NCBI数据库中获得的多个MYB转录因子序列比对显示,LfMYB具有与MYB亚组R2R3转录因子相同的保守的R2R3结构域。经磷酸化位点预测,LfMYB有 9 个氨基酸位点可被蛋白激酶C(PKC)磷酸化,其中 5 个位点位于转录激活区内。

1.M. DL5000;1~3分别为5′-RACE第一轮PCR产物、第二轮PCR产物和第二轮PCR空白对照;B. 4~6分别为3′-RACE第一轮PCR产物、第二轮PCR产物和第二轮PCR空白对照图1 LfMYB基因5′-RACE(A)和3′-RACE(B) PCR产物电泳检测M. DL5000;A. 1-3 5′-RACE first round PCR products, second round PCR products and second round blank control; B. 4-6 3′-RACE first round PCR products, second round PCR products and second round blank controlFig.1 5′-RACE(A) and 3′-RACE(B) PCR products of LfMYB checked by electrophoresis

图2 基于邻接法构建的不同物种LfMYB基因聚类树Fig.2 Phylogenetic clustering of LfMYB in different species based on Neighbor Joining method
2.2 LfMYB原核表达活性分析
利用大肠杆菌BL21对LfMYB所编码蛋白进行了原核表达,采用不同浓度的IPTG诱导后,通过镍柱纯化的方法得到了可溶性重组蛋白,融合蛋白进行SDS-PAGE电泳,并用考马斯亮蓝染色。结果显示pCOLD-LfMYB重组蛋白经0.2、0.4和0.8 mmol/L IPTG诱导后都能表达,蛋白大小为75 kD左右(图4),而Pcold TF空载未见有相应大小的蛋白表达,大肠杆菌 BL21空菌经不同浓度的IPTG诱导后也未见有相应大小的蛋白表达。
2.3 LfMYB转录活性验证
LfMYB转录活性检测结果如图5所示,转化质粒pBD-LfMYB、pGAL4(阳性对照)和pBD(阴性对照)的酵母在SD/-Trp+3AT培养基上均能生长,但在SD/-Trp-His-Ade+3AT的平板仅转化有质粒pBD-LfMYB和pGAL4的酵母能生长,而转化质粒pBD的酵母不能生长(图5),这表明 LfMYB在酵母中能够正确转录和翻译,且能够激活报告基因的转录和翻译,这表明LfMYB有自激活活性。

图3 LfMYB与LjaMYB12基因序列相似性比较Fig.3 Comparison of sequence similarity between LfMYB and LjaMYB12
2.4 LfMYB表达量与B含量检测
喀斯特土壤基质中B元素的含量为0.962 mg/kg,含量低于Muran等[13]认为的能引起植物B胁迫的水平临界值2.0 mg/kg。黄褐毛忍冬经不同浓度B处理后对不同部位LfMYB进行qRT-PCR检测结果如表1,结果表明LfMYB在老叶、白花和黄花中表达量明显高于其他部位,而幼茎和幼叶中表达量相对较低。在喀斯特土壤基质中添加中浓度B导致黄褐毛忍冬不同部位LfMYB表达量均有提高,其中以老叶、白花和黄花提高最明显(P<0.05),但当施加高浓度B(2.5 mg/L)时,各部位LfMYB表达量均明显降低,而以幼叶、幼茎和绿蕾降低最为明显(P<0.05)。黄褐毛忍冬经不同浓度B处理后,检测不同部位B含量结果如图6所示,结果显示B主要积累在黄褐毛忍冬的老叶和茎中,且随着施加B浓度升高,黄褐毛忍冬的各部位B含量随之升高,其中以幼叶、老叶和幼茎中B含量升高最为明显(P<0.05)。综上所述,在喀斯特土壤基质中施加一定浓度范围的B元素时,随着B元素浓度增加,黄褐毛忍冬各部位LfMYB表达量随之增加;当施加B元素达到中浓度(1.0 mg/L)时,LfMYB在老叶、白花和黄花中表达量增加更明显;但是,随着B元素浓度的继续增加,黄褐毛忍冬各部位LfMYB表达量反而减少,其中在幼叶、幼茎和绿蕾中LfMYB表达量降低达到显著水平。

1. 空白对照;2. 阳性对照;3~ 5表分别表示经0.2、0.4和0.8 mmol/L IPTG诱导后的重组蛋白;6~ 8分别表示经0.2、0.4和0.8 mmol/L IPTG诱导后的Pcold TF蛋白(空载);9~ 11分别表示经0.2、0.4和0.8 mmol/LIPTG诱导后的E.coli BL21(空菌)图4 LfMYB原核表达产物SDS-PAGE检测1. Blank control; 2. Positive control; 3-5. Recombinant protein (induction by IPTG of 0.2, 0.4, and 0.8 mmol/L, respectively); 6-8. Pcold TF protein (no load) induced by IPTG of 0.2, 0.4 and 0.8 mmol/L, respectively; 9-11. E. coli BL21 (empty bacteria) induced by IPTG of 0.2, 0.4 and 0.8 mmol/L, respectively)Fig.4 SDS-PAGE detection of LfMYB prokaryotic expression product

图5 pBD-LfMYB自激活活性分析Fig.5 pBD-LfMYB autonomous activation analysis

表1 施加不同浓度B元素对黄褐毛忍冬各器官LfMYB表达量的影响
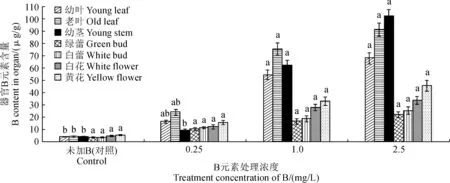
同类型器官不同小写字母表示差异达显著水平(P<0.05)图6 不同浓度B处理后黄褐毛忍冬不同器官中B元素含量Different normal letters in the same organ indicate significant difference at 0. 05 levelFig.6 B element content in different organs of L. fulvotomentosa treated by different concentrations of B
3 讨 论
本研究从黄褐毛忍冬中分离出了一个编码基因LfMYB,系统发育分析和保守序列分析表明LfMYB属于MYB,反式激活分析表明LfMYB是转录激活因子,LfMYB基因序列与LjaMYB12序列相似度为97.6%。Qi等[9]研究表明LjaMYB12的转录水平与金银花发育过程中的总黄酮含量成正比,认为LjaMYB12是植物中的黄酮醇特异性调节因子。本研究结果显示,黄褐毛忍冬LfMYB在老叶、白花和黄花表达量明显高于其他部位。黄褐毛忍冬是忍冬科中最重要的变种之一,它具有与金银花相似的化学组成和药理作用[14]。虽然,LfMYB基因序列与LjaMYB12序列相似度极高,但转录因子在不同植物中作用的靶基因具有明显的特异性,Nakatsuka等[15]研究发现转录因子GtMYBP3在拟南芥中过表达可以增加黄酮醇的积累,而在烟草中过表达时却未观察到黄酮醇含量的明显变化。LUO等[16]研究发现转录因子AtMYB12在番茄中异源表达时,可以调控PAL、CHS和GT基因表达量呈现超过100倍的增加,C4H、4CL和HQT基因表达量呈现出3~10倍的增加。ZHAO等[17]研究发现LjaMYB12在拟南芥中过表达能促进PAL、F3H、FNS、CHS和CHI等黄酮生物合成基因的表达上调。STRACKE等[18]研究认为,同一亚组的转录因子通常表现出相似的调节功能,但LfMYB与LjaMYB12是否属于同一亚组,这还有待进一步确认。因此,LfMYB在白花和黄花中的特异性表达对下游基因的调控特性是否与LjaMYB12相似,是否与其黄酮类药用成分的合成紧密相关,这还有待对黄褐毛忍冬中黄酮类药用成分合成相关基因的定量PCR检测与黄酮类成分的含量测定。
本研究结果显示在喀斯特土壤基质中施加一定量的B元素可促进LfMYB的表达量增加,而过量的B元素则抑制LfMYB的表达,这种抑制作用在幼叶、幼茎和绿蕾中最显著,这在另一个方面进一步证实了Gupta等[19]提出的B元素主要参与植物细胞分裂、开花和座果等代谢活动的观点。
Li等[20]研究认为B对类黄酮等成分合成影响极为明显。本研究结果显示,黄褐毛忍冬在B胁迫的条件下,过量的B主要积累在老叶、白花和黄花中,而白花和黄花是黄褐毛忍冬的主要药用部位。并且,另有研究表明,植物的生殖生长对硼缺乏的反应比营养生长更敏感,直接影响植物的开花与座果,特别是对类黄酮的合成与转运的影响极为明显[18]。因此,对喀斯特高钙、缺硼生境下的黄褐毛忍冬合理追施B肥,这是提高黄褐毛忍冬药材的产量和质量的有效措施。已有研究表明在植物中Ca或B的缺乏或过量会影响另一种元素的营养状况[21],因此,研究喀斯特高钙生境下黄褐毛忍冬对B吸收利用的分子机理,将为黄褐毛忍冬施加B肥的栽培措施提供很好的参考。
忍冬属药用植物中含有黄芩素、槲皮素、芦丁、二羟黄酮、山柰酚、槲皮素和杨梅素等多种类黄酮化合物[20]。类黄酮化合物含量是评估忍冬属植物药材质量的重要指标。近年来在忍冬属药用植物中有关黄酮醇、黄烷醇和花色苷等类黄酮化合物生物合成途径的研究越来越多,类黄酮生物合成途径相关结构基因的转录调控受生物与非生物因素协同作用[22]。植物中大多数MYB蛋白属于R2R3-MYB亚家族,已有研究表明该亚家族的成员参与干旱和盐胁迫等非生物胁迫的调控[9]。本研究结果显示,LfMYB是属于R2R3 MYB转录因子家族的转录激活因子,对其进行B胁迫下类黄酮代谢调控机理研究,将为黄褐毛忍冬矿质营养的改良和类黄酮代谢调控奠定重要的理论和实验基础。
————水溶蚀岩石的奇观

