苹果MAX1基因的克隆和表达及启动子分析
高馨怡,陈 皓,程 方,常兴敏,孙怡婷,谢玲玲,马娟娟
(西北农林科技大学 园艺学院,陕西杨陵 712100)
独角金内酯(strigolactones/SLs)因能诱导根寄生植物种子萌发和丛枝菌根真菌(AMF)菌丝分枝而受关注和研究[1],2008年被判定为第七大类植物激素,SLs作为植物激素首先被研究的功能与植物分枝相关[2-3]。分枝是植物株型重要构成方面之一,影响着植株对光照和养分等资源的获取[4]。植物分枝受激素、营养、发育阶段、环境因素及其之间复杂相互作用的调节[5-6]。生长素(吲哚-3-乙酸,IAAs)、细胞分裂素(CTKs)和SLs是控制分枝的重要激素,由类胡萝卜素类物质产生的SLs可能作为生长素第二信使参与分枝生长[7]。
豌豆中的rms1/5(ramosus)突变体、水稻中d10/17(dwarf)突变体、拟南芥中的max3/4(moreaxillarygrowth)突变体均具有多分枝表型,液相串联质谱测定后为SLs缺失型,外源施用SLs能抑制其分枝的产生[2-3],相互嫁接试验证明SLs能从根部合成并向上运输到芽进而抑制腋芽的生长[8]。
目前SLs的生物合成途径尚不完全清楚,但拟南芥中至少有5种酶的参与。DWARF27(D27)、MAX3、MAX4、MAX1和LATERALBRANCHINGOXIDASE(LBO)分别编码类胡萝卜素异构酶、类胡萝卜素裂解双加氧酶 7(CCD7)、类胡萝卜素裂解双加氧酶 8(CCD8)、细胞色素P450单加氧酶和侧枝双加氧酶[9-12]。D27、CCD7和CCD8等3种酶依次将β-胡萝卜素转化为己内酯(carlactone,CL)。拟南芥MAX1/CYP711A1将CL转化为己内酯酸(carlactonoic acid,CLA)[11],水稻中有5个MAX1的同源基因,其中编码产物Os900/CYP711A2将CL转化为 4- deoxyorobanchol (4DO),Os1400/CYP711A3将4DO转化为列当醇(orobanchol)[13]。MAX1s根据催化产物的不同分为3种类型:A1型,催化CL产生CLA;A2型,催化CL产生4DO;A3型,催化CL产生列当醇;不同物种中MAX1保守功能是催化CL产生CLA[14]。
SLs在分枝调控中具有重要作用,MAX3/4已被证明对苹果分枝有影响[15]。苹果是一种世界各地广泛栽培的果树,具有重要的经济价值。保持理想的分枝构型,以最大限度利用光能是提高产量的关键因素之一,因此,研究苹果腋芽分枝生长相关基因对苹果育种具有重要意义。拟南芥max1突变体具有多分枝表型,矮牵牛、水稻、杨树、番茄和油菜的MAX1同源基因均被证明具有控制分枝功能[16-21]。为此,本研究鉴定了苹果MAX1的同源基因,并进行了系统分析及研究,为将来进一步研究苹果MAX1参与SLs合成调控苹果分枝的功能提供依据。
1 材料和方法
1.1 实验材料
‘长富2号’/T337/八棱海棠(MalusrobustaRehd.)嫁接苗于陕西省杨陵区西北农林科技大学武功站实验苗圃(34°52′N,108°7′E)进行种植和管理,种植间距为50 cm×25 cm。基因克隆采样部位为腋芽;不同节位的腋芽自顶芽以下依次编号1~6。组织特异性采样部位为根(八棱海棠砧木所有根系混样)、茎(靠近生长点处,粗度达到3~4 mm左右)、顶梢(生长点1~2 cm处)、叶和腋芽(不同节位腋芽混样),开放花(盛花期)和幼果(直径约1 cm左右)采集于5年生‘长富2号’/T337/八棱海棠苹果树。
5周龄本氏烟草(Nicotianabenthamiana)种植于西北农林科技大学园艺学院实验室培养箱。
1.2 实验方法
1.2.1 MdMAX1的鉴定与系统发育分析采用同源比对法,以拟南芥MAX1(AtMAX1)蛋白序列为参照通过GDR(www.rosaceae.org)blastp寻找苹果同源序列。利用2个单子叶植物和7个双子叶植物MAX1蛋白序列,使用MEGA 5.0软件构建系统发育树,构建参数为邻接树法,p-distance、Bootstrap=1 000。
1.2.2 保守motif分析将构建系统发育树所用的MAX1蛋白质序列提交到MEME(http://meme-suite. org/tools/meme),并将motifs的参数设置为15。
1.2.3 基因克隆和实时荧光定量PCR将‘长富2号’嫁接苗不同组织(根、茎、开放花、幼果、顶芽、叶、腋芽)及不同节位腋芽分别提取总RNA。使用SYBR Prime Script RT-PCR Kit Ⅱ (TaKaRa, 中国上海)进行反转录。利用腋芽cDNA进行MAX1的克隆,利用Primer 6.0软件设计引物,CDS克隆引物为MdMAX1F(ATGAAGAGCTTGGAAGA-AGAG)和MdMAX1R(TGTCCTCTTTATGAC-TCTAAGCTT);定量引物为MdMAX1r-F(TCT-CGGACTTCATCAACCAACACA)和MdMAX1r-R(GCATTCGCTTCGCCACAATACC),以苹果Actin为内参基因,使用2×Fast qPCR Master Mixture Green(DiNing, 中国北京)进行实时荧光定量PCR。
1.2.4 RNA-seq表达分析苹果‘长富2号’嫁接苗 6-BA处理腋芽和海棠‘bly114’(Malusspectabilis)(WT)及其多分枝突变体(MB)腋芽的RNA-seq数据库来自本实验室已有数据[22-23],其中海棠‘bly114’及其多分枝突变体引种自青岛市农业科学院。RNA-seq表达量基于RPKM(reads per kilo bases per million reads)数值。
1.2.5MdMAX1启动子的克隆与序列分析利用GDR网站的contig MDP0000130133序列设计引物,以‘长富2号’叶片DNA为模板克隆MdMAX1 ATG前的1 500 bp序列,并将克隆得到的启动子序列提交至PlantCARE进行顺式作用元件的分析。启动子区段克隆引物为MdMAX1p-F(TAGTTTTAAGAACACCATCCATAA)和MdMAX1p-R(ATGAATGATTTCAATTGTGGAA-AT)。
1.2.6MdMAX1启动子活性分析采用同源重组法将MdMAX1 1 500 bp启动子序列连接到pCAMBIA1381-GUS载体。通过农杆菌EHA105介导,侵染5周龄本氏烟草,GUS染色后进行启动子活性分析[24]。为了解启动子活性是否受激素和光照等处理影响,用20 μmol/L GR24(独脚金内酯类似物)、100 μmol/L IAA(生长素)、100 μmol/L 6-BA(细胞分裂素)、100 μmol/L Lovastatin(细胞分裂素合成抑制剂)、100 μmol/L GA3(赤霉素)及光照处理48 h后,分别收集叶片进行GUS活性定量分析和组织化学染色。
1.3 数据分析
运用Excel 2019整理统计数据,使用软件SPSS 22.0分析数据,采用单因素ANOVA的Duncan法和独立样本T检验进行比较分析, 差异显著水平均为0.05(P<0.05),使用软件Origin 2017 作图。
2 结果与分析
2.1 MdMAX1的克隆和鉴定
在GDR网站以拟南芥MAX1为模板进行同源比对,苹果中位于LG15的MDP0000130133相似度最高。以MDP0000130133 CDS序列为参考,克隆得到MdMAX1,其开放阅读框1 620 bp,比参考序列增加了6个碱基,相似度99.44%;编码539个氨基酸,与参考基因氨基酸序列的相似度99.07%(图1)。系统发育树分析显示,MdMAX1与双子叶植物MAX1聚类距离较近(图2,A)。MAX1根据作用产物的不同可分为3种类型(A1~A3型),与A2类型水稻(Os900)和A3类型水稻、玉米(Os1400、ZmMAX1b)相比,MdMAX1与A1类型矮牵牛、番茄、拟南芥MAX1(PtMAX1、SlMAX1和AtMAX1)聚类关系更近。
进一步的基序分析表明,双子叶植物MAX1都包含13个motifs,而单子叶植物motifs数目不固定(12~14个)(图2,B)。双子叶植物MAX1比单子叶植物MAX1都少1个固定的motif,序列为RKDFLSVVLDARESNKSSREL。此外,所有的A1型MAX1都包含13个motifs。
2.2 MdMAX1在苹果中的表达模式
利用qRT-PCR分析‘长富2号’嫁接苗7个组织中MAX1的表达。MAX1在茎中高表达,在腋芽本身也有表达,而在开放的花、顶梢和叶片中的表达水平可以忽略不计(图3)。MAX1在腋芽3、5中的表达水平高于其他节位的腋芽并存在显著差异(图3)。
RNA-seq转录组数据分析发现6-BA处理‘长富2号’腋芽96 h后MAX1的表达量下降至对照组的一半,达到显著差异(图4,A)。另外,分析‘bly114’海棠腋芽(WT)及它的多分枝突变体(MB) 转录组数据发现MAX1在WT和MB腋芽中表达量有显著差异(图4,B)。
2.3 MdMAX1基因启动子的克隆与序列分析
以‘长富2号’叶片基因组 DNA 为模板,对MdMAX1 ATG前的1 500 bp启动子区段进行克隆(图5),得到的序列与GDR预测序列完全相同。使用PlantCARE在线软件进行顺式作用元件预测,MdMAX1启动子片段上含有多个光响应原件(TCT-motif、ATC-motif、Box4和MRE),多个激素相关作用元件(涉及到的激素有茉莉酸甲酯、赤霉素和水杨酸),分别与低温、抗逆和创伤响应相关的LTR、TC-rich repeats和WUN-motif元件,另外,还有响应厌氧诱导、分生组织特异性激活和生物节律的作用元件(表1)。
2.4 不同处理对MdMAX1启动子活性的影响
GUS活性检测显示MdMAX1 ATG上游1 500 bp启动子片段具有启动活性,且GR24和Lovastatin处理后,MdMAX1启动子活性增强;光照处理后,MdMAX1启动子活性减弱;IAA、GA3和6-BA处理后,MdMAX1启动子活性无显著变化(图 6)。

A1型MAX1将己内酯转化为已内酯酸;A2型通过已内酯酸将己内酯转化为4-deoxyorobancho(4DO);A3类型,将己内酯转换为列当醇;红色星号.单子叶植物MAX1特有的motif图2 不同植物MAX1蛋白的系统发育(A)及motif分析(B)A1-type, converting carlactone (CL) to carlactonoic acid(CLA); A2-type, converting CL to 4-deoxyorobanchol(4DO) via CLA; and A3-type, converting CL to CLA and 4DO to orobanchol. Monocots MAX1 unique motif is marked with a red asteriskFig.2 A phylogenetic (A) and motif analysis (B) of MAX1 protein from different plant species

不同小写字母代表不同组织间(虚线左)和不同节位腋芽间(虚线右)的显著差异(P < 0.05)。数据为平均值±标准差(n = 3)图3 MdMAX1在‘长富2号’嫁接苗不同组织中的表达Different lowercase letters represent significant differences between different tissues (the left part of the dashed line) and between axillary buds at different nodes (the left part of the dashed line). Data are means ± SE (n = 3)Fig.3 The expression of MdMAX1 in different tissues of ‘Nagafu 2’

A.6-BA处理后‘长富2号’腋芽中MAX1的表达;B.‘bly114’海棠(WT)和它的多分枝突变体(MB)腋芽中MAX1的表达。* 表示在0.05 水平上有显著性差异(P <0.05),RNA-seq表达量基于RPKM(Reads per kilo bases per million reads)数值图4 基于RNA-seq的苹果腋芽MAX1基因表达谱分析A. Expression of MAX1 in lateral buds of ‘Nagafu 2’with 6-BA treatment; B. Expression of MAX1 in lateral buds Malus spectabilis ‘bly114’ (WT) and its more branching mutant(MB).* indicates significant difference at the 0.05 level (P <0.05). RNA-seq expression is based on RPKM (Reads per kilo bases per million reads) valueFig.4 The expression patterns of MAX1 in lateral buds of apple by RNA-seq-based transcriptome
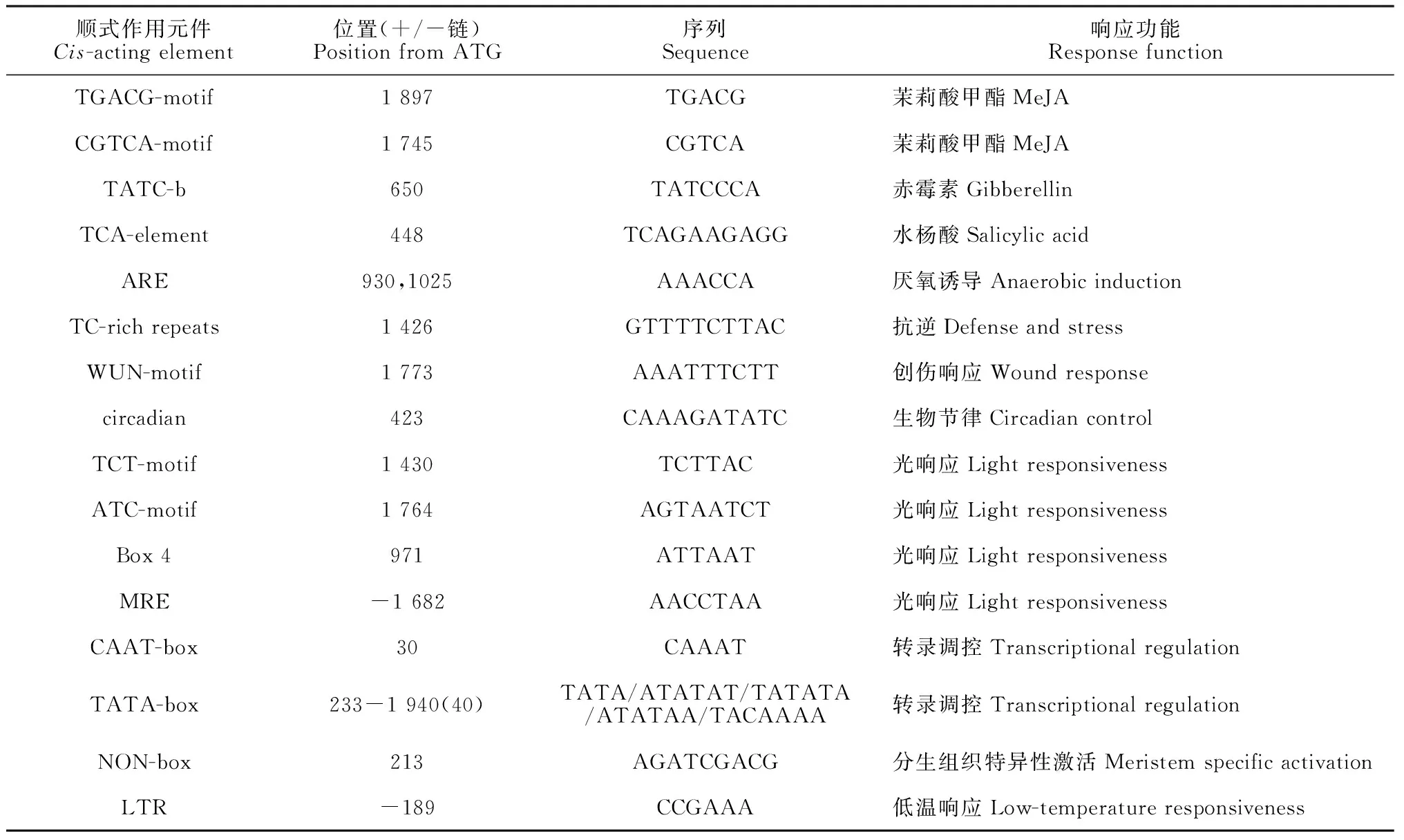
表1 MdMAX1基因启动子的顺式作用元件
1和2为MdMAX1启动子; M为DNA Marker图5 苹果MdMAX1基因启动子的克隆1 and 2 indicated the cloned products of the MdMAX1 promoter;M indicated the DNA markerFig.5 Promoter cloning of MdMAX1 in apple
3 讨 论
SLs是近年来发现的抑制腋芽生长的新型激素,有关SLs和分枝的关系许多问题还需深入研究[25]。MAX1是SLs合成途径中的关键基因,MAX1在‘长富2号’和 ‘Bly114’海棠的腋芽中均有表达,‘长富2号’不同节位的腋芽中,MAX1的表达水平不同。不同节位的腋芽具有不同的分枝能力[26];SLs在豌豆腋芽内自身合成并直接作用于腋芽[27]。根是SLs合成的主要部位,但嫁接实验表明,在茎中直接合成的SLs向上移动以抑制芽的生长可能更为重要[15,27]。苹果腋芽中MAX1表达的丰富性是否使腋芽中合成的SLs扮演更为重要的角色有待深入研究。
MAX1编码细胞色素P450单加氧酶,MAX1主要负责 SL 的结构修饰。植物中已发现三十多种天然的 SL,这些 SL 结构的差异化归功于MAX1同源基因的存在。MAX1s可以分为3种类型:A1~A3型,A1型是保守的,其将CL转化为CLA[14]。通过系统发育分析,MdMAX1与A1型MAX1s聚类接近,MdMAX1 基序数与A1型MAX1相同,因此MdMAX1可能也参与了苹果中CL向CLA的转变。
在植物分枝发育的复杂调控网络中,激素和环境因子发挥着极其重要的作用。但是,内源激素和环境因子之间的相互调控关系尚不明确。光作为重要的环境因素之一,通过光强、光质和光周期等影响植物侧枝伸长。高粱腋芽中 SL 信号转导基因SbMAX2 响应远红光处理上调表达,抑制phyB突变体的生长会诱导SbMAX2基因的表达[28];SL调控腋芽萌发依赖于BRC1,较低的红光/远红光比率处理能诱导腋芽中BRC1的表达,BRC1可以抑制与光合作用相关基因的转录活性,诱导与脱落酸相关基因的表达[29];在遮荫条件下,拟南芥phyB突变体分枝减少,茎中生长素响应相关基因的转录水平显著提高[30],由此推测,光可能通过植物激素(如生长素、SL 和脱落酸等)相关基因的表达调控植物的分枝发育。对MdMAX1 启动子片段顺式作用元件分析发现,苹果MdMAX1启动子含有多个光响应作用元件,推测光同样调控MdMAX1的表达;另外,启动子GUS活性分析结果显示光照处理能显著抑制苹果MdMAX1启动子的活性,表明苹果MdMAX1 基因与光信号之间有着不可忽视的关联,但其中的分子机制还需进行深入研究。

A.PMAX1-GUS 融合表达载体构建示意图; B.不同处理后烟草叶片中GUS含量的定量测定(n=3),小写字母代表不同处理间的显著差异(P < 0.05);C.不同处理后烟草叶片的 GUS组织染色,N b.本氏烟草图6 不同处理后苹果MdMAX1启动子瞬时转化烟草的 GUS 活性分析A. Schematic diagram of PMAX1-GUS fusion expression vector; B. GUS activity of MdMAX1a promoters in tobacco leaves in response to different treatments (n = 3), Lowercase letters represent significant differences among different treatments (P < 0.05); C. GUS tissue staining of tobacco leaves after different treatments, Nb. Nicotiana benthamianaFig.6 GUS activity of apple MdMAX1 promoter in tobacco leaves after different treatments

