基于单链DNA模板合成铜纳米簇的四环素无标记检测
杨丽霞 曽希珂 易 姿
(长沙市食品药品检验所,湖南 长沙 410036)
四环素类抗生素(tetracyclines,TCs)是一类重要的抗生素,因其具有抗菌谱广、药性稳定、低毒、价格低廉等特点,在治疗革兰氏阳性菌和革兰氏阴性菌引起的人畜感染中得到了广泛的应用[1-2]。目前,四环素在家畜和水产养殖中常被使用[3-4],导致日常食品中存在四环素残留,特别多见于肉类、鱼、牛奶和蜂蜜等动物产品中[5-7]。人通过食物长期低剂量摄入四环素并在体内蓄积,易引起人体内耐药菌株的产生和增加,导致胃肠道疾病、过敏、肾毒性,以及血液或中枢神经系统等疾病[8]。因此,应该控制四环素等抗生素的使用,中国国家标准[9]规定鸡蛋中四环素残留限量应≤400 μg/kg,肌肉中≤200 μg/kg,肝脏中≤600 μg/kg,牛奶中≤100 μg/kg。其他国家也制定了动物产品中四环素类药物的最大残留限量标准。例如,欧盟[10]规定,鸡蛋中四环素残留的最大限量应≤200 μg/kg,肌肉中≤100 μg/kg,肝脏中≤300 μg/kg,牛奶中≤100 μg/kg。
目前,四环素的检测已成功建立了多种分析方法,包括高效液相色谱法[11]、液相色谱—串联质谱法[12]、微生物分析法[13]、毛细管电泳法[14-15]、酶免疫分析[16]以及电化学免疫传感器[17-19]等。尽管其中一些方法[11-12]具有较高的选择性和足够的灵敏度,但大多数方法都或多或少地存在一些缺点,如仪器相对昂贵、样品制备过程复杂、预处理耗时等。
荧光金属纳米分析方法具有操作简单、速度快、灵敏度高、选择性好等优点,已经引起了研究人员的广泛关注。铜纳米簇作为一种新型的功能性纳米颗粒,由于合成简单、光稳定性好以及在水溶液中具有良好的分散性,使其作为荧光探针在生物传感领域具有广阔的应用前景。近年来,基于双链DNA和单链DNA模板合成的铜纳米簇的报道很多。例如,Wang等[20]基于聚T模板合成铜纳米簇,建立了一种曲酸的无标记检测方法。Ou等[21]以聚T为模板的铜纳米粒子作为荧光探针灵敏测定胰蛋白酶。Song等[22]利用双链DNA模板合成铜纳米离子,结合核酸外切酶催化的目标循环扩增能力,建立了一种检测赭曲霉毒素A的荧光方法。Zhang等[23]运用双链DNA模板铜纳米粒子作为荧光指示剂,建立了一种无标记荧光方法检测多核苷酸激酶活性。Hu等[24]基于双链DNA模板合成铜纳米粒子,用于核酸酶的检测。Song等[25]利用杂交链式反应和双链DNA模板合成的铜纳米粒子,建立了一种无标记、非酶促扩增的DNA检测方法。据以上文献报道,以聚T为模板合成的铜纳米簇,具有荧光强度高的特点,尺寸和荧光强度可以通过聚T单链DNA的长度来调节;另外,相比dsDNA-铜纳米簇的合成,为了保证dsDNA模板的有效杂交,通常需要耗时1 h以上,而聚T铜纳米簇的合成只需要几分钟即可完成。
在上述基础上,试验拟以聚T模板合成的铜纳米簇作为荧光探针,构建一种新的荧光生物传感方法用于检测实际样品中的四环素类抗生素,以期为食品中四环素类抗生素的快速检测提供技术支撑。
1 材料与方法
1.1 试剂与仪器
含30个碱基的聚胸腺嘧啶寡聚核苷酸链(T30):生工生物工程(上海)股份有限公司;
盐酸四环素、盐酸土霉素、盐酸金霉素、青霉素、氨苄西林、头孢氨苄、盐酸林可霉素、链霉素、卡那霉素、氯霉素:USP级,生工生物工程(上海)股份有限公司;
CuSO4·5H2O、抗坏血酸、甘氨酸、精氨酸、葡萄糖、麦芽糖、蔗糖、氯化钙、氯化镁:分析纯,国药集团化学试剂有限公司;
3-(N-吗啉基)丙磺酸(MOPS):分子生物学级,BBI生命科学有限公司;
缓冲体系:20 mmol/L 3-(N-吗啉基)丙磺酸(MOPS)缓冲溶液(pH=7.5);
试验用水:超纯水(电阻率>18.2 MΩ·cm),超纯水系统SMARTPLUS-N;
荧光分光光度计:LS-55型,珀金埃尔默股份有限公司;
电子天平:ME204型,瑞士Mettler Toledo公司。
1.2 荧光铜纳米簇的制备
荧光铜纳米簇的合成是以T30-DNA链为模板在文献[26]的合成方法上稍作修改。将5 mmol/L抗坏血酸溶液10 μL加入到70 μL含有2 μmol/L T30-DNA的MOPs缓冲溶液(20 mmol/L MOPS,300 mmol/L NaCl,pH=7.5)中混合均匀,再加入10 μL 300 μmol/L CuSO4溶液,室温下避光孵育5 min,得到荧光铜纳米簇。
1.3 检测条件的优化
由于Cu2+浓度、抗坏血酸浓度、铜纳米簇合成时间、加入四环素的孵育时间是影响四环素检测的重要参数,采用单一变量的原则,对4个参数进行优化。
1.3.1 Cu2+浓度的优化 在T30-DNA浓度2 μmol/L,抗坏血酸浓度5 mmol/L,铜纳米簇合成时间5 min,考察Cu2+浓度(100,200,300,400,500,600 μmol/L)对体系荧光强度的影响。
1.3.2 抗坏血酸浓度的优化 在T30-DNA浓度2 μmol/L,Cu2+浓度300 μmol/L,铜纳米簇合成时间5 min,考察抗坏血酸浓度(1,2,3,4,5,6,7 mmol/L)对体系荧光强度的影响。
1.3.3 铜纳米簇合成时间的优化 在T30-DNA浓度2 μmol/L,Cu2+浓度300 μmol/L,抗坏血酸浓度5 mmol/L,考察铜纳米簇合成时间(1,2,3,4,5,6,7,8 min)对体系荧光强度的影响。
1.3.4 加入四环素的孵育时间的优化 在T30-DNA浓度2 μmol/L,Cu2+浓度300 μmol/L,抗坏血酸浓度5 mmol/L,铜纳米簇合成时间5 min,考察加入四环素的孵育时间(1,2,3,4,5,6,7 min)对体系荧光强度的影响。
1.4 四环素的检测
按照1.3的最优条件合成荧光铜纳米颗粒。将10 μL 不同浓度的四环素溶液(浓度分别为0.5,5.0,10.0,20.0,40.0,60.0,80.0,100.0,150.0,200.0,300.0 μmol/L)与90 μL 荧光铜纳米簇溶液混合均匀,保证总体系体积为100 μL,室温下避光孵育5 min,将溶液移入石英比色皿,使用荧光分光光度计测量荧光,激发波长340 nm,发射光谱波长扫描范围500~660 nm。
1.5 四环素检测的特异性
为了验证方法的特异性,将浓度为100 μmol/L的盐酸四环素(TC)、盐酸土霉素(OTC)、盐酸金霉素(AM)、青霉素(PC)、氨苄西林(SAM)、头孢氨苄(CLX)、盐酸林可霉素(LM)、链霉素(SM)、卡那霉素(KAN)、氯霉素(CM)以及浓度为1 mmol/L的甘氨酸(Gly)、精氨酸(Arg)、葡萄糖(Glc)、麦芽糖、蔗糖、氯化钙、氯化镁等多种目标物,按照1.4的步骤加入到荧光铜纳米簇溶液中混合均匀,室温下避光孵育5 min,使用荧光分光光度计测量荧光。
1.6 牛奶样品的准备
纯牛奶样品购于当地超市。吸取5 g牛奶样品用5 mL 1%的三氯乙酸超声提取20 min,然后在15 000 r/min 转速下离心5 min,取上清液用滤纸过滤,将收集的滤液用水定容至5 mL,最后将通过0.22 μm的滤膜后的清液用于样品分析[27]。采用标准加入法进行牛奶样品中四环素的分析。
1.7 鸡肉样品的准备
1.7.1 提取 鸡胸肉样品购于当地超市。样品中四环素的提取步骤按照中国现行国家标准[28]3检测方法中的提取步骤进行。
1.7.2 净化 鸡肉样品中四环素的净化步骤参考中国现行国家标准[28]3检测方法中的净化步骤并略有修改。准确吸取10 mL提取液以1滴/s的速度过HLB固相萃取柱,待样液完全流出后,依次用5 mL水和5 mL甲醇—水(V甲醇∶V水=1∶19)淋洗,弃去全部流出液。2.0 kPa以下减压抽干5 min,最后用10 mL甲醇—乙酸乙酯(V甲醇∶V乙酸乙酯=1∶9)洗脱。将洗脱液氮吹浓缩至干(温度低于40 ℃),用1.0 mL超纯水溶解残渣,过0.22 μm 滤膜,收集清液用于样品分析,采用标准加入法进行实际样品中四环素的分析。
2 结果与分析
2.1 检测方法原理
试验方法的检测原理如图1所示。在不添加四环素的条件下,制备了以T30-ssDNA为模板的铜纳米簇,并表现出了优异的性能。T30-ssDNA模板铜纳米簇的形成通常包括两个步骤:胸腺嘧啶和Cu2+之间的结合作用,促进了“胸腺嘧啶-Cu2+”复合物的形成;抗坏血酸沿poly-T模板骨架将胸腺嘧啶络合的Cu2+还原为Cu0,形成了铜纳米簇,在340 nm激发波长的激发条件下,具有较强的荧光信号。当传感体系中存在目标物四环素时,铜纳米簇的荧光强度显著降低。这可能是由于四环素与poly-T模板铜纳米簇表面的基团发生相互作用,猝灭了铜纳米颗粒的荧光,导致荧光信号的降低。试验通过研究四环素存在与否对荧光响应的差异,设计了一种无标记、选择性的四环素荧光生物传感器。
2.2 荧光传感检测方法的可行性
为了检验该荧光传感方法用于四环素检测的可行性,即四环素的存在与否对铜纳米簇荧光强度的影响,测定了四环素存在与不存在时铜纳米簇的荧光值。如图2所示,当铜纳米簇体系中加入10 μL超纯水时,检测到强荧光值,当加入10 μL的300 μmol/L的四环素时,荧光值显著降低。以上结果表明该荧光传感检测方法用于四环素的检测是可行的。
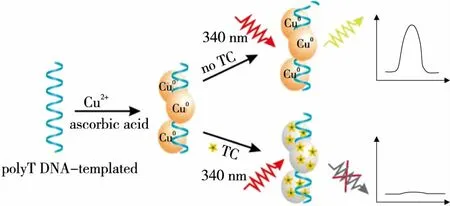
图1 基于非标记聚T单链DNA模板铜纳米簇的四环素传感检测原理
2.3 试验条件优化
2.3.1 Cu2+浓度的优化 根据检测原理,所开发传感器的检测性能在很大程度上取决于铜纳米簇的荧光强度。因此,考察了合成条件对反应的影响。如图3所示,铜纳米簇的荧光强度随Cu2+浓度的增加而迅速升高,当Cu2+浓度为300 μmol/L时,荧光强度达到最高,当Cu2+浓度>300 μmol/L时,荧光强度随之降低。这可能是由于较高浓度的Cu2+经还原剂活化后,通过氧基自由基降解聚T模板。结果表明,Cu2+的最佳浓度为300 μmol/L。
2.3.2 抗坏血酸浓度的优化 从图4可以看出,随着抗坏血酸浓度的增加,荧光强度显著增加,当抗坏血酸浓度为5 mmol/L时荧光强度达到最高。因此,选择5 mmol/L为抗坏血酸最佳浓度。
2.3.3 铜纳米簇合成时间优化 如图5所示,当T30-ssDNA中加入Cu2+和抗坏血酸后,随着孵育时间的增加,荧光强度迅速增加,当时间为5 min时荧光强度达到最高并趋于平稳,因此,5 min被选为铜纳米簇的最佳合成时间。

a. 不存在四环素 b. 存在300 μmol/L四环素
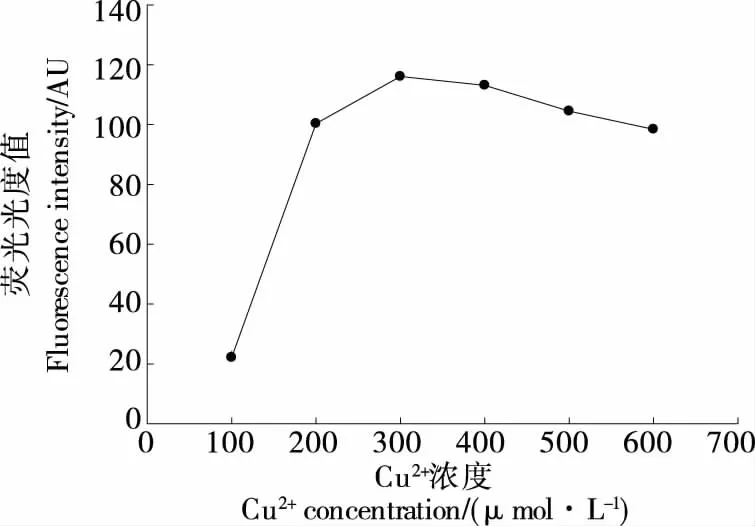
图3 Cu2+浓度对铜纳米簇荧光强度的影响
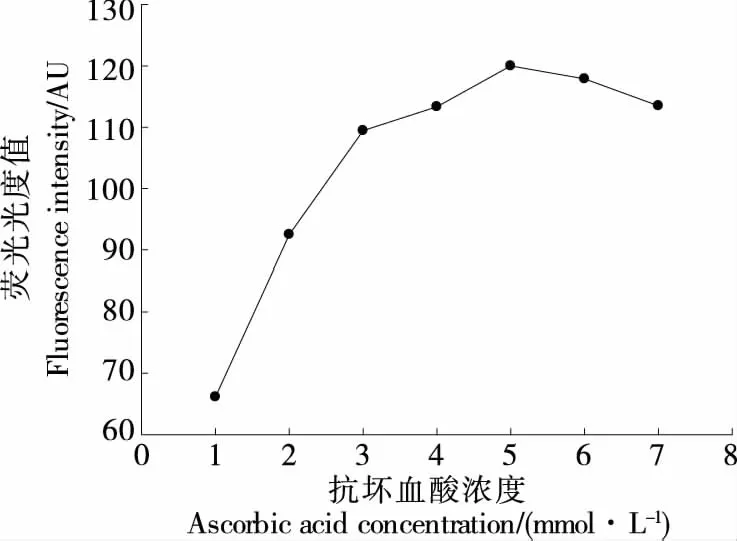
图4 抗坏血酸浓度对铜纳米簇荧光强度的影响
2.3.4 四环素孵育时间优化 如图6所示,四环素加入后,随着孵育时间的延长荧光强度逐渐降低,孵育时间超过5 min后荧光强度趋于平稳。在最初的3 min内,荧光度迅速下降(下降了89%)。因此,为了获得较短的反应时间,选择5 min为四环素最佳孵育时间。荧光法对四环素的定量分析性能,在优化的试验条件下
2.4 检测方法的性能
为了进一步研究基于T30-ssDNA模板的铜纳米簇检测了加入不同浓度四环素的荧光强度。图7描绘了在不同浓度的四环素存在下,T30-ssDNA为模板的铜纳米簇的典型荧光光谱。从图7可以看出,在0~300 μmol/L的四环素浓度范围内,荧光强度随浓度的增加逐渐降低。图8示出了四环素浓度与610 nm处的荧光强度之间的关系。在0~80 μmol/L的浓度范围内,荧光强度和四环素浓度之间获得了良好的线性关系,线性回归方程为y=-0.687 9CTC+96.122,线性回归系数R2=0.996 1。根据空白响应的3倍标准偏差,检测限为0.01 μmol/L,按式(1)进行换算后可得到:用于四环素残留量的检测范围为0~384 720 μg/kg,且测定低限为48 μg/kg,略低于国家标准[28]5检测方法(液相色谱质谱法)的检测限50 μg/kg。根据中国现行判定标准[9]的规定,牛奶样品中的四环素残留限量为100 μg/kg,肌肉样品中的四环素残留限量为200 μg/kg,该标准中四环素残留限量均在试验方法四环素残留量的检测范围内,这些结果进一步证明,试验提出的无标记荧光生物传感器可以应用于目标四环素的定量分析,性能良好,且该方法能对实际样品四环素残留量是否合格进行判定。
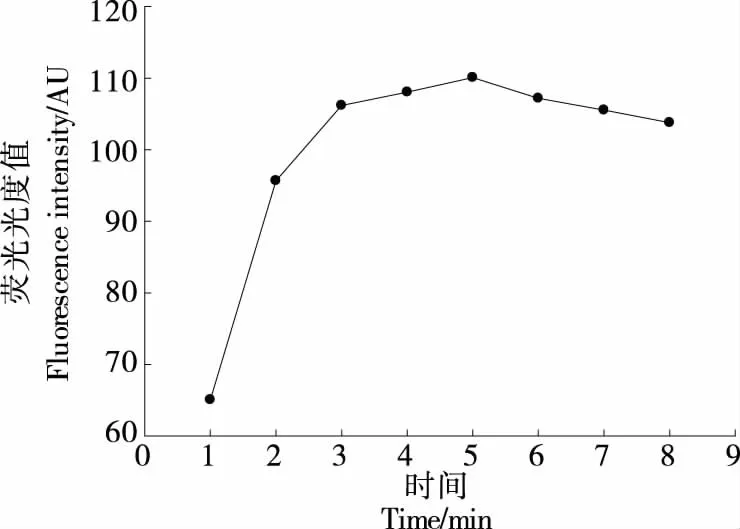
图5 铜纳米簇合成时间对荧光强度的影响
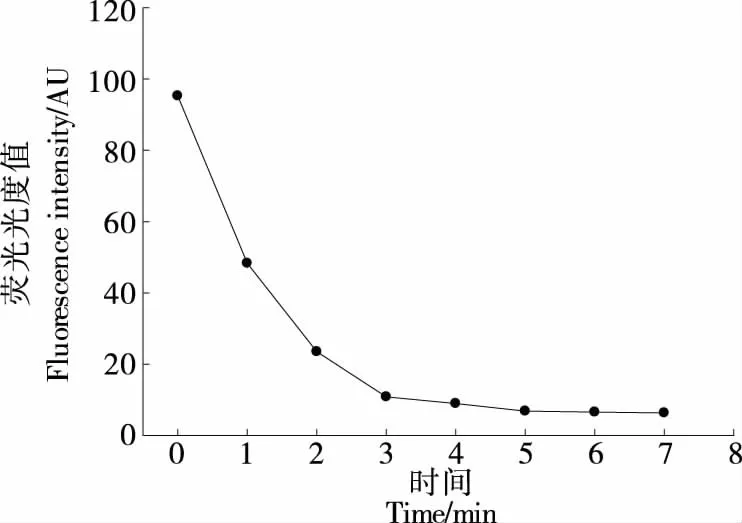
图6 四环素孵育时间对铜纳米簇荧光强度的影响

荧光曲线从上至下四环素浓度分别是0.0,0.5,5.0,10.0,20.0,40.0,60.0,80.0,100.0,150.0,200.0,300.0 μmol/L

图8 浓度校准曲线
(1)
式中:
X——样品中待测组分的含量,μg/kg;
c——测定液中待测组分的浓度,μmol/L;
v——测定液的体积,0.1 mL;
m——待测样品的质量,g;
500——稀释倍数;
480.9——四环素的摩尔分子量。
2.5 检测方法的特异性
为了验证检测方法的特异性,测试了其他抗生素、金属离子、氨基酸、糖类等对铜纳米簇的荧光影响,结果见图9。由图9可知,只有四环素类抗生素(盐酸四环素、土霉素、金霉素)能显著降低铜纳米簇的荧光强度,其他干扰物对荧光强度无影响,以上结果表明四环素类抗生素对铜纳米簇的荧光猝灭作用具有特异性。
2.6 实际样品分析
为探讨食品中四环素测定方法的可行性,分别在牛奶和鸡肉样品中加入标准品进行分析,采用标准加入法评价了该方法的实用性。结果见表1。牛奶样品中,3个加标水平的平均回收率在98.72%~108.30%,相对标准偏差(RSD,n=6)为2.36%~4.01%,鸡肉样品中,3个加标水平的平均回收率在97.67%~110.23%,相对标准偏差(RSD,n=6)为2.98%~3.84%,表明该检测方法准确性较好,能够被用于实际样品检测。
3 结论
利用聚T单链为模板制备铜纳米簇作为荧光探针构建了一种荧光生物传感方法用于四环素的检测。结果显示,该方法对四环素具有灵敏度高、选择性强的检测能力,检测限为0.01 μmol/L。与其他方法相比,该检测方法具有以下优点:① 这种新型传感器无需共轭或标记过程,所有的反应过程都在10 min内室温避光下完成;② 对四环素类抗生素具有较高的特异性。此外该方法可用于牛奶、鸡肉等实际样品中四环素的测定,因此作为一种无标记、快速、高选择性、高灵敏度的四环素类的检测平台,在食品分析等领域的小分子检测中具有广阔的应用前景。

