血清白细胞介素-8、环氧化酶-2、血管内皮生长因子-A水平变化与三阴性乳腺癌患者术后复发的关系及临床意义
张露文
(焦作市第二人民医院 甲状腺乳腺外科,河南 焦作 454100)
三阴性乳腺癌的免疫组织化学检查孕激素受体(progesterone receptor,PR)、雌激素受体(estrogen receptor,ER)、原癌基因HER-2均为阴性,远处转移风险较高,预后较其他类型的乳腺癌差。乳腺癌发病呈年轻化,严重危害女性的身心健康。临床多采用手术切除病灶治疗,但癌细胞易脱落、游离,随着血液、淋巴液扩散,形成远端转移。研究发现,乳腺癌细胞增殖、凋亡与某些细胞因子密切关系,其中白细胞介素-8(interleukin-8,IL-8)、环氧化酶-2(cyclooxygenase-2,COX-2)、血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A)在乳腺癌发生、发展过程中起重要作用[1-3]。本研究分析血清IL-8、COX-2、VEGF-A水平变化与三阴性乳腺癌患者术后复发的关系及临床意义。
1 资料与方法
1.1 一般资料将2017年3月至2018年9月焦作市第二人民医院收治的67例三阴性乳腺癌患者纳入乳腺癌组,将64例乳腺良性肿块患者纳入对照组。患者及家属均签署知情同意书。对照组:年龄22~46岁,平均(33.93±4.90)岁;体质量45~68 kg,平均(56.31±4.61)kg;良性肿块病程1.0~5.5 a,平均(3.24±1.11)a。乳腺癌组:年龄22~48岁,平均(34.81±5.19)岁;体质量45~67 kg,平均(55.82±5.07)kg;乳腺癌病程1.5~6.0 a,平均(3.51±0.99)a;国际抗癌联盟TNM分期Ⅰ期14例,Ⅱ期31例,Ⅲ期22例。两组年龄、体质量、病程比较,差异无统计学意义(P>0.05)。本研究经焦作市第二人民医院医学伦理委员会审批通过。
1.2 选取标准(1)纳入标准:①经病理学检查、免疫组织化学检查确诊为三阴性乳腺癌;②临床资料完整;③无手术与麻醉禁忌证,有手术治疗指征,能耐受手术者;④能正常交流者。(2)排除标准:①合并其他恶性肿瘤者;②严重心肺功能不全者;③合并其他免疫系统、血液系统疾病者;④严重精神、心理疾病致认知、语言功能障碍者;⑤妊娠期、哺乳期妇女;⑥有乳腺手术史或既往有乳腺肿块史者。
1.3 手术方法和病理检测两组术前均进行常规检查,均未发现转移灶。根据三阴性乳腺癌的临床分期,对乳腺癌组患者采取改良根治术、保乳术治疗。对照组患者接受微创手术切除肿块。术后由病理科对患者肿瘤大小、性质、淋巴结状态行病理检查。使用中性甲醛固定患者病理标本,石蜡包埋,然后连续切片4 μm厚,使用免疫组织化学染色SP法检测,严格按照说明书进行操作。以PBS代替一抗作阴性对照,已知阳性切片为表达阳性对照。IL-8阳性:连续选取20个高倍视野,光镜下细胞质见棕黄颗粒,阳性细胞数占比>25%。COX-2阳性:细胞质内或核膜有棕黄色颗粒,阳性细胞数占比(5个高倍视野)>5%。VEGF-A阳性:细胞质呈现棕黄色颗粒,选取4个视野,阳性细胞>10%。
1.4 观察指标分别于术前、术后3 d清晨抽取患者空腹静脉血5 mL,以3 000 r·min-1离心5~10 min,取上清液,-20 ℃保存,采用双抗体夹心酶联免疫吸附试验检测COX-2、IL-8、VEGF-A水平。所用酶标仪来自美国MD公司,试剂盒来自上海依科赛生物制品有限公司,严格按照操作标准检测。统计乳腺癌组1 a内复发情况,并于1 a后再次检测乳腺癌组患者的血清COX-2、IL-8、VEGF-A水平。
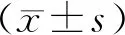
2 结果
2.1 血清COX-2、IL-8、VEGF-A水平术前,乳腺癌组血清COX-2、IL-8、VEGF-A水平高于对照组(P<0.05);术后3 d,乳腺癌组血清COX-2、IL-8、VEGF-A水平与对照组比较,差异无统计学意义(P>0.05);术后3 d,乳腺癌组血清COX-2、IL-8、VEGF-A水平低于术前(P<0.05);术后3 d,对照组血清COX-2、IL-8、VEGF-A水平与术前比较,差异无统计学意义(P>0.05)。见表1。

表1 两组手术前后血清COX-2、IL-8、VEGF-A水平比较
2.2 复发者与未复发者血清COX-2、IL-8、VEGF-A水平术后1 a,乳腺癌组复发4例,未复发63例。术后3 d、术后1 a,复发者血清COX-2、IL-8、VEGF-A水平高于未复发者(P<0.05);复发者术后1 a血清COX-2、IL-8、VEGF-A水平高于术后3 d(P<0.05)。见表2。

表2 复发者与未复发者术后3 d、术后1 a血清COX-2、IL-8、VEGF-A水平比较
3 讨论
乳腺癌属于常见的恶性肿瘤,三阴性乳腺癌为其中一种分型。与其他类型的乳腺癌相比,三阴性乳腺癌远处转移率较高,主要表现为晚期阶段易出现肝转移、肺转移,影响患者的生存质量。三阴性乳腺癌的发生、进展受各种因素的影响,如细胞增殖、凋亡过程紊乱,或肿瘤周围微血管的形成。肿瘤细胞增殖、凋亡与机体某些细胞因子有重要联系。
三阴性乳腺癌浸润、转移的先决条件为血管新生。本研究结果显示,术前乳腺癌组血清COX-2、IL-8水平高于对照组,术后3 d乳腺癌组血清COX-2、IL-8水平低于术前。这表明三阴性乳腺癌患者体内血清COX-2、IL-8呈高表达状态,而手术切除癌组织后机体血清COX-2、IL-8水平降低,提示血清COX-2、IL-8可反映手术治疗效果。COX-2可刺激癌细胞增殖和血管生成,抑制宿主免疫功能,为肿瘤生长提供优势条件,增强癌细胞的侵袭力[4-5]。IL-8可与细胞表面趋化因子受体1(CXC-chemokine receptor-1,CXCR1)、趋化因子受体2(CXC-chemokine receptor-2,CXCR2)结合发挥生物学效应,而CXCR1、CXCR2存在于癌细胞和新生血管内皮细胞中,IL-8与CXCR1、CXCR2结合后能促进癌细胞增殖及血管生长[6]。除免疫抑制外,乳腺癌发生发展的另一关键为血管、淋巴管新生。VEGF-A为血管内皮细胞特异性有丝分裂原,可作用于血管内皮细胞,促进癌细胞增殖;提高血管通透性,导致血浆蛋白渗漏到血管外,形成纤维蛋白凝块,以此作为新生血管支持物。因此,VEGF-A反映了癌组织血管生成能力,是目前特异性最高、作用最强的血管调控因子。本研究结果显示,术前乳腺癌组血清VEGF-A水平高于对照组,术后3 d乳腺癌组血清VEGF-A水平低于术前。这表明VEGF-A参与三阴性乳腺癌的发生和进展过程。肿瘤的生长必须有新生血管形成为肿瘤细胞提供足够营养。随着癌细胞的分化,VEGF-A会呈现高表达,说明VEGF-A水平可提示患者预后情况[7-9]。本研究结果表明,三阴性乳腺癌术后复发者血清COX-2、IL-8、VEGF-A水平可升高且处于持续升高状态,提示定期监测血清COX-2、IL-8、VEGF-A水平有助于了解手术预后与肿瘤进展情况,预测复发风险。
三阴性乳腺癌患者手术前后血清COX-2、IL-8、VEGF-A变化显著,可据此判断手术效果。监测三阴性乳腺癌患者术后血清COX-2、IL-8、VEGF-A水平有助于了解预后,预测复发风险。

