逍遥散抗抑郁代谢特征综合分析及其调节能量代谢和神经递质机制研究
高 耀,王 鹏,许 腾,武文泽,向 欢,韩雨梅,田俊生*,秦雪梅*
1.山西大学 中医药现代研究中心,山西 太原 030006
2.山西大学体育学院,山西 太原 030006
逍遥散源于宋代《太平惠民和剂局方》,由柴胡、当归、茯苓、白芍、炒白术、炙甘草、薄荷、生姜组成,具有疏肝解郁、养血健脾的功效。在治疗抑郁症方面,逍遥散因其符合整体调节、辨证论治、个体化诊疗等特点,显示了独特的理论优势和丰富的科学内涵优越性[1-3]。逍遥散能够通过调节抑郁症患者和抑郁动物模型机体异常代谢物水平,从而发挥抗抑郁作用[4-22]。课题组前期基于慢性不可预知温和刺激(chronic unpredicted mild stress,CUMS)抑郁大鼠模型的内源性代谢物变化探讨了抑郁症的发病机制,从神经递质、神经营养素、下丘脑-垂体-肾上腺轴、氨基酸、脂质和能量代谢、炎症因子等方面对逍遥散抗抑郁的作用机制进行分析,归纳总结了逍遥散抗抑郁的代谢网络调控机制[23-26]。随着代谢组学技术不断发展,不同生物样本的逍遥散抗抑郁作用代谢物数据得到充分的积累。因此,借助“大数据”理念对已有的特征代谢物进行综合分析,对深入挖掘和阐释逍遥散抗抑郁的作用机制有重要意义。
本研究从CUMS 动物的血液、尿液、海马、肝脏、盲肠、粪便和临床患者的血浆、尿液等生物样本中逍遥散具有显著调节作用的差异代谢物进行代谢特征综合分析,并归纳总结逍遥散在不同生物样本中调节的关键差异代谢物和代谢通路,以期为深入阐释逍遥散抗抑郁在代谢层次的作用机制提供科学依据。
1 材料
1.1 试剂
血清素(serotonin)购自日本TCI 有限公司;γ-氨基丁酸(γ-aminobutyric acid)购自阿拉丁公司;L-谷氨酸(L-glutamic acid)购自生工生物工程股份有限公司公司;去甲肾上腺素(norepinephrine)购自中国食品药品检定研究院;多巴胺(dopamine)、5-羟基吲哚乙酸(5-hydroxyindoleacetic acid)购自博飞美科公司。
1.2 仪器
1290Ⅱ超高效液相色谱仪(美国Agilent 公司);3200 QTRAP 三重四极杆串联质谱仪(美国AB Sciex 公司);Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm,美国Waters 公司);Neofuge 13R 高速冷冻离心机(力康生物医疗科技控股有限公司)。
2 方法
2.1 逍遥散代谢组学的信息收集与归纳分析
采用“抑郁”“抑郁症”“长期突触性抑郁”“逍遥”“逍遥散”关键词组合对PubMed、Cochrane Library、Embase、Web of Science、PsycINFO、中国知网、万方等数据库进行搜索查询,时间截止为2020年1月1日。同时通过抑郁症代谢数据库进行查询和补充[27],通过反复核对,整理逍遥散抗抑郁的代谢组学文献共19 篇,如表1所示。梳理不同生物样本在多个不同平台的代谢组学数据,为后续逍遥散回调差异代谢物的分析和代谢通路的富集提供数据支撑。
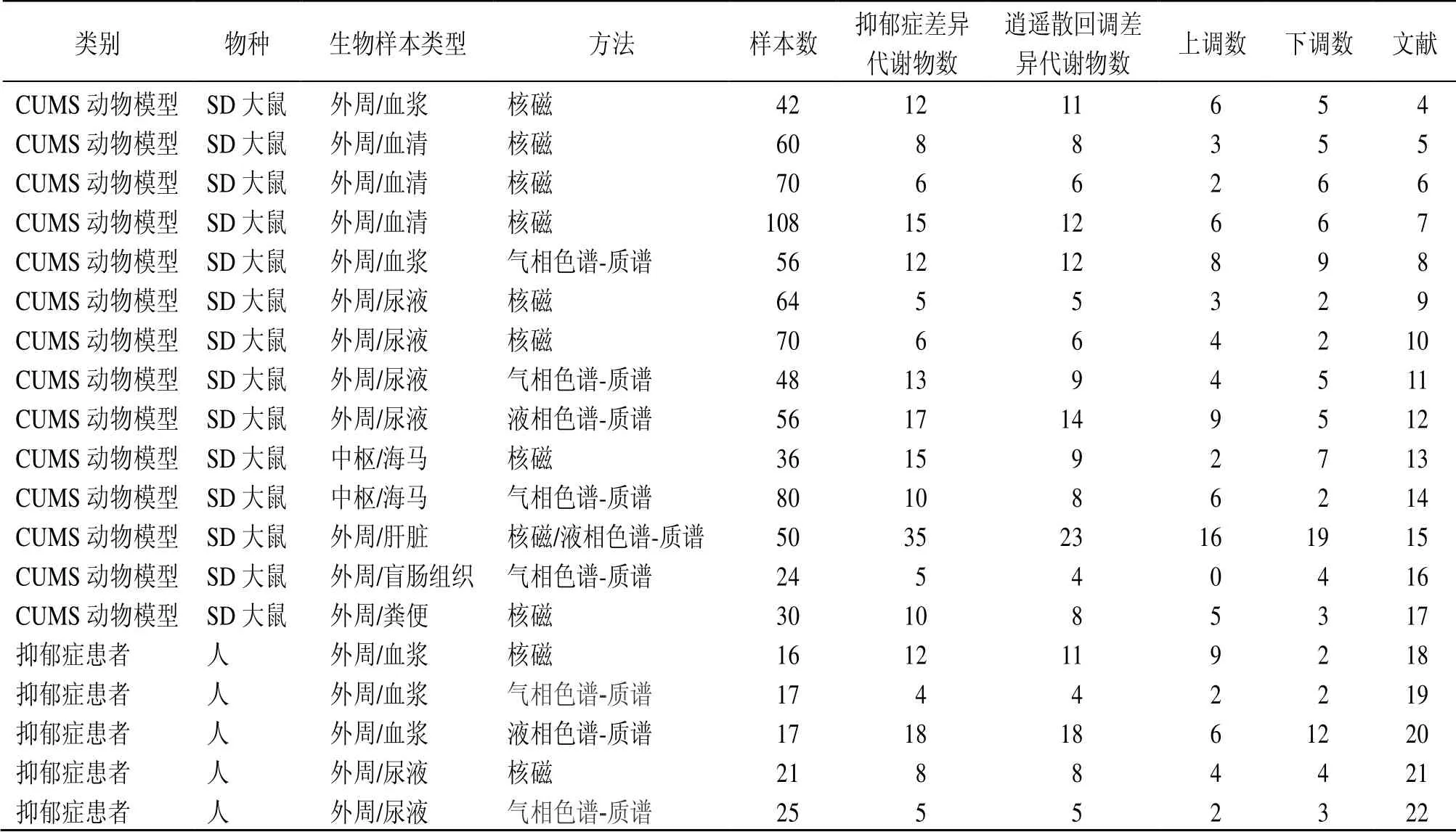
表1 逍遥散抗抑郁代谢组学文献信息Table 1 Information on antidepressant metabonomics of Xiaoyao San
2.2 逍遥散抗抑郁代谢特征综合分析
逍遥散抗抑郁代谢特征综合分析是指在逍遥散抗抑郁的代谢组学文献整理的基础上,对逍遥散回调差异代谢物和代谢通路进行分析,具体包括差异代谢物数量的比较分析、差异代谢物变化趋势的统计分析、差异代谢物的验证分析和差异代谢物的功能分析。其中,差异代谢物变化趋势的统计分析采用vote-counting 方法确定上调或下调的差异代谢物,并对原始文献中上调和下调的差异代谢物进行计数[27]。对逍遥散回调差异代谢物进行验证分析,差异代谢物的功能分析采用Omicsolution 软件进行代谢物途径的分析,并筛选符合标准(P<0.05)的通路。
2.3 逍遥散抗抑郁差异代谢物的验证分析
采用课题组前期建立的测定大鼠血清中神经递质水平的方法[28],通过超高效液相色谱-串联质谱法(UHPLC-MS/MS)测定CUMS 大鼠血清样品。
2.4 统计分析
实验数据以±s表示,采用SPSS 22.0 软件进行统计分析,组间比较采用单因素方差分析,采用Graphpad prism 5 软件绘图。
3 结果
3.1 差异代谢物数量的比较分析
如图1-A 所示,逍遥散对中枢和外周不同生物样本回调的部分差异代谢物相同。如表2所示,逍遥散回调CUMS 大鼠血液和尿液共有的差异代谢物有4 个,分别是棕榈酸(palmitic acid)、甘氨酸(glycine)、N-乙酰糖蛋白(N-acetyl glycoprotein)和丙酮酸(pyruvic acid);逍遥散回调CUMS 大鼠血液和肝脏组织共有的差异代谢物有4 个,分别是L-异亮氨酸(L-isoleucine)、肌酸(creatine)、β-D-葡萄糖(β-D-glucose)、和L-缬氨酸(L-valine);逍遥散回调CUMS 大鼠尿液和肝脏组织共有的差异代谢物有2 个,分别是柠檬酸(citric acid)和酮戊二酸(oxoglutaric acid);逍遥散回调CUMS 大鼠海马和肝组织共有的差异代谢物有1 个,为L-赖氨酸(L-lysine);逍遥散回调CUMS 大鼠尿液和海马组织共有的差异代谢物有1 个,为牛磺酸(taurine);逍遥散回调CUMS 大鼠血液、尿液和肝脏组织共有的差异代谢物有 2 个,分别为L-色氨酸(L-tryptophan)和L-酪氨酸(L-tyrosine);逍遥散回调CUMS 大鼠血液、海马组织和肝脏组织共有的差异代谢物有3 个,分别为L-谷氨酸(L-glutamic acid)、L-乳酸(L-lactic acid)和L-谷氨酰胺(L-glutamine)。表明逍遥散可调节动物不同生物样本的相同差异代谢物发挥抗抑郁作用。
如图1-B 所示,逍遥散对抑郁症患者和CUMS动物血液和尿液回调的部分差异代谢物相同。如表2所示,逍遥散对抑郁症患者和CUMS 动物血液回调的共有差异代谢物有7 个,分别是β-D-葡萄糖、胆碱(choline)、氧化三甲胺(trimethylamineN-oxide)、L-亮氨酸(L-leucine)、L-乳酸、L-丙氨酸(L-alanine)和甘氨酸;逍遥散对抑郁症患者和CUMS 动物尿液回调的共有差异代谢物7 个,分别是柠檬酸、L-苯丙氨酸(L-phenylalanine)、马尿酸(hippuric acid)、牛磺酸、酮戊二酸、肌酐(creatinine)和L-酪氨酸。逍遥散可能通过分别调节抑郁症患者和CUMS 动物血浆的7 个差异代谢物和尿液的7 个差异代谢物发挥抗抑郁作用。
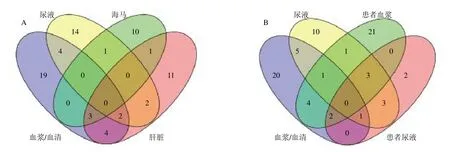
图1 逍遥散回调动物中枢和外周中差异代谢物的韦恩图 (A) 以及逍遥散回调患者、动物血液和尿液中差异代谢物的韦恩图 (B)Fig.1 Venn diagram of Xiaoyao San callback differential metabolites in central and peripheral of animals (A),Venn diagram of Xiaoyao San callback differential metabolites of blood and urine in patients and animals (B)
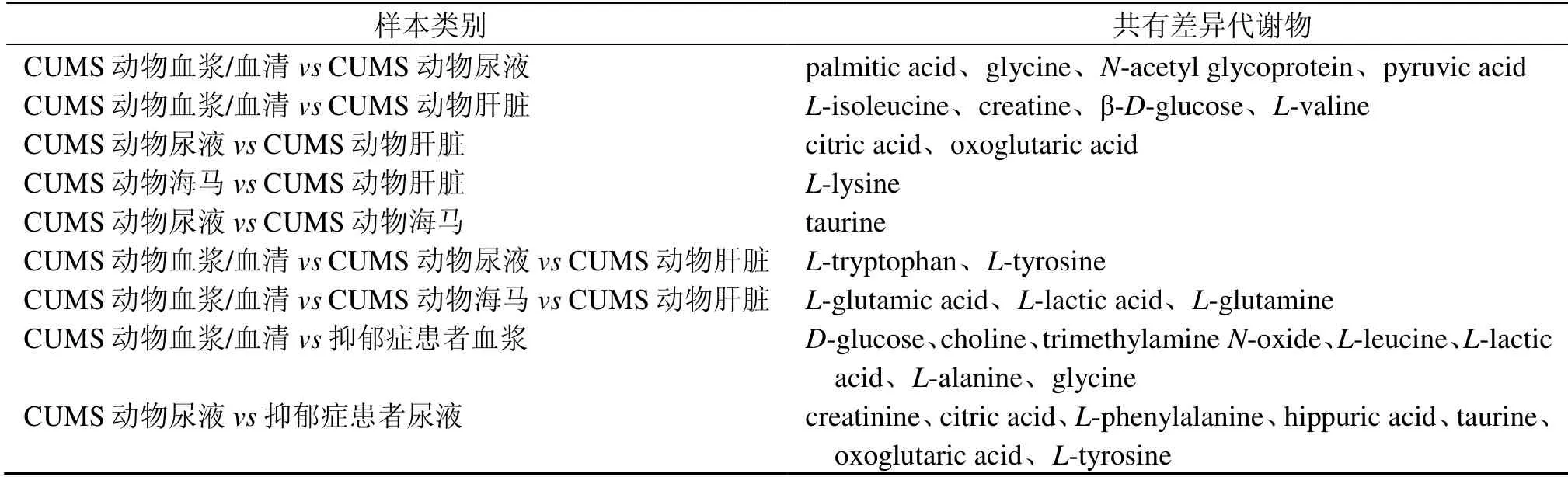
表2 逍遥散回调共有差异代谢物信息Table 2 Information of Xiaoyao San callback shared differential metabolites
3.2 差异代谢物变化趋势的统计分析
通过对逍遥散回调差异代谢物进行分析,发现在不同生物样本中,逍遥散调节相同的差异代谢物。进一步对回调差异代谢物进行统计,发现逍遥散调节34 个相同差异代谢物,如图2所示,差异代谢物按频数排序依次为乳酸(频数=7)、谷氨酸(频数=7)、丙氨酸(频数=6)、柠檬酸(频数=6)、酪氨酸(频数=6)、苯丙氨酸(频数=5)、胆碱(频数=5)、氧化三甲胺(频数=5)、谷氨酰胺(频数=5)、棕榈酸(频数=5)。
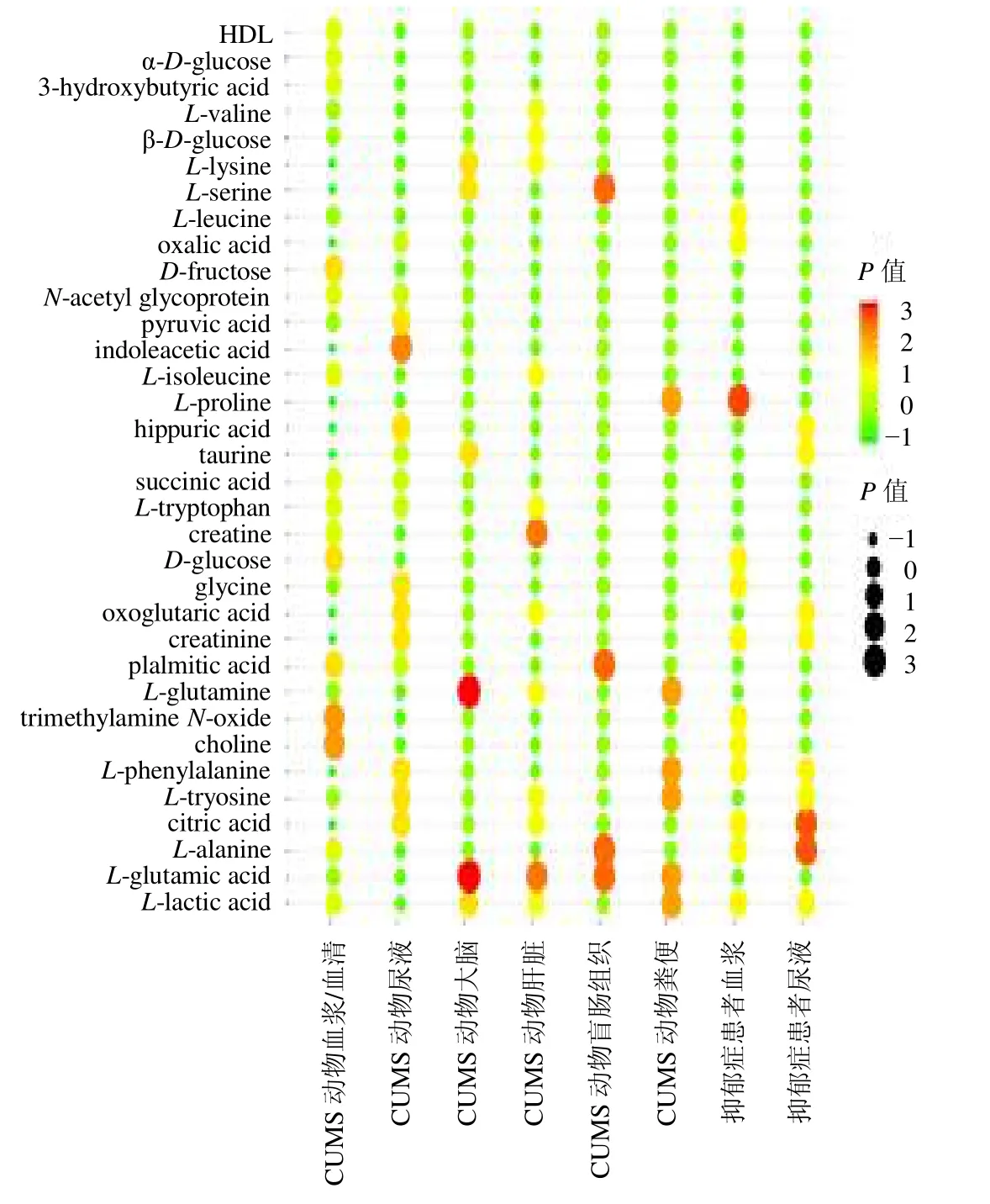
图2 逍遥散回调差异代谢物的矩阵气泡图Fig.2 Matrix bubble diagram of Xiaoyao San callback different metabolites
乳酸是报道次数最多的逍遥散回调差异代谢物,动物ip 乳酸钠(2 µg/kg)后,动物活动异常且活动减少[29]。乳酸钠可以急剧增加血液中的乳酸,同时增加大脑中的细胞外葡萄糖,葡萄糖是重要的能量代谢供应物质,逍遥散对CUMS 模型大鼠的能量代谢异常均有明显的治疗效果[30]。由此可见,这些调节的差异代谢物在逍遥散抗抑郁作用中发挥重要作用,可以为逍遥散抗抑郁疗效标志物的筛选和验证提供依据。
由于样本来源、备样方法、测试条件和数据采集等不同,不同类型的差异代谢物的变化趋势也不完全相同。进一步对不同差异代谢物的趋势进行分析,发现在34 个差异代谢物中,有11 个差异代谢物的变化趋势一致。如图3-A 所示,逍遥散上调的差异代谢物有7 个,分别为L-赖氨酸、L-亮氨酸、L-缬氨酸、L-脯氨酸(L-proline)、L-异亮氨酸、吲哚乙酸(indoleacetic acid)和酮戊二酸;逍遥散下调的差异代谢物有4 个,分别为β-D-葡萄糖、α-D-葡萄糖(α-D-glucose)、高密度脂蛋白(high-density lipoprotein,HDL)和D-果糖(D-fructose)。其中,酮戊二酸和果糖为变化趋势一致且报道次数最多的差异代谢物。此外,在34 个差异代谢物中,有23个差异代谢物的变化不完全一致,如图3-B 所示,逍遥散在不同生物样本中差异代谢物(下调数>上调数)有10 个,分别为L-乳酸、L-丙氨酸、D-葡萄糖、甘氨酸、肌酸(creatine)、L-谷氨酰胺、胆碱、牛磺酸、马尿酸和N-乙酰糖蛋白;逍遥散在不同生物样本中差异代谢物(下调数=上调数)有5 个,分别为L-酪氨酸、柠檬酸、L-丝氨酸(L-serine)、草酸(oxalic acid)和3-羟基丁酸(3-hydroxybutyric acid);逍遥散在不同生物样本中差异代谢物(下调数<上调数)有8 个,分别为L-苯丙氨酸和琥珀酸(succinic acid)、丙酮酸、L-色氨酸和肌酐、L-谷氨酸、棕榈酸和氧化三甲胺。
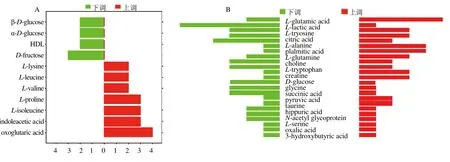
图3 逍遥散回调差异代谢物的变化趋势Fig.3 Histogram of Xiaoyao San callback different metabolites
3.3 差异代谢物的验证分析
如图4所示,CUMS 造模28 d 后,与对照组比较,模型组大鼠血清中血清素、去甲肾上腺素和γ-氨基丁酸水平显著降低(P<0.001),5-羟基吲哚乙酸和L-谷氨酸水平显著升高(P<0.001);与模型组比较,逍遥散组大鼠血清中血清素、去甲肾上腺素和γ-氨基丁酸水平显著升高(P<0.01、0.001),5-羟基吲哚乙酸和L-谷氨酸水平显著降低(P<0.001)。表明逍遥散能够逆转CUMS 引起的大鼠神经递质的变化。
3.4 差异代谢物的功能分析
通过对差异代谢物通路进行分析,发现逍遥散调节通路有47 条,如图5所示,分为能量代谢、神经系统、氨基酸代谢、其他氨基酸代谢、物质依赖性、辅助因子和维生素代谢、内分泌系统、消化系统等通路。其中能量代谢包含的通路有柠檬酸循环、丙酸代谢、半乳糖代谢、抗坏血酸和醛酸盐代谢、戊糖磷酸途径、硫代谢和氮代谢;神经系统包含的通路有逆行内源性大麻素信号、突触小泡周期、谷氨酸能突触、长期抑郁和胆碱能突触。
4 讨论
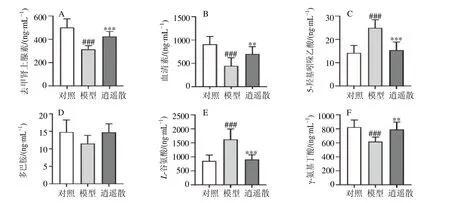
图4 逍遥散对CUMS 大鼠血清中去甲肾上腺素 (A)、血清素 (B)、5-羟基吲哚乙酸 (C)、多巴胺 (D)、L-谷氨酸 (E) 和γ-氨基丁酸 (F) 水平的影响 (x s,n=8)Fig.4 Effect of Xiaoyao San on levels of norepinephrine (A),serotonin (B),5-hydroxyindoleacetic acid (C),dopamine (D),L-glutamic acid (E),and γ-aminobutyric acid (F) in serum of CUMS rats (x s,n=8)
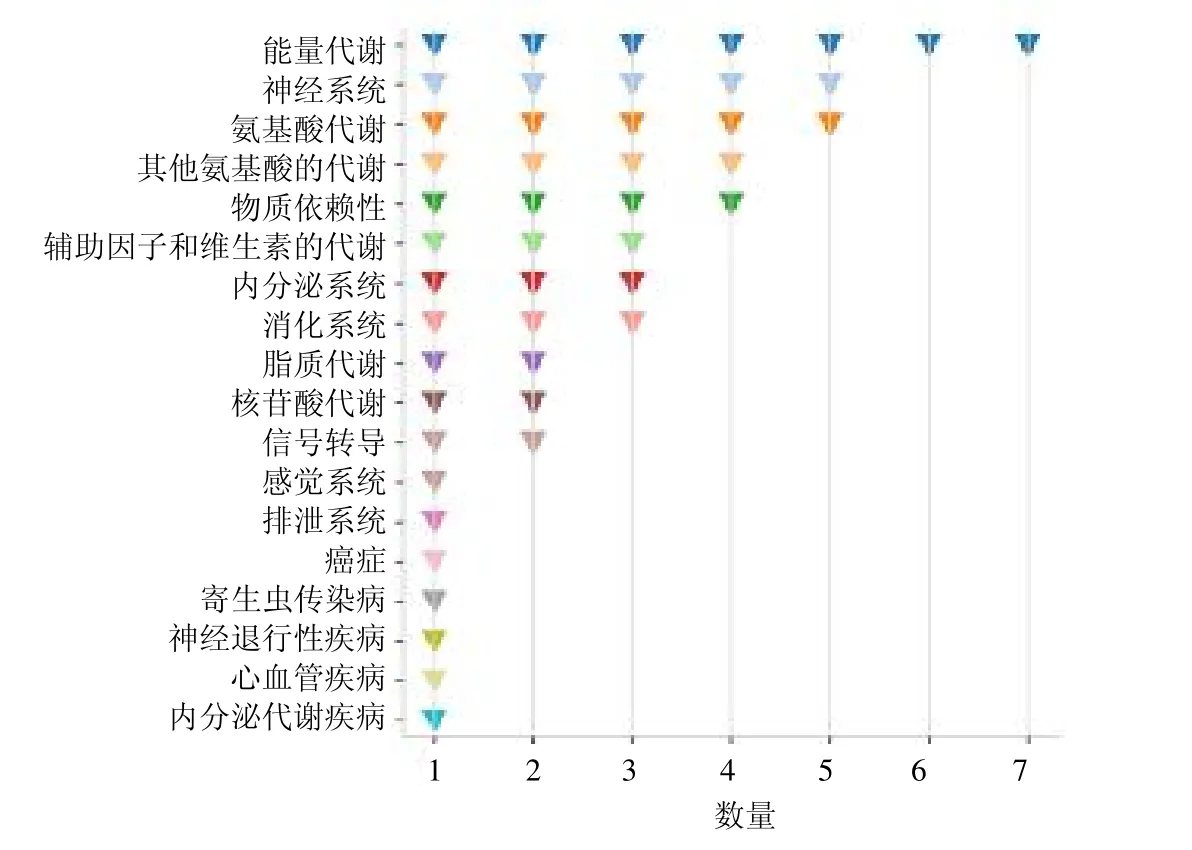
图5 逍遥散富集通路类点图Fig.5 Dot plot diagram of Xiaoyao San enrichment pathway category
本研究对动物的血液、尿液、海马、肝脏、盲肠、粪便和临床患者的血浆、尿液等生物样本中逍遥散具有显著调节作用的差异代谢物进行代谢特征综合分析,发现柠檬酸循环是逍遥散抗抑郁的重要通路之一。能量代谢障碍是抑郁症病因之一,研究发现,脾虚及能量代谢障碍是抑郁症发病的关键病机[31];线粒体能量代谢障碍在抑郁症发病机制中发挥关键作用[32]。课题组前期研究发现逍遥散能够治疗抑郁症核心症状即情绪低落,还能明显改善患者疲劳症状[33];逍遥散中多个成分可通过钠钾ATP酶α1 及ATP 合酶α、β、γ 亚基等靶点,调节三羧酸循环通路,从而发挥抗抑郁作用[34]。逍遥散能够减少抑郁症患者或CUMS 模型动物耗能,调节三羧酸循环功能,从而全面使机体的能量代谢趋于正常状态。
神经递质通路是研发抗抑郁药物的重要通路。CUMS 抑郁模型动物中海马组织中血清素水平显著降低,以逍遥散干预后,血清素水平显著升高[35]。逍遥散低极性分离组分对大鼠脑突触体摄取血清素有明显抑制作用[36]。去甲肾上腺素水平在CUMS抑郁大鼠脑组织和体液中显著降低,逍遥散能够显著升高CUMS 抑郁大鼠脑组织和体液中去甲肾上腺素水平[35,37],表明逍遥散可能通过抑制脑突触体对去甲肾上腺素的重摄取发挥抗抑郁作用。CUMS抑郁模型大鼠脑中谷氨酸水平显著升高,N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体表达水平显著降低,NMDA 受体的过度激活,导致Ca2+内流引起神经元凋亡;以逍遥散进行干预后,NMDA 受体表达水平恢复至正常水平[38-39]。结果表明逍遥散可以通过调节神经递质通路发挥抗抑郁作用。
目前许多研究中无法获得原始数据代谢数据集或平均代谢物浓度[40],本研究采用vote-counting方法对逍遥散调节差异代谢物进行梳理[41-42]。传统的代谢组学关注少量的差异代谢物,而抑郁症是病因复杂的精神系统疾病,生物学功能的整合分析尤为重要,能够通过整合来自多个来源的数据在同一个生物背景下进行系统性分析,阐明逍遥散治疗抑郁症的机制[43-44]。因此,本研究采用多个差异代谢物相关的数据进行富集。
逍遥散抗抑郁代谢特征综合分析为逍遥散后续实验的设计提供系统分析,一些重要的差异代谢物及富集的代谢通路为深入研究逍遥散抗抑郁提供了方向。课题组后续将对本研究中发现的差异代谢物和代谢通路进行验证,包括靶标代谢组学验证,即以标准品为参照,对特定的差异代谢物群进行有针对性地、特异性地检测与定量分析;示踪代谢组学验证,即以13C 或15N 等原子标记的稳定同位素示踪辅助代谢组学技术研究抑郁症的特有代谢通路以及逍遥散的回调机制[45-46];功能代谢组学验证,采用分子生物学包括基因沉默或基因过表达等技术验证关键靶点[47-48]。抑郁症的生物学过程不仅仅通过代谢水平变化阐明[49]。因此,课题组后续将整合蛋白质组学和转录组学数据,进行多组学技术的关联分析,通过生物网络与网络药理技术,采用网络拓扑属性和模块分析差异代谢物相关的一系列重要的“成分-靶点-代谢物-生物途径”,阐明逍遥散与抑郁症多成分、多靶点的科学内涵。
综上所述,本研究发现能量代谢和神经递质通路是逍遥散发挥抗抑郁作用的主要通路,为系统挖掘逍遥散抗抑郁代谢机制提供依据。
利益冲突所有作者均声明不存在利益冲突

