人牙周膜干细胞条件培养液对MC3T3-E1细胞形态及增殖特性的影响
刘 焱, 赵晓霞, 王靖宇, 陈青宇, 仲 琳
牙周炎症会破坏牙周支持组织,若治疗不及时甚至会导致牙齿松动、脱落及口颌系统结构与功能受损[1]。它还与多种全身性疾病,如冠心病、糖尿病、慢性呼吸系统疾病、胃炎以及高血压等的发生、发展密切相关[2]。随着病程的进展,牙周炎症会引发牙槽骨细胞的一系列功能学变化,甚至导致细胞凋亡,这是牙齿丧失稳定性、咀嚼功能下降的最主要因素,因此,新生成骨对于牙周组织修复和再生尤为重要。有效治疗牙周炎症的关键是消除局部及全身刺激因素、控制感染,并使已丧失的牙周组织实现修复与再生[3]。组织工程理论、材料和技术的不断发展给牙周支持组织再生带来了新的机遇和挑战[4]。作为牙周组织工程研究中公认的首选种子细胞——人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)具有良好的组织同源性、自我增殖活力和多向分化潜能[5]。在适宜诱导条件下,hPDLSCs可以形成牙槽骨-牙周膜-牙骨质复合体结构,实现真正意义上的牙周组织再生[6]。然而,干细胞治疗存在着许多问题[7]:移植后生存能力降低;潜在的致瘤、致畸风险;包装、转运、贮存及治疗方法缺乏统一化、标准化等。来源于间充质干细胞(mesenchymal stem cells,MSCs)的条件培养基(conditioned medium,CM)富含其旁分泌的生物活性因子,且规避了干细胞移植的各种风险,是替代干细胞治疗的理想方案[8,9]。本研究通过酶消化组织块法获取原代hPDLSCs进行培养,鉴定细胞来源后制备hPDLSCs-CM。选用具有单一定向成骨分化生物学特性的小鼠胚胎成骨细胞前体细胞MC3T3-E1以hPDLSCs-CM对其进行干预,探讨干预组和常规培养组的细胞形态特征及增殖能力的改变情况,为其在牙周组织工程的应用提供科学依据。
1 材料与方法
1.1实验材料和仪器 选取16~18周岁因正畸治疗需拔除的健康前磨牙及第三磨牙52颗,由包头医学院第一附属医院口腔科提供。所有牙无龋坏、无牙髓及根尖周病变,无牙周疾病,无黏膜疾病。所有纳入个体无系统疾病。患者知情同意并签署同意书。DMEM培养基(Hyclon,美国);胎牛血清(fetal bovine serum,FBS)(Hyclon,美国);0.25%胰蛋白酶-乙二氨四乙酸(ethylene diamine tetraacetic acid,EDTA)(Hyclon,美国);青霉素(河北石家庄华北制药);链霉素(河北石家庄华北制药);Ⅰ型胶原酶(Sigma,美国);小鼠抗人角蛋白(pan cytokeratin,PCK)、小鼠抗人波形丝蛋白(vimentin)、小鼠抗人STRO-1单克隆抗体(Dako,丹麦);羊抗小鼠四甲基异硫氰酸罗丹明标记的免疫球蛋白G(immunoglobulin G-tetramethyl rhodamine isothiocyanate,IgG-TRITC)荧光二抗、荧光染料Hoechst33258(Sigma,美国);二甲基亚砜(dimethyl sulfoxide,DMSO)、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)、细胞周期与细胞凋亡检测试剂盒(碧云天)。倒置相差显微镜及照相系统(Olympus,日本);荧光显微镜(BX61+DP-71,Olympus,日本);SpectraMax M2酶联免疫监测仪(Molecular Devices,美国);FACSCanto Ⅱ流式细胞仪(BD,美国)。
1.2酶消化组织块法获取hPDLSCs并制备hPDLSCs-CM 对待拔牙体周围组织以75%乙醇充分消毒后,拔除牙齿,离体牙立刻置于含高倍双抗的DMEM培养基,送至超净台。采用磷酸缓冲盐溶液(phosphate buffer saline,PBS)充分冲洗根面3~5次后刮取根中1/3的牙周膜,修剪为约1 mm3大小的组织块,置于3 mg/ml的Ⅰ型胶原酶溶液中,37 ℃条件下作用1 h,离心弃上清,以含10% FBS的DMEM培养液吹匀所得沉淀,平铺于培养皿底部,置37 ℃、5% CO2细胞培养箱中进行培养。培养2 d后予首次全量换液,后每3 d换液1次。当细胞长至铺满培养皿底部70%~80%时进行消化、传代。当第3代hPDLSCs长满皿底约80%时,在无血清培养基条件下继续培养24 h后收集上清,即为hPDLSCs-CM,备用。
1.3免疫荧光染色法检测vimentin、PCK及STRO-1的表达情况 制备hPDLSCs的细胞爬片,应用免疫荧光染色技术检测细胞中vimentin、PCK和STRO-1的表达情况。PBS漂洗后,以预冷的4%多聚甲醛固定细胞30 min,1%牛血清白蛋白(albumin from bovine serum,BSA)封闭30 min,加入特异性一抗,孵育过夜。次日以PBS冲洗2~3次,避光加入二抗孵育1 h,以Hoechst33258对细胞核进行复染5 min,甘油封片、标记,镜下观察vimentin、PCK及STRO-1的表达情况。
1.4MC3T3-E1细胞的培养与干预 通过国家实验细胞资源共享服务平台购入MC3T3-E1细胞系,常规培养、传代,选取第4代生长旺盛的MC3T3-E1细胞用于后续干预实验。其中,干预组MC3T3-E1细胞在含50% hPDLSCs-CM +50%常规DMEM培养液(DMEM培养液+10% FBS)条件下进行培养;对照组在常规DMEM培养液中进行培养。
1.5不同处理组MC3T3-E1细胞的增殖能力检测 取生长状态良好的干预组和对照组MC3T3-E1细胞,以2×104cells/cm2密度接种于96孔板中,每孔100 μl,每组设5个重复孔。按各组培养条件继续培养1、3、5、7 d,培养结束后,每个孔加20 μl MTT溶液,37 ℃、5% CO2条件下继续孵育4 h,吸弃上清后再向各孔加入150 μl DMSO,振荡10~15 min。采用SpectraMax M2酶联免疫监测仪测定490 nm波长处各孔吸光光度值(OD值)。
1.6不同处理组MC3T3-E1细胞的细胞周期检测 分别收集干预组和对照组的MC3T3-E1各约3×106个,制成单细胞悬液,离心后加入70%乙醇吹打充分混匀,4 ℃过夜,每组设5个重复管。次日离心后吸弃乙醇上清,避光下各加入50 μg/ml的碘化丙锭1 ml,4 ℃环境下染色30 min,通过200目尼龙筛网,经FACSCanto Ⅱ流式细胞仪测定两组MC3T3-E1细胞的细胞周期。

2 结果
2.1hPDLSCs的形态观察及vimentin、PCK及STRO-1的表达情况 原代培养hPDLSCs 14 d可见细胞以组织块为中心,呈环绕、散在分布,细胞形态为长梭形或多边形、胞体丰满,贴壁生长(见图1ⓐ)。培养21 d后,细胞增多,可达80%汇合,形态均一,呈放射状、旋涡状紧密排列于组织块周围(见图1ⓑ)。传代后,细胞的形态特征与原代相同,呈成纤维细胞样长梭、多角形特征,束状整齐排布(见图1ⓒ)。经免疫荧光染色可见hPDLSCs中vimentin阳性表达,胞浆红染,胞核蓝染(见图2ⓐ);PCK阴性表达,胞浆未被染色,仅见胞核蓝染(见图2ⓑ)。提示hPDLSCs为间充质来源,未有上皮细胞污染。STRO-1阳性表达,胞浆绿染,胞核蓝染(见图2ⓒ)。

ⓐ原代培养14 d;ⓑ原代培养21 d;ⓒ传代培养的hPDLSCs

ⓐvimentin表达阳性,胞浆红染,胞核蓝染;ⓑPCK表达阴性,胞核蓝染;ⓒSTRO-1表达阳性,胞浆绿染,胞核蓝染
2.2两组MC3T3-E1细胞的形态观察结果 镜下可见干预组和对照组细胞的形态一致、均为长梭形或多角形,细胞呈“漩涡状”紧密排列,CM处理组的细胞数量较对照组明显增多。见图3。

ⓐCM处理组;ⓑ对照组
2.3两组MC3T3-E1细胞的增殖能力比较 两组MC3T3-E1细胞的数量及增殖活性均随培养时间的增长呈现上升趋势。在培养第3天、第5天和第7天,干预组OD值均显著大于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组MC3T3-E1细胞的增殖能力比较值]
2.4两组MC3T3-E1细胞的细胞周期情况 干预组和对照组处于G0/G1期的细胞比例分别为(65.50±0.28)%和(78.82±0.86)%,两组比较差异有统计学意义(t=32.943,P=0.000)。两组处于G2/M+S期的细胞比例分别为(31.43±0.59)%和(19.11±0.24)%,两组比较差异有统计学意义(t=43.393,P=0.000)。说明hPDLSCs-CM更能促进MC3T3-E1进入DNA合成期,发生细胞分裂、加速增殖。见图4。
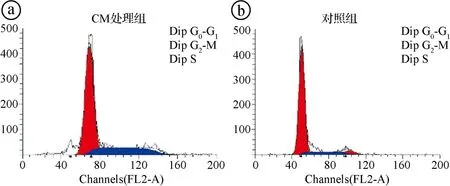
图4 流式细胞仪检测两组细胞周期结果图
3 讨论
3.1《全国第四次口腔健康流行病学调查报告》显示,我国成人组和老年组的牙周健康率均低于10%,55~64岁年龄段人群的牙周健康率更是仅为5%,这说明牙周病的防治已成为亟待解决的口腔健康问题。在控制感染的同时获得牙周支持组织的再生、重建是牙周病治疗的终极目标。牙周治疗可以有效清除致病菌,延缓、阻止牙周炎的进展,但受制于机体修复的自限性,病变区域难以获得牙周组织的新生[10]。引导组织再生技术虽然可以获得一定的牙周附着和骨内缺损修复,但目前仍存在易形成长结合上皮、再生硬组织的功能较差、手术适应证窄、生物膜降解时易塌陷等问题[11],对于牙周组织的正常结构和功能的构建,远未达到医师和患者所期望的理想结果。
3.2相较于传统治疗方法,组织工程技术利用干细胞的定向分化潜能发挥修复作用,给牙周组织修复和再生提出了新思路。有研究[12]通过体内示踪植入的MSCs发现,仅有<1%的干细胞归巢并定植于病变缺损区发挥促进组织再生的作用,而绝大多数的MSCs仅附着于待修复组织的表面,这说明直接发挥生物学功能、参与组织再生和修复的主要细胞并不是MSCs。另有研究[13]表明,比起“分化、替代受损细胞”,再生过程中移植的干细胞主要通过旁分泌机制释放多种生物活性分子(如趋化因子、生长因子等),从而构建、优化局部微环境,趋化病变周围的健康干细胞/祖细胞迁徙至损伤部位进行增殖、分化,减少受损细胞发生凋亡和炎性反应,促进组织新生血管,并可通过调节细胞免疫功能等多重效应诱导组织再生。Osugi等[14]将人MSCs-CM作用于小鼠颅骨缺损模型,经CT检查发现,干预后颅骨骨量生成增多;同时体内细胞示踪技术发现,经MSCs-CM处理后被标记的小鼠MSCs迁移到病变缺损区的细胞量显著增多,并能检测到明显的血管新生。上述研究结果均表明MSCs-CM可以调动内源性MSCs的归巢,并能正向调节血管新生和新骨形成。
3.3本研究通过酶消化组织块法获得hPDLSCs,并经免疫荧光染色证实所得细胞呈现vimentin阳性表达、PCK阴性表达的状态,说明其来源于间充质,而非上皮来源。目前尚无明确的研究结论给出一种或几种特殊的hPDLSC标志物。2004年,Seo等[5]最早成功分离获得hPDLSCs,并使用早期间MSCs的标志物STRO-1等作为其标志物。本研究也发现所得hPDLSCs呈现STRO-1阳性表达,以此验证细胞来源。
3.4MC3T3-E1细胞具有单一定向成骨分化的各种生物学特性,因而被广泛应用于成骨相关的体外细胞实验研究中[15]。MC3T3-E1细胞形态符合成纤维细胞样特性,为长梭形或多角形,生长特性为贴壁生长。经hPDLSCs-CM干预作用后,MC3T3-E1细胞形态与常规培养组的细胞形态一致,均为长梭形或多角形,说明hPDLSCs-CM不会导致MC3T3-E1细胞形态特征发生改变。类似结果在许多干细胞条件培养基的研究中被证实[7,14],这可能与MSCs的旁分泌功能密切相关。MSCs生长过程中会将一些活性物质,如生长因子、血管生成因子、激素、细胞因子、细胞外基质蛋白、细胞外基质蛋白酶和激素等分泌到培养环境中,这些活性物质不仅对维持干细胞自身的未分化状态和存活具有关键作用,还可以影响其他细胞的生长和(或)功能,保持其原有的典型的细胞形态,且不会明显改变细胞体积[16]。细胞增殖能力是反映生物学活性的重要指标之一,组织的生长、修复与重建都需要依靠细胞的增殖来完成[17]。本研究通过MTT法和细胞周期分析检测hPDLSCs-CM对MC3T3-E1细胞增殖活力的影响,结果显示,hPDLSCs-CM干预可促进MC3T3-E1细胞增殖,且可正向促进MC3T3-E1细胞进入DNA合成期,加速细胞发生有丝分裂。类似结果也在其他的体内、外实验中得以证实。Hendudari等[18]发现联合骨髓MSCs-CM与激光有利于人皮肤成纤维细胞在高糖培养基中的生长。Nagata等[19]将牙周膜干细胞CM植入大鼠牙周缺损组织,获得了较好的牙周组织再生,并且缺损的再生效果与条件培养液的浓度显著相关。这些效应与MSCs-CM的趋化性能、免疫调节功能、细胞生长支持功能、抗细胞凋亡及血管生成功能等相关,但具体的机制尚无定论,有待进一步研究。
综上所述,本实验证实了hPDLSCs-CM干预可在不改变MC3T3-E1细胞形态特征的情况下增强其增殖能力。为研究干细胞衍生物CM应用于牙周疾病及修复骨组织缺损的临床治疗提供了参考依据。但是,本研究对于具体干细胞培养液的内容物质没有进行深入检测,后续实验还将进一步在体外细胞水平及牙周炎的动物模型中验证hPDLSCs-CM对于成骨效应所发挥的作用。

