基于SNaPshot技术对ABO血型亚型分型的方法
牛晓珂,石 宏
(昆明理工大学灵长类转化医学研究院,云南 昆明650093)
0 引言
自1900年Karl Landsteiner发现ABO血型系统[1]到今天,国际输血协会已正式报道了39种血型系统[1],其中ABO血型在遗传学研究、临床输血和移植免疫领域中具有重要意义.除了常见的ABO血型外,血型抗原基因突变数据库(Blood Group Antigen Gene Mutation Database,BGMUT)已收录超过390个ABO等位基因[2].目前研究表明单核苷酸多态性(Single Nucleotide Polymorphism,SNP)是引起ABO基因突变的主要原因[3],除此之外,还包括其他突变机制,例如核苷酸片段缺失或插入[4]、基因重组和交换等[5-6].
目前,临床鉴定ABO血型主要依赖于传统血清学方法,该方法是较为廉价、快速和标准化的鉴定方法,然而,抗原、抗体的凝集强度在不同亚型中会产生变化,从而导致漏检或误定,将血型不匹配的血液输给患者可能会引起溶血性输血反应等严重后果,必须通过基因分型来鉴别亚型才能实现患者和供体血型的完美匹配,这是传统血清学不能达到的标准[7].目前实验室对ABO亚型进行鉴定时使用基因技术主要有聚合酶链式反应序列特异性引物(PCR-SSP)[8]和基因测序法[9]等.其中PCR-SSP技术的应用最为广泛,然而该技术会产生假阳性等错误,导致其结果与血清学结果和基因测序结果不一致[10],具有一定的局限性.DNA测序技术可以提供精确的核苷酸序列信息,是基因检测的金标准[11],其优点显而易见,缺点是成本较高,且受到实验室仪器条件限制,无法在一个反应内对远距离的SNP同时进行鉴定,一般只用于验证新发现的等位基因.上述两种方法存在一个通病,通量低,面对大批量样本略显乏力,因此需要继续发展或改进现有方法,以提高对血型鉴定的准确度.
可以快速筛选出成千上万SNP的高通量技术的出现,使得市场上自动化系统数量急剧增加和基因分型成本降低[12-14].由于SNP是引起ABO基因突变的主要原因,因此这些新系统的出现对血型的基因分型产生了巨大的影响,大大地提高了血型分型的准确度,特别是针对抗原的弱表达或突变[15].目前,已有许多研究结果表明,利用不同类型的基因分型技术对多个与血型和血小板抗原相关的SNP进行基因分型是可行的[15-19],且在大批量样本下依旧可保持高准确率.
SNaPshot技术又称微测序,是一种基于荧光标记单碱基延伸原理的分型技术[20].应用SNaPshot技术进行SNP序列分析的基本原理与DNA直接测序中的双脱氧终止法一致,不同的是SNaPshot技术延伸反应中只有不同荧光标记的ddNTP.设计单碱基延伸引物时每个SNP的引物3′端都紧靠SNP,在聚合酶作用下根据模板序列仅结合一个含有荧光标记的ddNTP,通过测序仪检测延伸ddNTP的荧光颜色即可实现SNP的分型,其中纯合子表现为单峰,杂合子表现为双峰.为分辨不同SNP的基因型,在引物的5′端加上不同长度的Poly尾巴区分各SNP,从而实现多个SNP的同时检测,且该技术可以对核苷酸序列进行分析,相对于测序技术又具有成本低,通量高,不受SNP之间的距离限制等优势[21],所以在血型鉴定方面SNaPshot技术是一种极为有效的方法.
因此,本研究针对近几年昆明地区无偿献血者中所发现的ABO亚型及常见ABO血型选取了9个SNP位点(见表1)利用SNapShot技术建立了一种针对多种ABO亚型的检测方法,以弥补上述ABO血型分型技术的缺陷,并对50例外周血进行检测以验证该方法的准确性.
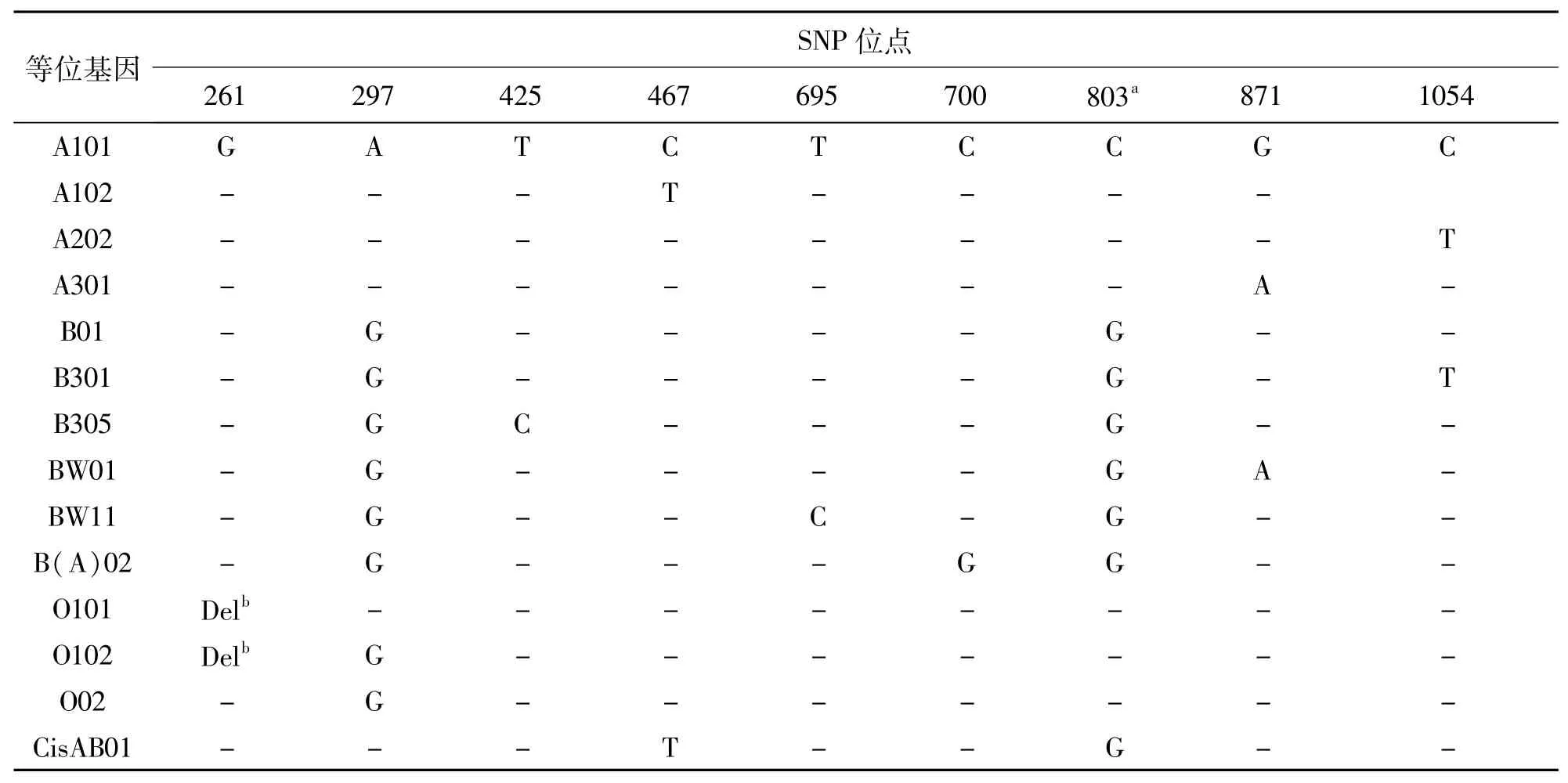
表1 ABO基因9个SNP的序列特征Tab.1 The 9 SNP loci of ABO gene
1 材料和方法
1.1 样本及基因组DNA提取
50名无关个体外周血样本由昆明血液中心提供,抗凝剂为EDTA-Na2.所有样本已由昆明血液中心通过血清学、PCR-SSP和测序等方法进行ABO血型鉴定,其结果用于检测本研究中所建立方法的可靠程度.外周血样本基因组DNA采用天根血液/细胞/组织基因组DNA提取试剂盒提取.
1.2 方法
1.2.1 PCR引物设计及ABO基因扩增
使用NCBI Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LIN-K_LOC=BlastHome)[22]设计了四对特异性PCR引物(见表2)用于扩增ABO基因,以及9个SNP位点的单碱基延伸引物(见表3),由昆明硕擎生物技术公司合成.
ABO-E6包含位点nt261和297,ABO-E7a包含位点nt425和467,ABO-E7b包含位点nt695、700、803和871,ABO-E7c为包含位点nt1054.
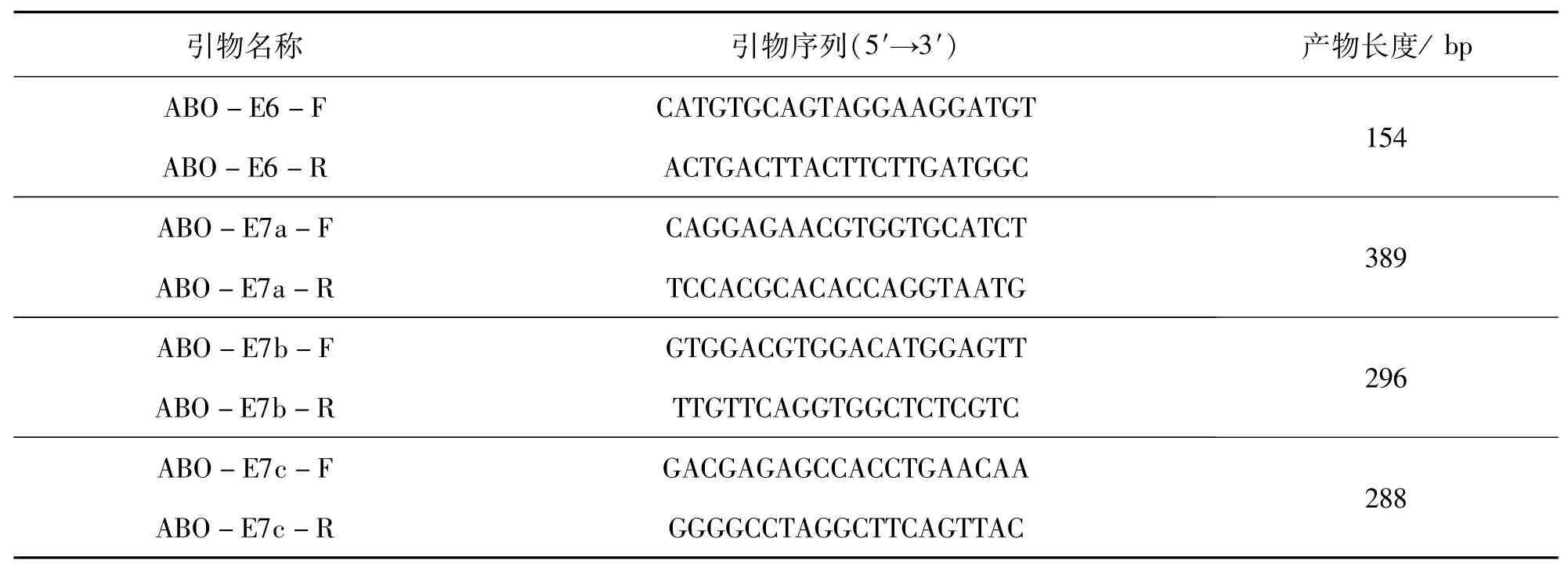
表2 用于ABO基因的特异性PCR引物序列Tab.2 Primers for PCR of ABO gene
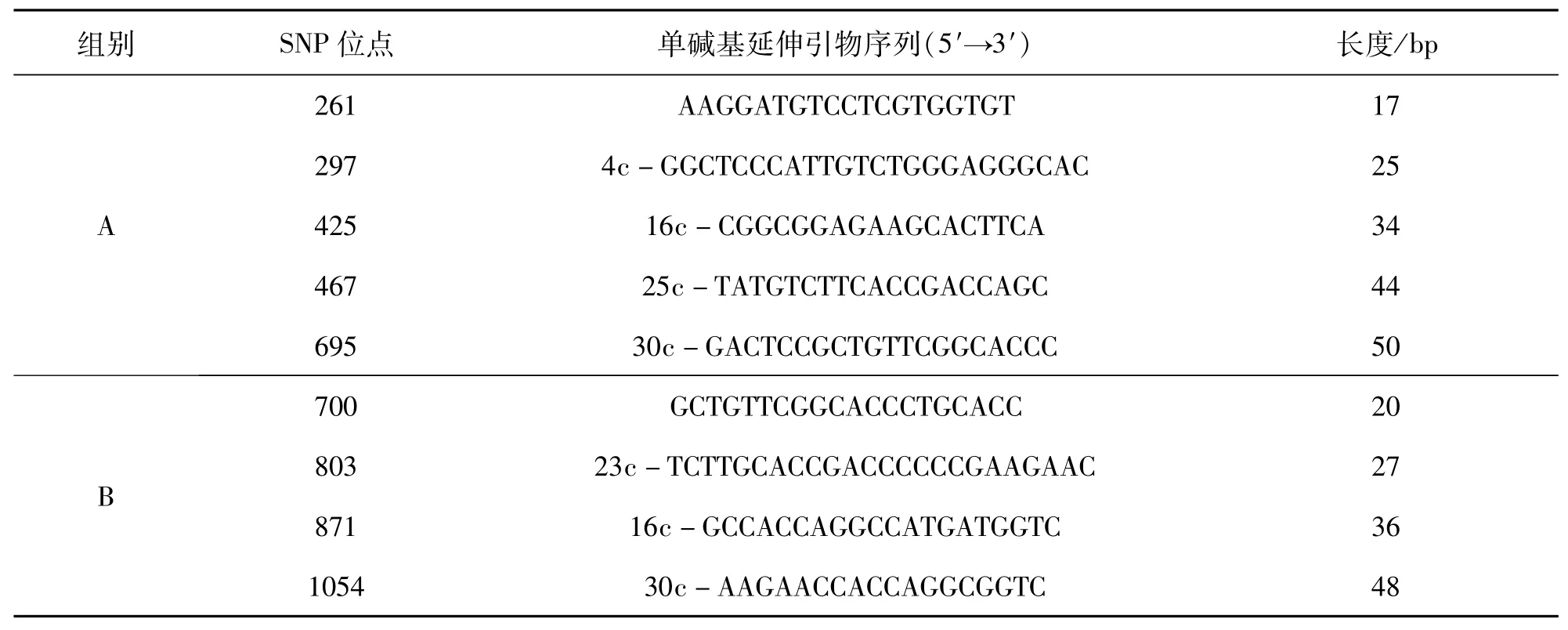
表3 单碱基延伸引物序列Tab.3 Primers for single base extension
1.2.2 PCR反应及产物纯化
PCR反应体系总体积10μL,其中包括样本DNA1μL(约10ng),上下游引物各0.5μL,2×Ex Taq Buffer(TaKaRa公司)5μL,ddH2O 3μL.PCR反应条件为95℃5min,95℃30s,59℃30s,72℃20s 35个循环;72℃5min.然后对PCR产物进行纯化,纯化体系含有1 U/μL虾源碱性磷酸酶(Phosphatase alkaline shrimp,SAP,Roche)2μL,10 U/μL核酸外切酶(Exonuclease I,Exo-I,Roche)0.1μL,ddH2O 0.9μL;根据SNP位点的分布各取1μL产物加入到3μL纯化体系中混匀,37℃60min,85℃15min,4℃保存.
1.2.3 SNapShot检测
使用SNaPshot Multiplex试剂盒(美国AB公司)进行单碱基延伸反应.反应体系为5.4μL体系包括纯化后PCR产物1μL,ddH2O 1.6μL,SNaPshot Multiplex Ready反应混合物1μL,BigDye 5×Seq缓冲液0.8μL,延伸引物混合物1μL.反应程序为95℃1min;95℃10s,50℃5s,60℃30s,25个循环.获得单碱基延伸产物后对其进行纯化,在产物中直接加入1U/μL SAP 1μL,在PCR扩增仪上运行如下程序:37℃60min,85℃15min.取1μL产物加至9μL甲酰胺-内标混合液(甲酰胺和内标体积比例为10∶0.1)中,以GeneScan-120 Liz(美国AB公司)为内标,95℃变性5min,冰浴1min后上样.使用3130型遗传分析仪(美国AB公司)进行毛细管电泳,通过Genemapper v5.0软件分析数据.
2 结果
通过单碱基延伸反应将带有荧光标记的ddNTP添加至单碱基延伸引物3′端,经测序仪检测后,根据荧光颜色可识别不同的等位基因,根据荧光信号产生位置区分单碱基延伸产物对应的SNP位点.
经SNaPshot技术检测,50个样本的基因分型结果与昆明血液中心所提供结果一致.本次检测共测出10种ABO等位基因分别为A101、A102、B01、B305、Bw11、O101、O102、O02、B(A)02、CisAB01;检测到16种不同的基因型,其中包括A型4种(见图1),分别为A101/A102、A101/O101、A101/O102、A102/A102;B型4种(见图2),分别为B01/B01、B01/O101、B305/O101、Bw11/O101;AB型3种(见图3),分别为A101/B01、A101/B305、A102/B01;O型3种(见图4),分别为O101/O101、O101/O102、O102/O102;特殊亚型2种(见图5),分别为B(A)02/O101、CisAB01/O2.
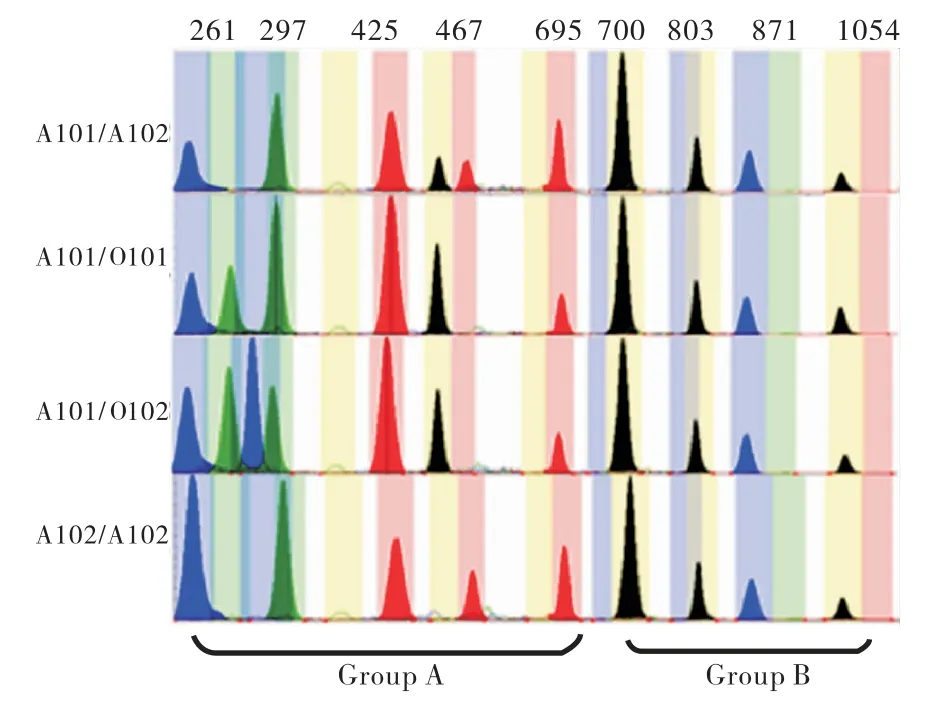
图1 A血型4种基因型的毛细管电泳图谱Fig.1 The capillary electrophoresis map of four genotypes of blood type A(Blue peak:G;Black peak:C;Green peak:A;Red peak:T)
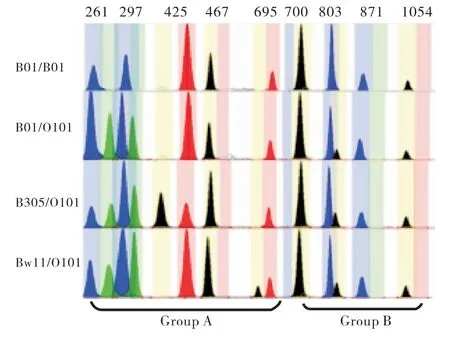
图2 B血型4种基因型的毛细管电泳图谱Fig.2 The capillary electrophoresis map of four genotypes of blood type B(Blue peak:G;Black peak:C;Green peak:A;Red peak:T)
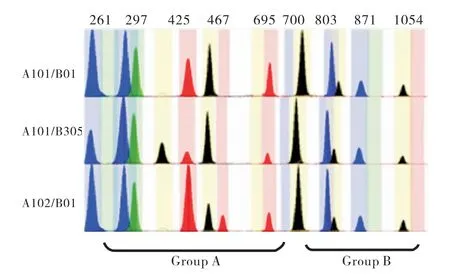
图3 AB血型3种基因型的毛细管电泳图谱Fig.3 The capillary electrophoresis map ofthree genotypes of blood type AB(Blue peak:G;Black peak:C;Green peak:A;Red peak:T)
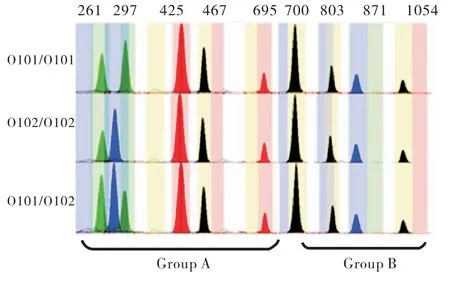
图4 O血型3种基因型的毛细管电泳图谱Fig.4 The capillary electrophoresis map of three genotypes of blood type O(Blue peak:G;Black peak:C;Green peak:A;Red peak:T)
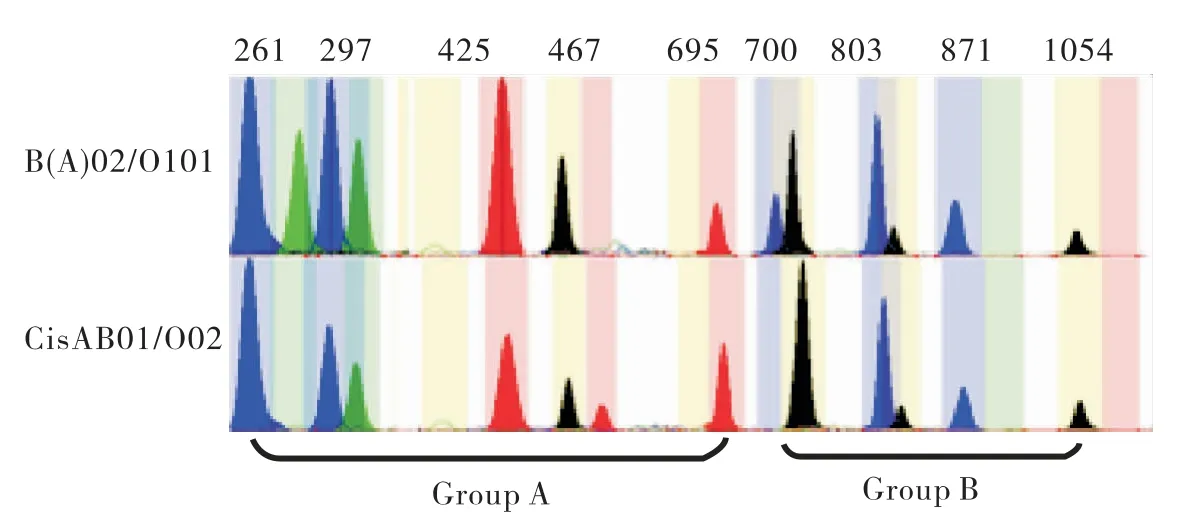
图5 罕见亚型2种基因型的毛细管电泳图谱Fig.5 The capillary electrophoresis map of two genotypes of rare(Blue peak:G;Black peak:C;Green peak:A;Red peak:T)
3 讨论
本研究通过erythrogene数据库[23]所提供的ABO基因表型与突变位点信息建立了一种基于SNaPshot技术对ABO血型亚型进行鉴定的方法,并成功鉴定出10种等位基因(A101、A102、B01、B305、Bw11、O101、O102、O02、B(A)02、CisAB01),且准确率到达100%.当发现新的等位基因突变位点后,在已有的实验基础上增加荧光信号,可以实现更多ABO亚型的同时检测,为更多稀有的ABO血型的快速遗传分型提供可能,该方法具有通量高、自动化程度高、不受SNP位置距离限制和成本相对低廉等优点,而且可以准确地检测出SNP的基因型,准确有效地对ABO亚型进行分型.同时对其他血型系统构建基因检测方法提供了参考,为实现更快捷准确的血型匹配提供了数据支撑.云南作为全国拥有少数民族最多的地区,提供了丰富的血型资源,本研究对昆明血液中心提供的样本进行的研究为中国人群血型基因分型的临床应用奠定了一定的基础.
ABO亚型的形成是由单核苷酸多态性或者核苷酸片段缺失或插入、基因重组和交换等引起的,例如O型血是由于ABO基因第6外显子上(261delG)鸟嘌呤缺失,导致所编码的糖基转移酶失活无法修饰H抗原所产生的[24];A307基因型则是由ABO血型基因第7外显子的突变(745 C>T)导致α-1,3-N-乙酰半乳糖胺基转移酶酶活性降低,产生A3表型[25].尽管由ABO亚型引起的溶血反应不常见,但ABO亚型会对输血的安全性和有效性产生严重的影响.在鉴定时,亚型与亚型之间经常由于各种原因(例如:试剂、实验室条件、实验人员经验水平等)而被错误判断,例如B(A)表型是一种罕见的ABO亚型可能会被误判为AB,通常是因为在红细胞上检测到了A抗原;而且B(A)表型在传统血清学检查中很容易与CisAB表型和AxB表型混淆.这些亚型都具有独特的血清学特征:CisAB与O表型杂合时B抗原较弱,H抗原较强,A抗原表达强度介于A1B与A2B之间,血清中含有较弱的抗-B,血清学常表现为A2B3或者A2BX型[26-27].而在B(A)表型中B抗原水平几乎正常,与抗-H血清和-B血清凝集反应较强;A抗原则较弱,与抗-A1、人源抗-A及一些单克隆抗-A凝集反应较弱,B(A)血清中的抗-A可以凝集A1和部分A2细胞[28].AxB血清中的抗A1可以凝集A1细胞,但不能凝集A2细胞.因此,本研究建立了基于SNaPshot技术对ABO亚型分型的方法用于对ABO亚型进行准确分型,以弥补国内输血实验室现有技术的缺陷.
ABO血型的准确分型至关重要,不仅关系到输血安全,同时可以预防新生儿溶血(HDFN)和造血干细胞、器官移植排异反应等副作用或疾病[7],并可对需要多次输血疾病(如镰状细胞性贫血、β-地中海贫血、自身免疫性溶血性贫血)的治疗提供帮助.
4 结论
通过本实验可以得到以下结论:
1)建立了一种基于SNaPshot技术对ABO血型亚型分型的方法,为ABO血型亚型的分型提供了一种可行的实验方法.
2)通过本方法检测出10种ABO等位基因分别为A101、A102、B01、B305、Bw11、O101、O102、O02、B(A)02和CisAB01.
3)通过本方法检测出16种不同的基因型,其中包括A型4种,分别为A101/A102、A101/O101、A101/O102和A102/A102;B型4种,分别为B01/B01、B01/O101、B305/O101和Bw11/O101;AB型3种,分别为A101/B01、A101/B305、A102/B01;O型3种,分别为O101/O101、O101/O102和O102/O102;罕见亚型2种,分别为B(A)02/O101和CisAB01/O2.

