千岛湖有色可溶性有机物的生物可利用性特征及其环境指示意义
李元鹏,张柳青,江 威,石 玉,郭燕妮,周 蕾,4,周永强,4*,张运林,4
1. 中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008 2. 聊城大学环境与规划学院,山东 聊城 252059 3. 淳安县环境保护监测站,浙江 淳安 311700 4. 中国科学院大学,北京 100049
引 言
天然水生生态系统广泛存在的溶解性有机物(dissolved organic matter,DOM)是全球最大的有机碳库之一。有色可溶性有机物(chromophoric dissolved organic matter,CDOM)是DOM中能够强烈吸收紫外辐射及蓝光波段的那部分有机物,其组成结构十分复杂[1-2]。目前国际上常用在254或350 nm处的吸收系数,亦即a254或a350来表征CDOM浓度; CDOM吸收光谱斜率S275-295及比紫外吸收SUVA254等值被广泛用以表征CDOM芳香程度的高低,其中CDOM陆源芳香信号随S275-295升高而降低,随SUVA254升高而增强[2-4]。借助三维荧光光谱技术可获得一系列有机物的荧光峰。平行因子分析法(parallel factor analysis,PARAFAC)可从重叠错交、种类繁多的荧光峰中提取出具有单一发射波长的若干个不同的荧光组分,用于探究CDOM来源及迁移转化规律[5]。微生物降解广泛存在,在以往光降解的研究中很难彻底去除微生物降解的影响,加之DOM的生物可利用性与水体中重金属、有机污染物等的迁移转化息息相关,因此微生物降解对CDOM浓度和结构的改变方式及其程度值得深入探究[6-7]。在一定时间内(通常为28 d)能被微生物降解利用的那部分DOM被称为生物可降解溶解性有机物(BDOM)。作为CDOM循环中的最活跃的参与部分,BDOM迁移转化过程对碳循环过程及气候变化的影响也具有一定的指示意义[8]。CDOM各荧光组分在微生物降解过程中的归宿往往与湖泊的光学性质、初级生产力高低、有机物结构特征等多因素相关[9-10]。千岛湖位于浙江省淳安县(图1),是典型的深水型人工湖泊。该湖有机物来源相对简单,同时,具有水下光化学条件较好、初级生产力较低的自身特点,探究该湖CDOM生物可利用性特征对掌握水源型湖泊有机物迁移转化规律具有一定指示意义[1-2]。

图1 千岛湖采样点位置Fig.1 Location of sampling sites in Lake Qiandao
通过对比分析微生物培养前后CDOM光谱特征,试图揭示该湖CDOM生物可利用性特征并指出对水源型湖泊有机物迁移转化规律的指示意义; 同时,探究微生物活动对荧光光谱在有机物估算及点源污染识别应用中的影响。本研究对掌握清洁湖泊CDOM归趋,以及微生物活动对千岛湖水质监测的影响具有重要的实际指导意义。
1 实验部分
1.1 样品采集与微生物降解培养实验

1.2 Chla和SDD的测定
叶绿素(chlorophyll-a,Chla)采用分光光度法予以测定,使用90%的热乙醇提取叶绿素并使用岛津公司生产的UV-2550(UV-Vis)的分光光度计测定665及775 nm处吸光度再经换算得到Chla浓度,透明度(secchi disk depth,SDD)使用30 cm塞氏盘测定。
1.3 CDOM参数测定
1.3.1 样品预处理及CDOM吸收光谱的测定
微生物降解培养前后的样品在测量前均先使用0.22 μm孔径Millipore滤膜过滤,再将滤后水置入仪器进行检测,获得每个样品培养前后CDOM的吸收光谱和荧光光谱。
CDOM的吸收光谱采用岛津UV-2550 UV-Vis分光光度计测定,使用5 cm比色皿,以Milli-Q水为空白对照,在200~800 nm范围内每间隔1 nm测量CDOM的吸光度。为消除潜在散射效应,扣除700 nm处吸光度,然后根据式(1)计算对应波长的吸收系数
a(λ)=2.303D(λ)/r
(1)
式(1)中,a(λ)为CDOM在波长λ处对应的吸收系数(m-1);D(λ)为扣除700 nm处吸光度后在波长λ处的吸光度;r为光程路径(m)。S275-295是由275~295nm波长范围内拟合得到的指数函数的光谱斜率。
1.3.2 三维荧光光谱测定及平行因子分析
采用F-7000型荧光光度计进行样品测定。拉曼散射校正,瑞利散射校正,内滤波效应方法参见文献[1-2]。HIX的计算方法参见文献[4]; 该指数越大CDOM腐殖化程度越高。采用MATLAB 2015b的drEEM工具箱(ver.0.2.0)进行平行因子分析,共选取120个(培养前后各60个)EEMs矩阵进行运算,最终确定3个组分模型能很好地通过对半检验。
1.4 数据处理
使用SPSS 23.0软件计算平均值、标准差以及独立样本差异性显著水平t检验,使用ArcGIS 10.2进行空间插值分析,其他统计图使用Origin 20196进行绘制。
2 结果与讨论
2.1 平行因子分析所得荧光组分
经平行因子分析获得3种荧光组分,分别是C1(Ex: 255 nm,Em: 420 nm)为陆源类腐殖酸对应于A峰; C2(Ex: 275 nm,Em: 340 nm)和C3(Ex: 230(295) nm,Em: 340 nm)为类色氨酸对应T峰[2,5](图2)。
2.2 水质参数、CDOM各指标培养前后平均值及其显著性差异
千岛湖Chla浓度平均值及标准差(4.53±0.18) μg·L-1,SDD平均值及标准差(4.7±1.2) m,该湖Chla浓度较低而透明度较高。经微生物降解培养后,千岛湖a254平均值显著减小(t-test,p<0.01,剔除3个异常值),由培养前(4.4±0.8) m-1降低至(3.8±0.9) m-1,以a254表征CDOM浓度,微生物降解的CDOM占比为14.3%±4.8%(范围4.3%~23.6%)。微生物降解致使HIX显著增大而S275-295值显著减小(t-test,p<0.001),说明微生物降解培养致使千岛湖CDOM浓度降低芳香性升高; 三种荧光组分荧光强度平均值均显著减小(t-test,p<0.001),说明三种荧光组分均发生降解(表1)。

图2 平行因子分析所得3个荧光组分光谱特征Fig.2 Spectral shape of the three fluorescent components identified using PARAFAC
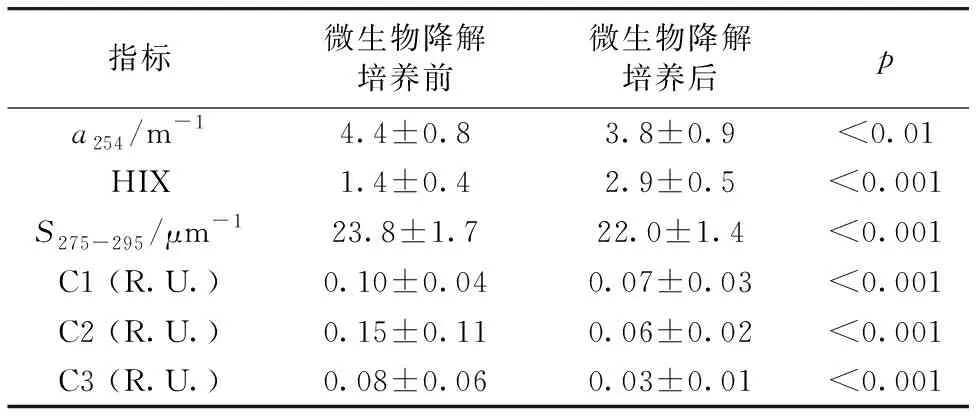
表1 微生物降解培养前后各水质参数、各组分荧光强度平均值及差异显著性水平t检验
2.3 CDOM光学参数的空间分布
结果表明微生物降解培养前a254及陆源类腐殖酸C1高值均主要集中在上游西北湖区。而类色氨酸C2高值主要集中在湖心区及东南湖区,类色氨酸C3主要集中在湖心区及西北湖区。Δa254为培养前后吸收系数差值,用以表征经28 d微生物培养的CDOM生物可利用性高低。Δa254高值主要集中在东南湖区,说明东南湖区CDOM生物可利用性最高。用*a254表示经28 d微生物降解培养后CDOM浓度,*C1,*C2和*C3表示培养后对应的各荧光组分。*a254及陆源类腐殖酸*C1高值依然集中在西北湖区; 两种类色氨酸组分C2和C3分布特征发生改变,湖心区C2和C3高值均消失,东南湖区C2高值亦消失; 经生物培养后*C2和*C3分布特征与a254和*a254、陆源类腐殖酸C1和*C1均具有一致性,即高值主要分布在西北湖区(图3)。

图3 千岛湖CDOM光学参数生物培养前后的空间分布Fig.3 Spatial distribution of optical parameters of CDOM in Lake Qiandao
2.4 微生物降解培养前后荧光光谱变化及各组分生物可利用性
结果表明微生物降解培养致使千岛湖CDOM荧光信号发生明显变化,培养前类色氨酸C2为主要的荧光信号,其次是陆源类腐殖酸C1,再次为类色氨酸C3[图4(a)]; 培养后陆源类腐殖酸C1变为主要荧光信号,其次为C2再次为C3[图4(b)]。%ΔC1,%ΔC2和%ΔC3为各组分培养前后荧光强度差值占培养前各组分荧光强度比重,用以表示28 d生物降解培养后各荧光组分生物可利用性。微生物主要利用类色氨酸C2(%ΔC2平均值为54.1%±18.2%)和C3(%ΔC3平均值为53.2%±14.3%),%ΔC2和%ΔC3平均值不存在显著差异(t-test,p>0.05),陆源类腐殖酸C1生物可利用性最低(%ΔC1平均值及标准差为28.2%±9.1%)[图4(c)]。大部分站点三种荧光组分生物可利用性大于0,极少站点生物可利用性小于0,说明千岛湖CDOM三种荧光组分均以降解为主,极少累积[图4(c)]。
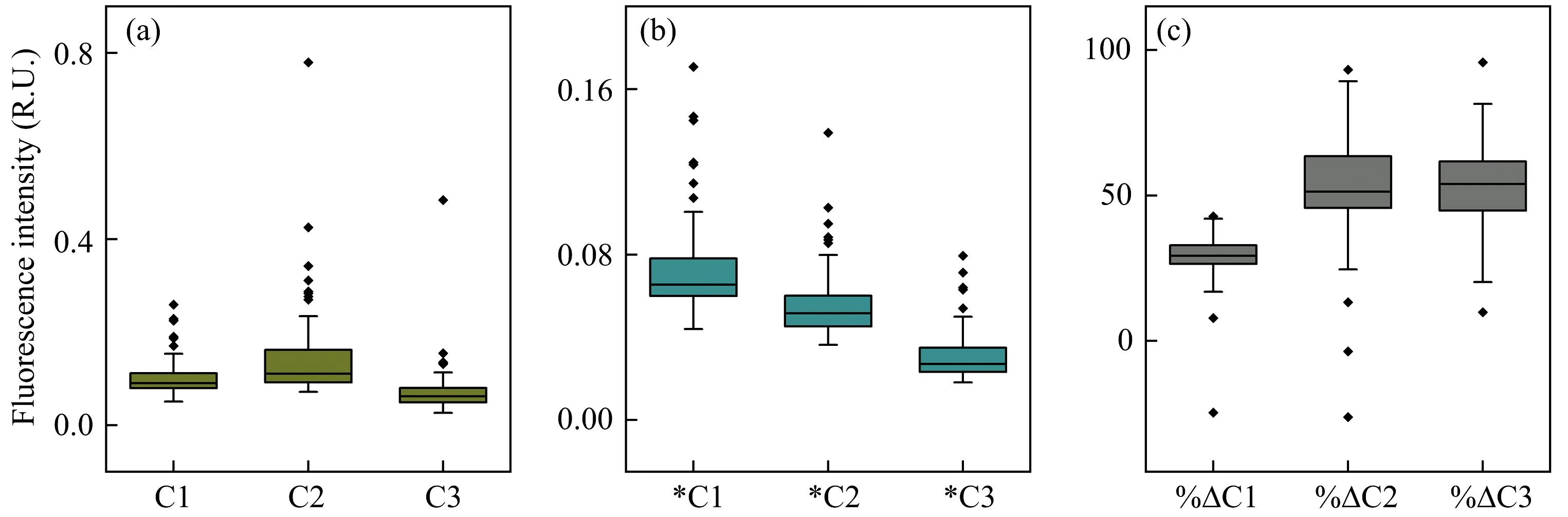
图4 各荧光组分生物可利用性及生物培养后荧光强度变化Fig.4 Biologically lability of each fluorescent component after 28 days of biodegradation
2.5 微生物降解培养前后各荧光组分与a254相关性分析
微生物降解培养前陆源类腐殖酸C1(r2=0.91,p<0.01)和类色氨酸C3(r2=0.55,p<0.01)与a254均为显著正相关,类色氨酸C2与a254无显著相关性(p>0.05)。培养后陆源类腐殖酸*C1(r2=0.91,p<0.01)、类色氨酸*C2(r2=0.46,p<0.01)和类色氨酸*C3(r2=0.88,p<0.01)与*a254均为显著正相关(图5)。

图5 28 d生物培养前后各组分荧光强度与a254相关性分析红色圆形及绿色三角形分别表示生物培养前后各组分与a254相关性Fig.5 Relationships between the three PARAFAC-derived components and a254 pre- and post-28 days biodegradation
2.6 千岛湖CDOM生物可利用性特征
本次研究表明类色氨酸C2和C3是千岛湖BDOM主要的贡献者。首先,C2和C3的生物可利用性平均值可达50%以上; 其次,a254能很好的评估湖泊的营养水平,基于光学原理获取的CDOM光谱比较稳定,a254能较好的表征水体中有机物浓度[12]; Δa254高值主要集中在东南湖区以及西北湖区,与类色氨酸C2及C3的空间分布具有一定相似性(图3)。以往研究表明上游新安江是千岛湖有机物的主要来源,湖心区及东南湖区类色氨酸大量赋存可能与淳安县生活污水的点源排放有关; 此外,陆源类腐殖酸是千岛湖主要的有机物组分,因而尽管C1生物可利用性相对低(28.2%±9.1%),但陆源类腐殖酸C1对该湖BDOM的也具有较大贡献[1,13]。部分研究指出类腐殖酸生物活性一般比较低,在生物降解过程中容易累积,尤其在营养程度较高,初级生产力较高的水体中类腐殖酸累积比较常见[8,14]。千岛湖陆源类腐殖酸具有一定的生物活性; 这可能与其透明度高,受到光辐射影响显著有关。以往研究表明光辐射可提高CDOM的生物可利用性,经过光照预处理后CDOM的生物利用度提高且微生物产量提高[10]。光照可致使类腐殖酸分解为类蛋白等物质[6]; 而微生物往往可快速地利用脂肪族,糖类、有机酸等[7,15],这在一定程度上解释了光照致使CDOM生物利用度提高的原因,然而光照能否直接提高类腐殖酸的生物利用性却在很大程度上未知。Gan等发现中国东海长江口附近水域陆源类腐殖酸生物活性较高,并将该现象归因于光辐射的影响[8]。马琼琳等的研究表明部分较难被生物利用的DOM经光辐照后其生物活性提高[16]。由于各种组分的生物活性存在差异,微生物降解培养致使千岛湖荧光光谱发生明显的改变,主要表现为削弱类色氨酸C2(T峰),保留类腐殖酸C1(A峰)。类色氨酸C2是千岛湖主要的荧光信号,其生物可利用性较高,经过生物培养后类色氨酸C2被大幅降解,陆源类腐殖酸C1的生物可利用性相对较低,因而得以保留(图4)。以往的研究也表明类蛋白荧光组分可被微生物快速的降解,类腐殖酸对生物降解具有一定的抵抗性,降解相对缓慢[7,15]。生物培养致使A峰替代T峰成为主要的荧光信号,这从本质上解释了以往研究中生物降解致使HIX值增大,S275-295值减小的原因[17]。
本次研究结果表明在生物降解过程中很可能存在类蛋白组分的新生。首先,经生物培养后类色氨酸C2和C3的高值区发生改变,生物培养前C2分布具有高度的空间异质性主要集中在东南湖区及湖心区,C3高值主要分布在湖心区及西北湖区(图3)。然而,经过生物培养后C2和C3湖心区及东南湖区高值消失,高值主要集中在西北湖区,表现出与a254及C1相似的分布特征,这在微生物降解培养后类色氨酸C2和C3与a254具有很好的相关性得以进一步验证(图3和图5)。这说明微生物在降解CDOM过程中可能会产生类色氨酸C2和C3,类色氨酸可能是类腐殖酸C1经微生物降解的产物,也可能来自微生物的分泌。一般而言类蛋白往往能在较短的时间内被微生物降解[7,15]; 然而,Kothawala等在3.5年黑暗环境中的长期生物培养实验中发现类腐殖酸发生一定程度的降解,而类蛋白类物质却未发生变化[18]。这一现象也在一定程度上说明微生物活动过程中伴随类腐殖酸的降解,可能会产生类色氨酸等蛋白质。以往研究表明类色氨酸在生物培养过程中消耗和生产同时发生,类蛋白峰存在先升高后降低的趋势[9]。千岛湖东南湖区CDOM浓度较低,主要聚集类色氨酸C2,在培养过程中该部分有机物被迅速消耗,而西北湖区有机物浓度较高,陆源类腐殖酸降解速率较慢,因此,可能存在微生物在消耗C1过程中产生C2和C3,进而使得C2和C3分布特征与C1相似。
2.7 CDOM微生物降解特征的环境指示意义
天然水体中的CDOM主要受光化学降解和微生物降解两方面作用。以往研究发现从千岛湖上游入湖口至下游大坝方向类腐殖酸占比降低而类蛋白占比升高,在该方向腐质化程度逐步降低,这在一定程度上归因于光化学降解的影响[13]。本次研究发现微生物活动可大幅度降解类蛋白组分,使腐殖化程度升高亦即芳香信号增强。避光培养实验可去除光化学降解的影响,Zhang等的研究表明9 d的自然光降解致使a254降低22%~34%,本次28 d微生物降解致使a254降低14.3%±4.8%,这说明在CDOM降解过程中光化学降解可能占据主导地位[6]。
水生生态系统的生物泵作用对碳循环的影响是近年来的热点问题。CDOM的生物可利用性对揭示碳循环过程具有一定的指示意义。以往研究表明湖泊通常扮演着碳汇的角色[19]。本次研究可在一定程度上说明相比于富营养化湖泊,清洁湖泊的碳汇功能可能会被削弱。首先,研究表明初级生产力在碳的固定及矿化过程中发挥着关键作用[8,14]; 本次研究中千岛湖Chla浓度较低,以往研究也发现在夏季藻类对该湖有机物的贡献依然比较有限[2],这说明清洁湖泊往往受营养盐限制初级生产力较低,因而藻类所固定的碳相对较少。其次,较高的透明度使得大分子有机物发生降解,或直接使其生物活性提高,进而提高微生物对有机物的利用量。再次,结果表明在水质清洁的千岛湖类色氨酸具有较高的生物可利用性,类腐殖酸也具有一定生物活性,且在生物培养过程中很少出现类腐殖酸的累积。以上微生物降解有机物过程中往往存在大量温室气体的释放[19]。然而,值得指出的是千岛湖作为深水湖泊,其蓄水量较大,换水周期较长; 上游新安江不断输入高浓度的有机物,因而该湖可能依然具有较强的碳汇作用[1,13]。
2.8 微生物降解对有机物估算的影响
以往研究表明,河流往往是内陆湖泊有机物的主要来源,陆源类腐殖酸更适于有机物的估算[1,13]。基于千岛湖CDOM特殊的生物可利用性,本次研究发现微生物降解对于陆源类腐殖酸组分估算CDOM的影响较小。首先,尽管陆源类腐殖酸可在一定程度上被微生物降解,然而经培养后C1依然与a254具有很好的相关性(图5); 其次,微生物降解培养后对C2削弱,对C1保留,这也进一步表明C1对有机物的估算能力受微生物降解的影响较小。Zhou等指出类色氨酸组分适于千岛湖点源污染的识别[2],本次研究发现微生物活动可大量降解类色氨酸,微生物降解培养后类色氨酸C2与C1具有相似的分布特征(图3)。因而,若在水滞留时间较长的枯水期,微生物降解可能会影响到类色氨酸对点源污染的识别能力。
3 结 论
(1) 千岛湖CDOM各荧光组分微生物降解培养过程中以降解为主,很少出现累积。类色氨酸和类腐殖酸均具有比较高的生物活性,类色氨酸的生物可利用性高于类腐殖酸。
(2) 千岛湖CDOM在东南出湖区域较其他湖区降解更明显,类色氨酸组分C2是BDOM的主要贡献者。
(3) 微生物活动致使千岛湖CDOM荧光光谱发生明显变化,表现为削弱T峰保留A峰。
(4) 微生物活动对陆源类腐殖酸估算有机物的影响很小,而对类色氨酸荧光峰识别点源污染具有一定影响。
致谢: 感谢张成英、史鹏程、季鹏飞、叶小锐等在野外采样及室内实验中提供的帮助。
——千岛湖站

