复方蜚蠊提取物缓解噁唑酮诱导大鼠活动期溃疡性结肠炎的作用机制
陈金虎 ,余万鑫,耿福能,张成桂,何 苗∗,巫秀美
(1.大理大学,云南省昆虫生物医药研发重点实验室,药用特种昆虫开发国家地方联合工程研究中心,中国西南药用昆虫及蛛形类资源开发利用协同创新中心,云南大理 671000;2.药用美洲大蠊四川省重点实验室,四川成都 610000)
溃疡性结肠炎(ulcerative colitis,UC)是一种以结肠和直肠黏膜弥漫性炎症为特征的慢性炎症性疾病。UC 的病因机制尚不清楚,多数研究认为其主要是由遗传易感性、外界环境刺激、自身免疫性疾病、肠道菌群失调和肠黏膜屏障损伤共同作用的结果[1]。目前治疗UC 的一线药物为氨基水杨酸类,其治疗周期长、有效性低,长期服用不良反应大、疾病易复发,严重增加了患者的经济负担和生活困扰,并有可能提高结肠癌的风险[2]。
美洲大蠊Periplaneta americana L.作为一味中药材,入药始载于《神农本草经》,其主要化学成分为氨基酸、凝集素、活性肽类及硫酸黏糖多糖类[3]。现代药理学证明,美洲大蠊提取物具有加速病损组织修复、改善病灶部位微循环、消除炎症水肿、抗病毒、巩固机体防御机制、调节机体T淋巴细胞与B 淋巴细胞比例等功能[4]。本课题组前期研究证实了美洲大蠊提取物对噁唑酮(Oxazolone,OXZ)[5]、2,4-二硝基氯苯(1-chloro-2,4-dini-trochlorobenzene,DNCB)[6]诱导UC 大鼠均有显著地促黏膜修复作用,但是治疗前期抑制炎症的作用却不明显。蒲公英作为一种药食两用的菊科植物,主要成分为酚酸类、黄酮类和多糖类[7]。现代药理研究证明,蒲公英具有抗炎、抗氧化和免疫调节等功效[7]。在临床和实验性结肠炎中均已证明蒲公英提取物对UC 具有治疗作用[8-9]。因此,课题组依据中医治疗UC 的特点将美洲大蠊与具有抗炎功效的蒲公英进行配伍,组成抗炎和促修复作用更为显著的动植物药复方Ento-PB。其中美洲大蠊入心、肝、脾、肾,健脾、散瘀消肿、敛疮生肌促修复,加强收敛止泻;蒲公英苦寒,清热燥湿,泻火解毒,善治肠胃湿热所致泄泻、痢疾;两药合用以共同调补脏腑,益气健脾、去腐生肌、消除炎症水肿之功效。本研究通过噁唑酮诱导的大鼠UC 模型,评价复方Ento-PB 对活动期UC 的作用,以期为其中药配方制剂的研究提供实验基础。
1 材料
1.1 动物 60 只SD 大鼠,SPF 级,雌雄各半,体质量180~220 g,购于湖南斯莱克景达实验动物有限公司 [许可证号SCXK(湘)-2016-0004]。在大理大学实验动物中心饲养[许可证号SYXK(滇)2011-0004]。
1.2 药物与试剂 蒲公英全草(批号170306)购于云南大理中药材市场,由大理大学生药学专业何苗助理研究员鉴定为蒙古蒲公英Taraxacum mongolicum Hand.-Mazz.;蜚蠊成虫干燥全体(批号YF1807014)购于四川好医生攀西药业责任有限公司,经大理大学动物学专业杨自忠教授鉴定为美洲大蠊Periplaneta americana L.。柳氮磺吡啶(SASP,批号09160503,上海信谊天平药业有限公司);咖啡酸(批号110885-200102)、丙氨酸对照品(批号140676-201706)均购于中国食品药品检定研究院;三氟乙酸(TFA,Lot 17040277,美国天地有限公司);噁唑酮(OXZ,Lot 11432-035,深圳市丽晶生化科技有限公司);大鼠白介素4(IL-4,批号R171229-002a)、大鼠白介素10(IL-10,批号R170112004a)、大鼠肿瘤坏死因子-α(TNF-α,批号R170103-002a)、表皮生长因子(EGF,批号R71105-099a)试剂盒均购于欣博盛生物科技有限公司;隐血试剂盒(批号20170424)、大鼠白介素13(IL-13,批号 20171215)、髓过氧化物酶(MPO,批号20170112)、一氧化氮合酶(NOS,批号20171022)试剂盒均购于南京建成生物工程研究所。
1.3 仪器 SpectraMax M2 多功能酶标仪(美国Molecular Devices);HC3018R 型高速离心机(安徽中科中佳科学仪器有限公司);UV-6000PC 型紫外-可见分光光度计(上海元析仪器有限公司);Agilent 1260 高效液相色谱仪(美国安捷伦科技有限公司)。
1.4 复方Ento-PB 制备 按7 ∶3 的比例称取蜚蠊和蒲公英,加水煮沸,滤过,滤液浓缩后加入适量的乙醇,搅拌均匀,静置过夜,离心,取上清液,浓缩至干燥即得复方Ento-PB 提取物,密封保存在-20 ℃。
1.5 复方Ento-PB 中总氨基酸和咖啡酸含量测定根据《四川省中药材标准》 和2020 年版《中国药典》 对美洲大蠊和蒲公英的质量控制要求,采用茚三酮显色法测定复方Ento-PB 中的总氨基酸含量,同时HPLC 法测定复方Ento-PB 中咖啡酸的含量。用超纯水配制1.0 mg/mL 的复方Ento-PB 供试液,按文献[10-11]方法对复方Ento-PB 中的总氨基酸和咖啡酸含量进行检测,并建立丙氨酸线性曲线(Y=0.028 7X+0.003 9,r =0.999 8),计算得复方Ento-PB 中总氨基酸含量为9.85%;用0.22 μm微孔滤膜过滤复方Ento-PB 供试液,HPLC色谱条件为Sepax HP-C18(4.6 mm × 250 mm,5 μm);流动相0.1% TFA 水溶液(A)-0.1%TFA 甲醇(B),梯度洗脱(0 min,11% B;15 min,11%B;21 min,70%B;30 min,11%B);体积流量1.0 mL/min;进样量10 μL;检测波长323 nm;室温。测定得复方Ento-PB 中的咖啡酸质量分数为0.08%。
2 方法
2.1 模型建立 本研究参考并改进了文献报道的噁唑酮诱导结肠炎的方法[12]。造模前1 d,对所有大鼠背部2 cm × 2 cm 的区域进行剃毛,同时,随机选取10 只大鼠作为正常组,雌雄各半。其余大鼠以0.2 mL 噁唑酮(30 mg/mL,无水乙醇)涂抹在暴露的皮肤处,连续7 d。第7 天禁食不禁水24 h 后,用异氟醚麻醉大鼠,将聚乙烯软导管(外径2.00 mm,长度10 cm)通过直肠小心地插入结肠,其尖端位于肛门近端约8 cm 处,将0.4 mL噁唑酮(10 mg/mL,50% 乙醇溶液)使用1 mL 注射器通过软导管缓慢注入结肠,缓缓拔出导管,使大鼠保持头部朝下姿势60 s。正常组大鼠用生理盐水代替造模剂按上述方法平行操作。
2.2 分组 造模结束24 h 后,将造模大鼠按文献[13]标准进行疾病活动指数(disease activity index,DAI)评分,并剔除DAI 评分为0~6 分的大鼠,剩余大鼠随机分为模型组,SASP 组(0.3 g/kg),复方Ento-PB 低、中、高剂量组(0.05、0.1、0.2 g/kg),每组10 只,雌雄各半。分组当天给药,每天1 次,持续7 d。
2.3 指标检测 给药期间,每天观察大鼠的一般状态,并在给药的第1、4、7 d 对大鼠进行DAI 评分。末次给药24 h 后,水合氯醛麻醉大鼠,腹主动脉取血,3 500 r/min 离心10 min,取血清,用试剂盒检测tNOS、iNOS 活性及 IL-4、IL-10、IL-13、EGF 表达。解剖大鼠取出肝脏、脾脏和胸腺,称重,计算脏器指数。取出结肠,剔除肠系膜周围脂肪组织,沿肠系膜剪开,冷生理盐水洗净粪便,参照文献[14]方法进行结肠黏膜损伤指数(colon mucosal damage index,CMDI)评分。将结肠纵向剪取一半称定质量,按1 ∶9 用冰生理盐水匀浆,3 500 r/min 离心10 min,取上清液,试剂盒检测匀浆液中MPO 活性及炎性标志物TNF-α 表达。剩余结肠组织用4%多聚甲醛固定,包埋后制成5 μm 切片,苏木精-伊红(H&E)染色,参照文献[15]方法进行组织病理学(histopathological score,HS)评分。
2.4 统计学分析 通过SPSS 24.0 软件进行处理,数据以()表示,多组间比较采用One-way ANOVA 分析,两两比较采用LSD 检验方法或Tamhane’s T 检验。以P <0.05 为差异有统计学意义。
3 结果
3.1 复方Ento-PB 对UC 大鼠一般状态的影响给药期间,正常组大鼠活泼好动,被毛光滑发亮,体质量增加,大便成形。模型组大鼠毛色无光泽、枯乱,体质量明显减轻,精神萎靡,出现拱背、扎堆等现象,大便多为黏液便和脓血便。UC 大鼠经SASP 治疗后精神状态明显好转,活动增多,粪便基本成形;复方Ento-PB 各剂量组也能不同程度的改善大鼠稀便、血便等症状,粪便基本成形,体质量逐渐回升。
3.2 复方Ento-PB 对UC 大鼠DAI 的影响 如表1所示,给药第1 天,与正常组比较,经噁唑酮处理的各组大鼠DAI 评分升高(P<0.01),提示建模成功,经SASP 和复方Ento-PB 处理后,DAI 评分呈现下降趋势。给药第7 天,与正常组比较,模型组大鼠DAI 评分升高(P<0.01);与模型组比较,SASP 组大鼠DAI 评分降低(P<0.01);复方Ento-PB 组大鼠DAI 评分呈剂量依赖性降低,差异具有统计学意义(P<0.05,P<0.01)。
3.3 复方Ento-PB 对UC 大鼠结肠相关指标的影响 如表2 所示,与正常组比较,模型组大鼠结肠出现缩短变宽,黏膜表面有颗粒状改变,质脆易断并形成炎症性息肉及溃疡,结肠长宽比显著下降、CMDI 评分和结肠指数升高(P<0.01);与模型组比较,SASP 组大鼠结肠长宽比升高、CMDI 评分和结肠指数降低(P<0.05,P<0.01);复方Ento-PB 各剂量组大鼠结肠长宽比升高、CMDI 评分降低,结肠指数呈剂量依赖性降低(P<0.01)。
表1 复方Ento-PB 对噁唑酮诱导UC 大鼠DAI 评分的影响(,n=10)Tab.1 Effects of compound Ento-PB on DAI scores in oxazolone-induced UC rats(,n=10)
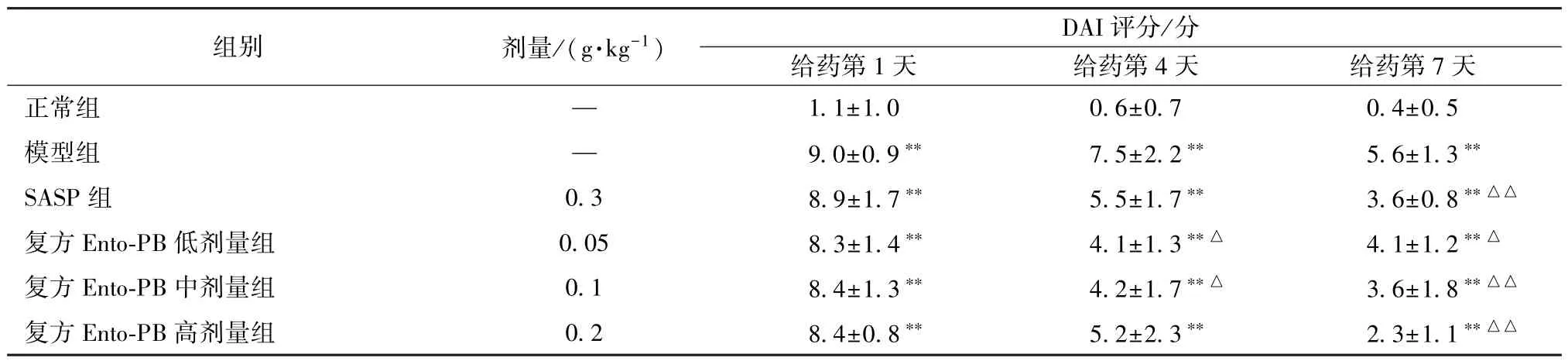
表1 复方Ento-PB 对噁唑酮诱导UC 大鼠DAI 评分的影响(,n=10)Tab.1 Effects of compound Ento-PB on DAI scores in oxazolone-induced UC rats(,n=10)
注:与正常组比较,∗∗P<0.01;与模型组比较,△P<0.05,△△P<0.01。
表2 复方Ento-PB 对噁唑酮诱导UC 大鼠结肠相关指数的影响(,n=10)Tab.2 Effects of compound Ento-PB on colon-related indices in oxazolone-induced UC rats(,n=10)
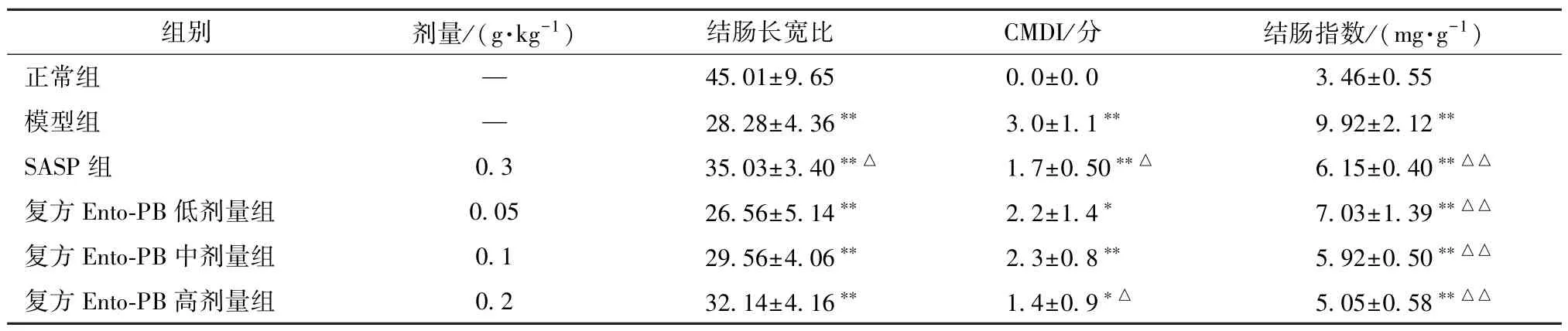
表2 复方Ento-PB 对噁唑酮诱导UC 大鼠结肠相关指数的影响(,n=10)Tab.2 Effects of compound Ento-PB on colon-related indices in oxazolone-induced UC rats(,n=10)
注:与正常组比较,∗P<0.05,∗∗P<0.01;与模型组比较,△P<0.05,△△P<0.01。
3.4 复方Ento-PB 对UC 大鼠脏器指数的影响如表3 所示,与正常组比较,模型组大鼠胸腺指数和脾脏指数降低(P<0.05),肝脏指数无明显影响;与模型组比较,SASP 组大鼠肝脏指数和脾脏指数升高(P<0.05,P<0.01),复方Ento-PB 组大鼠脾脏指数升高(P<0.05,P<0.01)。
表3 复方Ento-PB 对噁唑酮诱导UC 大鼠脏器指数的影响(,n=10)Tab.3 Effects of compound Ento-PB on visceral indices in oxazolone-induced UC rats(,n=10)

表3 复方Ento-PB 对噁唑酮诱导UC 大鼠脏器指数的影响(,n=10)Tab.3 Effects of compound Ento-PB on visceral indices in oxazolone-induced UC rats(,n=10)
注:与正常组比较,∗P<0.05,∗∗P<0.01;与模型组比较,△P<0.05,△△P<0.01。
3.5 复方Ento-PB 对UC 大鼠血清生化指标的影响 如表4 所示,与正常组比较,模型组大鼠血清tNOS、iNOS、IL-13 水平升高(P <0.01),IL-4、IL-10、EGF 表达降低(P<0.01);与模型组比较,SASP 组大鼠血清tNOS、iNOS、IL-13 水平降低(P<0.05,P<0.01),IL-4、IL-10、EGF 表达升高(P <0.01);复方Ento-PB 高剂量组大鼠血清tNOS、iNOS、IL-13 水平降低(P <0.05,P <0.01),IL-4、IL-10 和EGF 的表达升高(P<0.05,P<0.01)。
3.6 复方Ento-PB 对UC 大鼠结肠组织TNF-α 及MPO 的影响 如表5 所示,与正常组比较,模型组大鼠结肠TNF-α 水平、MPO 活性升高(P <0.05,P<0.01);与模型组比较,SASP 组大鼠结肠TNF-α 水平、MPO 活性降低(P <0.05,P <0.01);复方Ento-PB 组可呈剂量依赖性降低大鼠结肠TNF-α 水平(P<0.01),并且高剂量组大鼠结肠MPO 活性降低(P<0.05)。
表4 复方Ento-PB 对噁唑酮诱导UC 大鼠血清tNOS、iNOS、IL-13、IL-4、IL-10、EGF 水平的影响(,n=10)Tab.4 Effects of compound Ento-PB on serum levels of tNOS,iNOS,IL-13,IL-4,IL-10 and EGF in oxazolone-induced UC rats(,n=10)
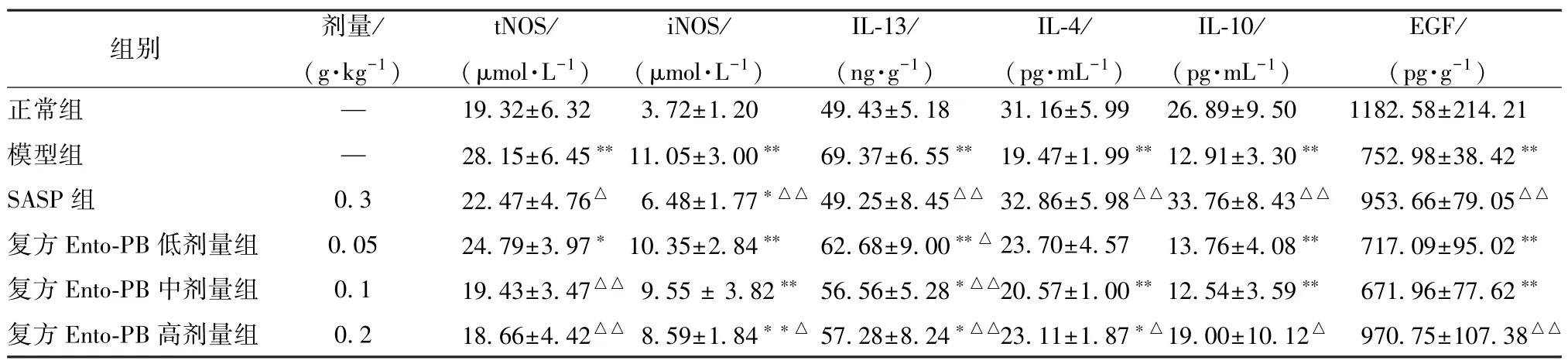
表4 复方Ento-PB 对噁唑酮诱导UC 大鼠血清tNOS、iNOS、IL-13、IL-4、IL-10、EGF 水平的影响(,n=10)Tab.4 Effects of compound Ento-PB on serum levels of tNOS,iNOS,IL-13,IL-4,IL-10 and EGF in oxazolone-induced UC rats(,n=10)
注:与正常组比较,∗P<0.05,∗∗P<0.01;与模型组比较,△P<0.05,△△P<0.01。
表5 复方Ento-PB 对噁唑酮诱导UC 大鼠结肠组织TNF-α、MPO 水平的影响(,n=10)Tab.5 Effects of compound Ento-PB on TNF-α and MPO levels in colonic tissue of oxazolone-induced UC rats(,n=10)
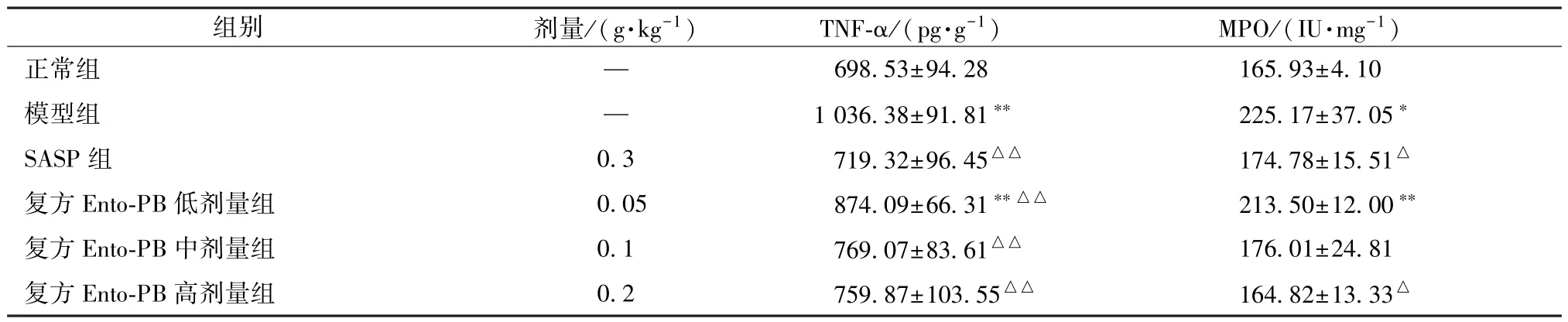
表5 复方Ento-PB 对噁唑酮诱导UC 大鼠结肠组织TNF-α、MPO 水平的影响(,n=10)Tab.5 Effects of compound Ento-PB on TNF-α and MPO levels in colonic tissue of oxazolone-induced UC rats(,n=10)
注:与正常组比较,∗P<0.05,∗∗P<0.01;与模型组比较,△P<0.05,△△P<0.01。
3.7 复方Ento-PB 对UC 大鼠结肠HS 评分的影响 如表6、图1 所示,与正常组比较,模型组大鼠结肠病理表现为隐窝消失、杯状细胞面积丢失、黏膜层坏死,固有层出血、炎细胞浸润到黏膜肌或黏膜肌下层。模型组大鼠结肠上皮细胞、炎细胞浸润评分和HS 评分均高于正常组(P<0.01);与模型组比较,SASP 组大鼠结肠上皮细胞、炎细胞浸润评分、HS 评分降低(P <0.01),复方Ento-PB高剂量组大鼠结肠上皮细胞、炎细胞浸润评分降低(P<0.05,P<0.01),复方Ento-PB 各剂量组大鼠HS 评分降低(P<0.05,P<0.01)。
表6 复方Ento-PB 对噁唑酮诱导UC 大鼠HS 评分的影响(,n=10)Tab.6 Effects of compound Ento-PB on HS scores in oxazolone-induced UC rats(,n=10)

表6 复方Ento-PB 对噁唑酮诱导UC 大鼠HS 评分的影响(,n=10)Tab.6 Effects of compound Ento-PB on HS scores in oxazolone-induced UC rats(,n=10)
注:与正常组比较,∗P<0.05,∗∗P<0.01;与模型组比较,△P<0.05,△△P<0.01。
4 讨论
UC 是一种与黏膜炎症反应持续存在、免疫功能异常和肠屏障受损相关的结肠炎症性疾病[16]。噁唑酮诱导的急性结肠炎模型,在病理学特征、免疫学特征和炎症分布上均类似临床活动期的UC 患者,具有建模周期短、可重复性好等特点,是较为理想的人类活动期UC 模型[17]。
在本研究中,在皮肤预先用噁唑酮致敏后,通过直肠内给予低剂量的噁唑酮来诱发大鼠急性结肠炎。造模后大鼠出现腹泻,黏液血便,体质量减轻等临床表现,DAI、CMDI 评分升高。镜下检查可见单核细胞透壁浸润、杯状细胞大面积丢失和隐窝结构变形,HS 评分升高。此外,模型组大鼠结肠组织中MPO 活性和血清中tNOS、iNOS 表达上调,这是结肠黏膜中中性粒细胞浸润致使炎症上升的标志。SASP 和复方Ento-PB 各剂量组显著减轻了结肠的病理损伤,组织中MPO 活性以及血清中tNOS、iNOS 表达均不同程度的降低。提示复方Ento-PB 可以抑制炎症细胞浸润,改善UC 相关的临床症状,对噁唑酮诱导的结肠炎大鼠有保护作用。
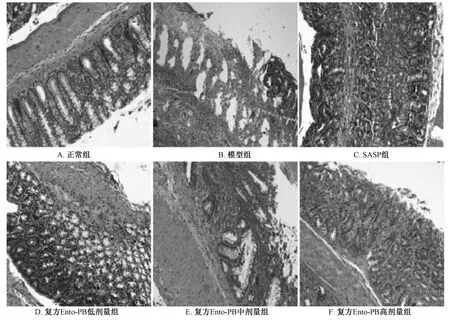
图1 各组大鼠结肠组织的组织病理学评分(HE,×200)Fig.1 Histopathological scores of rats colon tissue in each group(HE,×200)
IL-4 作为调节细胞可激活Th0 细胞向Th2 细胞分化,具有抑制炎症反应和维持肠道免疫平衡作用[18]。IL-10 作为典型的抗炎细胞因子与免疫抑制性Th2 型细胞因子,能从分子水平上抑制TNF-α、IL-1β 等促炎因子的分泌,并下调Th1 细胞的分化[19]。IL-4 和IL-10 协同作用下可逆转Th1/Th2 细胞活化过程,从而改善黏膜损伤情况。IL-13 作为Th2 细胞关键效应细胞因子,其局部浓度过高不仅导致上皮屏障功能受损,而且还影响肠上皮细胞凋亡,紧密连接和恢复速度[18]。TNF-α 由单核巨噬细胞和活化Th1 细胞分泌,具有诱导iNOS、COX2(环氧化酶)等多种促炎细胞因子合成,启动“瀑布式”炎症联级反应,加剧UC 病情的发展[20]。EGF 是作用于组织、细胞、分化基因的一种多功能修复细胞因子,通过增加细胞内蛋白质的合成,刺激组织的生长,在肠道黏膜损伤和修复中发挥着重要作用[21]。在本研究中,模型组大鼠血清中IL-13 和结肠组织TNF-α 表达量升高,而血清IL-4、IL-10、EGF 表达量降低,提示模型组大鼠肠屏障功能受损、机体抗炎能力降低。而经复方Ento-PB治疗后,TNF-α、IL-13 水平降低,而IL-4、IL-10和EGF 水平升高。其中复方Ento-PB 高剂量组治疗效果接近于阳性药SASP 组。提示复方Ento-PB可以通过调节炎性细胞因子分泌,减轻机体炎症反应,最终达到治疗UC 的作用。
综上所述,复方Ento-PB 高剂量组的治疗作用趋近于SASP 组。且在促进黏膜修复方面优于SASP,这从CMDI 评分以及EGF 和MPO 的表达上可以体现,提示复方Ento-PB 具有促进黏膜损伤后的快速愈合作用,若与抗炎药物配伍使用,将会弥补抗炎药物对UC 患者黏膜愈合率低的缺陷。课题组后期将深入研究复方Ento-PB 抗UC 的作用机制,以期为复方Ento-PB 的药动学与药效作用的关联提供理论依据和证明。

