3D腹腔镜肝Ⅶ段病灶前切除术22例疗效分析*
高胜强,姜静华,罗建生,俞世安
(金华市中心医院 肝胆胰外科,浙江 金华321000)
腹腔镜肝切除术已在全球得到推广和应用,随着腹腔镜器械和手术技术的提高,其相对于开腹手术的可行性和潜在优势得到了证实,但对于切除右肝上叶后段肿瘤仍然是一项艰难的挑战。早期因担心手术风险较高、肿瘤种植[1]和技术困难等,腹腔镜困难部位肝切除手术量并不多。与开腹手术相比,腹腔镜具有失血量少[2]、术后并发症少[3]、腹水比例低[4]和住院时间短[5]等优势。传统腹腔镜手术的主要限制之一是缺乏深度景深感。与传统的2D腹腔镜相比,3D腹腔镜技术采用3D 成像技术,能使外科医生获得景深感,提高运动精度。肝Ⅶ段位于肝脏右叶后上段,病灶位置较深、难以暴露,给操作带来不少困难,3D 腹腔镜则可以解决这一困难。笔者团队先游离肝脏周边韧带,在病灶前方2 cm 处用大针丝线缝合肝脏表面,缝合3处,再牵拉丝线到腹壁打结,使病灶暴露到前方(即前切除),此方法取得了较好的临床效果。现报道如下:
1 资料与方法
1.1 一般资料
回顾性分析2016年1月-2019年12月22 例在本金华市中心医院行3D 腹腔镜下肝Ⅶ段病灶前切除术患者的临床资料。其中,男15 例,女7 例;年龄22~76岁,中位年龄54.9岁。病灶部位均位于肝Ⅶ段。原发病:原发性肝癌11例,结肠癌肝转移1例,血管瘤8 例,血管平滑肌脂肪瘤1 例,肝细胞局灶性结节性增生1 例。Child-Pugh 分级全部为A 级,8 例合并有肝硬化。肝恶性肿瘤患者血清甲胎蛋白有不同程度的升高,肝良性肿瘤患者的血清甲胎蛋白和癌胚抗原水平正常。
1.2 手术方法
患者采用头高足低仰卧分腿位,气管插管后行全身麻醉。术者及助手均佩戴专用3D 眼镜。采用五孔法操作,以脐部为观察孔,术者立于患者左侧,助手位于患者右侧,扶镜手位于患者两腿之间。进入腹腔后,先用红皮导尿管于患者第一肝门绕两圈,行预阻断,如果术中有大出血,可于此处阻断入肝血流。然后再游离肝周韧带和进行肝实质离断。
1.2.1 游离肝周韧带 首先游离肝圆韧带和镰状韧带,再游离右肝冠状韧带、肝肾韧带及右三角韧带。抬起右肝,游离右肝下端的裸区,再充分游离右肝周围的韧带。用大块纱布填塞到肝Ⅶ段后方,在病灶前方靠近肝脏Ⅷ段处,用大针丝线缝合肝脏表面,然后缝合打结,使橡皮筋固定在肝脏表面(橡皮筋取自无菌手套腕部末端),缝合3 处,穿刺针穿过左下腹壁皮肤,使丝线牵拉橡皮筋,再在腹壁皮肤外打结,以使肝Ⅶ段暴露到肝Ⅷ段位置(即前方)。
1.2.2 肝实质离断 对于肝实质内肉眼无法看到的病灶,可用术中超声定位,本文有5例采用了术中超声定位。找到病灶后,用电凝勾电凝肝脏表面,标出肝脏的边界,于病灶边缘2 cm 处做一预切除线。用超声刀切开肝实质,由浅入深逐步行分离、解剖、夹闭和切断,小血管可以用钛夹夹闭后离断,较大的血管用hemo-lock 夹夹闭后再离断。如果切肝过程中有血管性出血或胆漏发生,则使用proline 线进行缝合,少量的创面出血可用电凝勾电凝止血。最后,用明胶海绵止血材料填塞肝残面,腹腔内放置引流管,将标本装入标本袋,于扩大的脐部切口取出。
1.3 术后处理和随访
术后当天给予禁食、护肝等对症支持治疗,术后第2天进流质饮食。观察腹腔引流管情况,如引流出胆汁样液体,应考虑胆漏的可能。观察患者术后并发症。恶性肿瘤患者术后随访1年。
2 结果
22 例患者均成功完成手术,术中无中转开腹。手术时间(253.3±93.5)min,术中出血量(240.0±92.3)mL,术后(1.0±0.5)d 下床活动,术后平均(4.5±1.5)d 拔除腹腔引流管,术后平均住院时间(8.0±1.0)d。术后有1例发生肺部感染和肺不张,无胆漏和腹腔出血等发生。恶性肿瘤患者术后随访1年,无肿瘤复发。患者手术过程见附图。
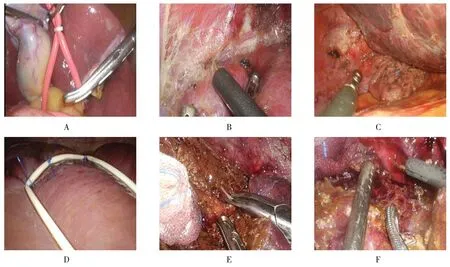
附图 3D腹腔镜肝Ⅶ段病灶前切除术Attached fig.3D laparoscopic anterior lesion resection of liver Ⅶsegment
3 讨论
肝脏由肝动脉、门静脉和肝静脉系统提供血流,血流非常丰富,肝切除术中如何控制出血是手术的难点。1991年REICH 完成了世界首例腹腔镜肝切除术[6],由于其具有切口小和术后恢复快等优点,在世界范围得到了迅速推广。对于腹腔镜肝切除术,是否能良好暴露视野至关重要。传统的2D 腹腔镜仅能提供术者二维平面视野,无法展示三维立体解剖结构,缺少3D 腹腔镜的景深感[7],增加了术者的学习时间。以往腹腔镜肝切除主要局限在左肝及右肝的边缘部位[8]。肝Ⅶ段位于肝脏后上半部,接近主肝静脉和下腔静脉,暴露效果差,传统的2D 腹腔镜难以进入,且易导致术中出血而中转开腹,但开腹手术下该部位视野显露也存在一定的困难。为了保证肝Ⅶ段手术的成功,笔者设计了一种安全的手术方法,即将肝牵引和3D腹腔镜结合。
INOUE 等[9]使用肋间套管针;MORISE 等[10]使用伴有体位改变的尾侧入路;杨斌等[11]报道了双窥视孔完全腹腔镜下Ⅶ段肝肿瘤切除术,增加右上腹窥视孔来辅助手术。上述方法均较新颖,但如果要完全暴露肝穹顶后面的病变,需要增加额外的伤口或端口,且外科医生还要适应不熟悉的组织解剖和位置。我国也制定了《3D 腹腔镜手术技术专家共识(2019版)》[12],利于3D 腹腔镜技术的发展。3D腹腔镜摄像系统能够实时呈现立体图像,并4倍放大手术视野,大大提高了切割、抓持和组织缝合操作的精度,从而提高手术效率[13],已被越来越多地应用于肝Ⅶ段手术。
目前,行3D腹腔镜手术的报道较多,但3D腹腔镜在肝脏手术中的报道较少。张红卫等[14]认为,3D腹腔镜对于精确分离肝内管道结构具有一定优势,并有助于控制术中出血。方驰华等[15]采用增强实现技术,将三维模型与3D腹腔镜手术图像进行实时融合,联合吲哚菁绿(indocyanine green,ICG)分子荧光影像技术,进行手术实时导航右半肝切除,ICG分子荧光影像从微观分子细胞水平进行肿瘤边界界定和肝切除范围的确定,通过结合增强实现技术投影的三维融合图像,突出了多模图像导航肝切除的优点,以达到解剖性、功能性和根治性肝切除的效果。
笔者采用3D 腹腔镜肝Ⅶ段病灶前切除手术,术中可很好显露病灶,3D 腹腔镜的景深感使术者能够准确、迅速地进行解剖,并更好地控制出血,缩短了手术时间,特别是在肝实质的横切过程中更有体现。
笔者的经验体会:①术前需要充分评估患者全身情况,术前影像需要仔细查阅,熟悉肿瘤与周边血管的关系,有条件者可进行CT 三维重建,术前评估肝功能分级以防止术后肝衰竭的发生;②术中首先行第一肝门的预阻断,当有大出血时,可立即阻断第一肝门,以减少术中出血,本组22 例病例中有11 例进行了第一肝门间歇性阻断;对于右肝周边的韧带需要进行完全游离,否则无法牵拉出肝脏和暴露肝Ⅶ段;③3D 腹腔镜对于肝内管道结构解剖显露效果较好(特别是肝静脉分支),有助于术中控制出血,尤其适用位于肝Ⅶ段的病灶;④若长时间手术,术者也会出现轻度视觉疲劳,并伴有眩晕感,需要术者有一个适应的过程。
综上所述,采用3D腹腔镜肝Ⅶ段病灶前切除术,术者能获得高清的立体视野,可较好地显露肝Ⅶ段和肝内管道结构,使操作更为精准,并减少术中出血量,在临床应用中效果满意,值得进一步推广。

