表皮松解性掌跖角化症KRT9R163W突变表达对细胞骨架结构影响研究
王 朋,梁胜男,王唯嘉,王 鹏,赵 娟,康晓静
RNA干扰(RNA interfrence,RNAi)借 助 于内源或外源性的双链短小RNA诱发针对目的基因在mRNA水平上的基因沉默[1]。小干扰RNA(small interfrencing RNA,siRNA)作为一种新近发现的诱导细胞内特定基因沉默的技术,广泛应用于基因功能研究[2]。表皮松解性掌跖角化症(epidermolytic palmoplantar keratoderma,EPPK,OMIM 144200),又称Vorner型掌跖角化病,为一种常染色体显性遗传性皮肤病,具有遗传异质性,多数EPPK患者的致病基因为角蛋白9(KRT9)[3]。本研究前期通过全基因组外显子测序结合连锁分析发现一维吾尔族EPPK大家系的致病基因为KRT9R163W,该位点错义突变可能导致氨基酸163由精氨酸突变为色氨酸,前期研究已利用蛋白预测软件预测该突变为有害突变[4,5]。目前已报道的EPPK研究方向多数为寻找其致病基因,但其疾病的发病机制研究较少。本研究从细胞水平上进一步探讨KRT9的基因功能,利用siRNA靶向沉默KRT9R163W对HaCaT细胞基因表达,并观察转染前后细胞骨架的变化,进一步从mRNA水平及细胞的结构上探索EPPK的发病机制,为EPPK的分子靶向治疗提供理论基础。
1 材料与方法
1.1 材料和试剂
永生化人角质形成细胞(HaCaT细胞)(中国科学院细胞研究所);胎牛血清及二甲基亚砜(DMEM)细胞培养液(上海四季青生物技术公司),青链霉素双抗液及0.25%的胰酶(上海生工生物工程股份有限公司),siRNA序列(上海吉玛制药技术有限公司);荧光定量聚合酶链反应(qPCR)试剂盒、TrizolRNA抽提试剂盒及pMD-18T质粒(上海生工生物工程股份有限公司)。
1.2 方法
1.2.1 细胞的复苏、培养 HaCaT细胞冻存于液氮中,快速解冻法解冻,无菌操作台进行接种操作。吸管吸出细胞悬液,立即注入离心管,加2 ml含有10%胎牛血清(FBS)的DMEM,充分混合,低速离心800 r/min,弃上清,测定细胞活力。加入5 ml DMEM完全培养基(含10%FBS,100 U/ml青霉素,100 μg/ml链霉素)充分吹打混匀,接种至100 ml的培养瓶,置于37℃,5%CO2,相对湿度90%的培养箱中培养。
1.2.2 细胞的传代及冻存 选生长融合度为60%~70%的细胞,倒去原有的培养液,吸取适量的PBS加入培养瓶中,轻轻震荡后弃去,重复1次,以清除血清成分,并利于胰酶消化。加入适量0.25%的胰酶,转动培养瓶,使其充分湿润,培养箱内消化2~3 min。显微镜下观察细胞体积缩小,呈类圆形,细胞间隙增大时,加入适量培养液终止消化。吸取瓶中培养液反复冲洗瓶壁上的细胞层轻轻吹打、混匀,制成细胞悬液,将细胞悬液按1:5分装到无菌培养瓶中培养,4~6 h后可见细胞贴壁生长,每48 h进行1次换液。
1.2.3 质粒的构建、扩增、筛选及鉴定 ①载体构建:质粒载体选用pMD-18T,为一种高效的克隆PCR产物的专用载体,约2690 bp。本实验主要以pMD-18T质粒为载体,将野生型KRT9(K9-WT)和具有R163W突变型KRT9的目的基因通过转化或转导的方法导进宿主细胞,进行重组、筛选、扩增的过程。连接体系为pMD 18T 0.5 μl,目的DNA 2.5 μl,Solution I 3 μl,16℃过夜连接。②转化及扩增:将连接体系共8 μl加入至100 μl的JM109细胞中,用无菌枪头轻柔的混匀细胞混合物,42℃加热45 s,冰上放置1 min,加入890 μl的SOC培养基,37℃振荡培养60 min。 取出100 μl的培养物涂于37℃预热的LB固体培养基(含氨苄青霉素)表面。37℃恒温箱中过夜培养(16 h左右)。③筛选及鉴定:在含有氨苄青霉素的L-琼脂平板培养基上培养,形成单菌落,计数白色、蓝色菌落。挑选白色菌落进行质粒小量抽提方法抽提BAC质粒。PCR验证目的基因序列。
1.2.4 siRNA及细胞转染 在网站上进行特异性序列筛选,将选中的碱基序列随机重新排列作为阴性对照。在数据库中进行同源性对比,以保证和目的细胞中的基因无同源性,只沉默单一的基因,以此设计siRNA阴性对照序列。siRNA序列由上海吉玛制药有限公司合成。siRNA序列[6]:sense: 5′-GCCCGUUG UUGGAAAUCAUTT-3′,antisense: 5′-AUGAUUUCCA ACAACGGGCTT-3′,KRT9R163WsiRNA序列:sense: 5′-TGCAGGAACTCAATTCTTGUU-3′,antisense: 5′-AACAAGAATTGAGUUCCTGCA-3′,siRNA阴 性对照序列:sense: 5′-UUCUCCGAACGUGUCACGUT T-3′,antisense: 5′-ACGUGACACGUUCGGAGAATT-3′。将生长良好的细胞接种至6孔板,每孔板加入2 ml无双抗培养基,放至培养箱培养24 h,准备转染。转染混合液严格按照试剂公司提供说明书进行操作,并在荧光显微镜下观察转染效率。转染细胞分组:①KRT9-wt:野生型KRT9质粒转染入HaCaT细胞(过表 达KRT9-wt);②KRT9-R163W:KRT9-R163W突变型质粒转染入HaCaT细胞(过表达KRT9-R163W);③KRT9-wt+siRNA-wt:野生型KRT9质粒与野生型siRNA共转染入HaCaT细胞(野生型siRNA特异性抑制KRT9-wt);④KRT9-wt+siRNAR163W:野生型KRT9质粒与突变型siRNA共转染入HaCaT细胞(siRNA-R163W能否特异性抑制KRT9-wt);⑤KRT9- R163W +siRNA- wt:突变型KRT9质粒与野生型siRNA共转染入HaCaT细胞(siRNA- wt能否特异性抑制KRT9- R163W);⑥KRT9- R163W + siRNA- R163W:突变型KRT9质粒与突变型siRNA共转染入HaCaT细胞(突变型siRNA- R163W能否特异性抑制KRT9- R163W)。实验细胞被每组设3个复孔。
1.2.5 qPCR检测与蛋白质Western印迹(WB) HaCaT细胞转染质粒与siRNA后,24 h 提取细胞总RNA,48 h后提取总蛋白。qPCR与Western 印迹严格按照操作规范进行。KRT9的qPCR引物:F:5′-CAGGTGAACAGATGTGGTCAA-3′,R: 5′-TTCCA GCTTCCATGCAATCAA-3′。Western印迹 KRT9抗体(abcam公司,英国,ab171966,一抗浓度:1:1000),β-肌动蛋白(abcam公司,英国,ab8226,一抗浓度:1:5000)。二抗选用abcam公司鼠/兔抗。
1.2.6 细胞骨架免疫荧光染色 取出6孔板内的细胞爬片,用PBS洗涤3次,每次5 min。用3.7%多聚甲醛固定15 min。用PBS振荡洗涤2次,每次5 min。用0.1 %Triton X-100振 荡 洗 涤15 min。用PBS振荡洗涤2次,每次5 min。用1% BSA浸没爬片,静置约20 min。加入鬼笔环肽200 μg/ml震荡10 min,然后置于4 ℃冰箱约60 min(本步骤及以下步骤避光进行)。用PBS振荡洗涤4次,每次5 min。加入Hoechst 33258染色液300 wl,室温静置15 min。用PBS洗涤4次,每次5 min。空气干燥,抗荧光衰减封片剂封片。在激光共聚焦显微镜和荧光显微镜下观察、摄影。
1.3 统计学方法
qPCR结果通过PCR仪系统软件计算出△CT,△△CT和mRNA相对表达量(RQ-2-△△Ct)。WB结果使用Image J软件分析出其灰度值。数值资料多组比较选用方差分析,P<0.05具有统计学差异。
2 结果
2.1 质粒、siRNA转染
质粒及siRNA转染效率为荧光细胞总数/细胞总数,质粒及siRNA转染效率均>75%(图1),符合实验标准。
2.2 KRT9 mRNA表达
qPCR的结果显示,KRT9-R163W组及KRT9-R163W +siRNA- R163W组,KRT9 mRNA的 相 对表达量分别是1.063±0.159,0.242±0.051,也就是说在针对突变位点设计的siRNA能显著抑制KRT9 mRNA R163W的相对表达量(P< 0.05)(表1)。
表1 KRT9 mRNA的表达 (±s)
分 组 2-△△Ct F值 P值 组间P值KRT9-wt 1.011±0.068452.23<0.05 KRT9-R163W 1.063±0.159 <0.05 KRT9-wt+siRNA-wt 0.340±0.063 <0.05 KRT9-wt +siRNA-R163W 0.992±0.069 <0.05 KRT9- R163W +siRNA-wt 0.329±0.778 <0.05 KRT9- R163W +siRNA- R163W 0.242±0.051 <0.05
2.3 Western印迹检测KRT9蛋白表达水平
Western印迹检测角质形成细胞的KRT9表达,KRT9-R163W组 及KRT9- R163W +siRNA-R163W组,KRT9蛋白的相对表达量分别是1.1329±0.131,0.289±0.036。针对突变位点设计的siRNA能显著抑制KRT9R163W蛋白的相对表达量(P< 0.05)(表2,图2)。

图2 KRT9蛋白表达电泳图
表2 WB结果分析灰度值 (±s)

表2 WB结果分析灰度值 (±s)
分组 蛋白相对表达量 F值 P值 组间P值KRT9-wt 1.362±0.176356.04<0.01 KRT9-R163W 1.132±0.131 KRT9-wt+siRNA-wt 0.337±0.112 <0.01 KRT9-wt +siRNA-R163W 1.251±0.071 KRT9- R163W +siRNA- wt 0.389±0.108 <0.01 KRT9- R163W +siRNA- R163W 0.289±0.036 <0.01
2.4 细胞骨架结构变化
KRT9R163W高表达时,细胞骨架结构为错综复杂的网状结构,且部分细胞骨架结构消失。siRNA特异性沉默KRT9R163W基因后,细胞骨架结构恢复正常的束状排列(图3)。
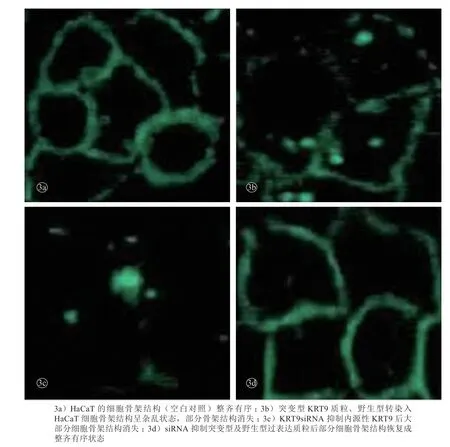
图3 细胞siRNA转染前后HaCaT细胞骨架变化(共聚焦显微镜)
3 讨论
EPPK为常染色体显性遗传病,临床症状主要为出生后数月内出现掌跖部的角化过度性斑块。组织病理特征性表现为表皮内出现空泡化细胞,电镜下显示表皮上基底棘层和颗粒层的角质形成细胞可见角蛋白和张力丝的异常聚集物。目前,国内外已有超过20余种的致病基因突变位点报道,但对致病基因突变所致的细胞结构影响的发病机制研究较少[7]。本研究利用脂质体转染质粒及siRNA转染入正常HaCaT细胞,使得KRT9R163W在HaCaT细胞中分别呈高表达及低表达状态,探讨其对细胞骨架结构的影响。HaCaT细胞为一种永生化的人角质形成细胞,遗传特性稳定,为研究角蛋白基因突变相关疾病的理想体外模型。质粒携带绿色荧光,siRNA携带红色荧光,转染入HaCaT细胞48 h后可在荧光显微镜下直观检测其转染效率,与阴性对照相比较,质粒及siRNA的转染效率均>75%。通过构建含有KRT9R163W突变质粒,转染入HaCaT细胞,KRT9R163WmRNA相对表达量显著增高, KRT9R163W呈高表达状态。共聚焦显微镜下观察HaCaT细胞骨架结构呈杂乱状态,部分细胞骨架结构消失。利用siRNA靶向沉默KRT9R163W的突变表达,KRT9R163W mRNA相对表达量显著降低,HaCaT细胞骨架结构部分恢复正常。研究结果提示,KRT9R163W高表达时可破坏细胞的正常骨架结构,KRT9R163W低表达时细胞的正常骨架结构不受影响。角质形成细胞的细胞骨架结构主要是由微丝、微管和中间丝结构组成。正常生理状态下,角蛋白9(Keratin9,K9)与配对的碱性蛋白角蛋白(Keratin1,K1),形成K9/K1异源二聚体,K9/K1是形成中间丝的重要结构。Dun 等利用K9基因敲除小鼠模型进一步验证Krt9-/-小鼠具有与表皮松解性掌跖角化症相同的临床表型。免疫组化染色结果提示K9的完全敲除可引起K6及K16的代偿表达,此研究提示内源性K9是维持角质形成细胞的正常蛋白[8]。KRT9R163W突变表达导致K9第163位精氨酸(arginine)被色氨酸(tryptophan)替代,此突变位点位于K9的1A区域,多个物种的氨基酸序列比较,此区域是K9的保守区域,具有高度保守性,推测此区域突变可能是K9的功能区[5]。K9发生突变后可能会影响异源二聚体的形成,进而影响细胞的结构。本研究通过抑制正常角质形成细胞中KRT9,通过siRNA抑制后正常的细胞骨架结构紊乱,进一步说明K9是维持角质形成细胞的重要结构。其编码的KRT9基因发生突变,可能影响正常角质形成细胞的骨架结构,推测KRT9R163W突变表达可能是导致该病发病的理论基础。
siRNA利用外源性核苷酸序列特异性沉默目的基因的表达,广泛应用于单基因疾病的致病基因研究[7-11]。本研究通过针对KRT9R163W突变位点设计的siRNA,运用这一新方法验证KRT9R163W mRNA在HaCaT细胞中表达被抑制。 siRNA能够有效的在细胞模型中抑制其表达,说明K9是维持人表皮功能正常表达的关键因素,可为EPPK的分子靶向治疗提供新的思路。本研究进一步说明siRNA技术可适用于EPPK致病基因功能验证及基因治疗。EPPK为单基因遗传病,是由一个致病基因突变所导致的临床表型,并且存在突变热点,EPPK少见隐性纯合突变或缺失基因功能突变(loss of function mutation)的研究报道。针对EPPK的致病基因设计siRNA转染入细胞中,可特异性的沉默致病基因的表达,为其分子靶向治疗提供新的方向。EPPK主要表现为掌跖部的角化过度,皮损较为局限,理论上可利用siRNA转染入较为局限的皮损内达到其治疗效果。抑制KRT9R163W突变表达可能成为治疗EPPK的一个新的治疗方向。siRNA技术目前已应用于部分角蛋白相关性疾病的基因功能验证及基因治疗研究,如先天性厚甲症,单纯型大疱性表皮松解症及先天性角膜营养不良等相关角蛋白疾病,已处于Ⅰ期临床研究阶段[6,12,13]。利用RNAi技术,可有效地沉默EPPK的体外模型HaCaT细胞中KRT9R163W基因的表达,为进一步探索KRT9R163W基因在EPPK发生发展中的重要作用奠定了基础,并为在EPPK的治疗中寻找更有效的治疗靶点提供新的思路。

