基于数据挖掘分析ZC3H13在透明细胞肾细胞癌中的表达及预后意义
孙琰,方久远,李惠翔
(郑州大学第一附属医院 病理科,河南 郑州 450000)
肾细胞癌是起源于肾小管上皮的一组恶性肿瘤,约占肾脏恶性肿瘤的90%[1]。透明细胞肾细胞癌(clear cell renal cell carcinoma,ccRCC)、乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)、嫌色细胞肾细胞癌(chromophobe renal cell carcinoma,CRCC)是3种常见的肾细胞癌亚型[2]。CRCC预后最好,PRCC次之,而占肾细胞癌70%~80%的ccRCC的预后最差。目前原发性ccRCC的5 a生存率为65%,但一旦发生转移,5 a生存率下降至10%~20%[3]。随着分子靶向治疗的发展,肾细胞癌作为一组具有广泛表型变异和瘤内异质性的疾病,有关预后和治疗的基因研究显得尤为重要[4-5]。ZC3H13是一种含有CCCH序列的锌指蛋白,其特异性的锌指结构通过与靶点DNA或RNA序列相结合,影响基因的转录和翻译。ZC3H13在胚胎发育、肿瘤发生发展等多种进程中行使不同的功能,与多种疾病和肿瘤相关。ZC3H13突变发生于肺癌、胃肠道肿瘤、卵巢癌、胶质母细胞瘤等多种肿瘤中,影响肿瘤的发生、进展及预后[6-8]。Zhu等[9]在117例大肠癌患者中检测到ZC3H13体细胞框架移位突变,并且发现该突变可能通过Ras-ERK信号通路影响预后。但ZC3H13在ccRCC中的表达及对预后的影响尚不明确。本研究利用Ualcan数据库和HPA数据库挖掘分析ZC3H13mRNA及蛋白在ccRCC中的表达及其与预后的关系,并利用GEPIA数据库加以验证,最后应用生物信息学方法预测ZC3H13在肾细胞癌中可能存在的作用机制。
1 资料与方法
1.1 Ualcan数据库挖掘分析Ualcan数据库(http://Ualcan.path.uab.edu/)是一个基于TCGA数据库的癌症数据在线分析和挖掘网站。本研究利用Ualcan数据库挖掘分析ZC3H13在ccRCC中的表达并进行差异性分析、生存分析和共表达分析,设置检索条件为:(1)选择scan by gene;(2)enter gene symbol输入ZC3H13;(3)TCGA database选择KIRC、KIRP、KICH。
1.2 HPA数据库挖掘分析人类蛋白质图谱(Human Protein Atlas,HPA)数据库(http://www.proteinatlas.org/)是一个基于蛋白组学和转录组学的大型蛋白组和转录组数据库,包含上万种人类蛋白质的分布和表达信息,可以利用RNA测序和免疫组化分析肿瘤与正常组织之间的差异性表达。本研究利用HPA分析ccRCC组织及对照组织中ZC3H13蛋白的定位及表达情况。
1.3 GEPIA数据库验证分析GEPIA数据库(http://gepia.cancer-pku.cn/index.html)是由北京大学所研发的用于基因表达谱数据的动态分析数据库。本研究利用GEPIA分析来自TCGA数据库中ccRCC的RNA测序数据,进行ZC3H13mRNA差异性分析、相关性分析及生存分析的验证。
1.4 STRING在线分析利用STRING在线数据库(https://string-db.org/cgi/input.pl)研究ZC3H13相关蛋白质之间的相互作用。本研究检索条件设置为:(1)选择protein by name;(2)protein name输入ZC3H13;(3)Organism选择Homo sapiens。
2 结果
2.1ZC3H13mRNA在RCC中的表达相比正常肾脏组织,ZC3H13mRNA在肾细胞癌中呈低表达。Ualcan数据库结果显示,在ccRCC、PRCC、CRCC中,ZC3H13mRNA表达水平均下调(P<0.05),见图1。GEPIA数据库结果显示,相比正常肾组织,ZC3H13mRNA在ccRCC、PRCC、CRCC这3种亚型肾细胞癌中表达水平均下调(P<0.05),见图2。
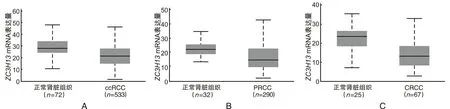
A为ZC3H13 mRNA在ccRCC组织和正常肾脏组织中的表达水平比较,P=3.699×10-9;B为ZC3H13 mRNA在PRCC组织和正常肾脏组织中的表达水平比较,P=4.210×10-6;C为ZC3H13 mRNA在CRCC组织和正常肾脏组织中的表达水平比较,P=6.756×10-4;ccRCC为透明细胞肾细胞癌;PRCC为乳头状肾细胞癌;CRCC为嫌色细胞肾细胞癌。
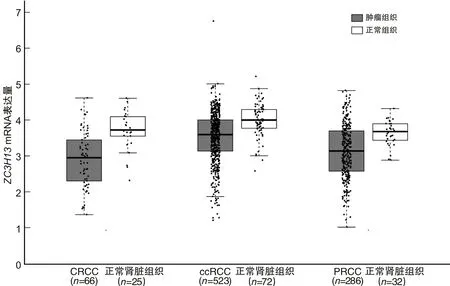
图2 GEPIA数据库中ZC3H13 mRNA在不同类型肾细胞癌中的表达情况
2.2ZC3H13mRNA在ccRCC中的表达与临床病理特征的关系在ccRCC中,Ualcan数据库按照性别、年龄、种族、肿瘤分期、肿瘤分级、肿瘤分型、转移情况分组进行ZC3H13mRNA表达的差异分析,结果显示,ZC3H13mRNA的表达在ccRCC患者不同分期、肿瘤分型、组织学分级中存在差异。Ualcan数据库结果显示:Ⅰ期ccRCC患者ZC3H13mRNA表达水平高于Ⅲ期者(P<0.05);ZC3H13mRNA在其他分期中的表达水平比较,差异无统计学意义(P>0.05),见图3A;与ccA型比较,ccB型ccRCC患者的ZC3H13mRNA表达水平较低(P<0.05),见图3B;ccRCC患者的组织学分级与ZC3H13mRNA的表达水平有关,相比于低组织学分级患者,具有高组织学分级患者的ZC3H13mRNA表达水平降低(P<0.05),见图3C。在GEPIA数据库中,随着ccRCC肿瘤分期的增高,ZC3H13mRNA的表达量逐渐下降(P<0.05),见图4。
2.3ZC3H13mRNA在ccRCC中的表达与预后的关系Ualcan数据库挖掘性分析发现,在ccRCC中,与ZC3H13mRNA高表达组比较,ZC3H13mRNA低表达组生存期较短(P<0.05),见图5。GEPIA验证性分析发现,在ccRCC中,与ZC3H13mRNA高表达组比较,ZC3H13mRNA低表达组的总生存期和无瘤生存期下降(P<0.05),见图6。

A为不同肿瘤分期ccRCC的ZC3H13 mRNA表达情况;B为不同肿瘤分型ccRCC的ZC3H13 mRNA表达情况;C为不同组织学分级ccRCC的ZC3H13 mRNA表达情况。
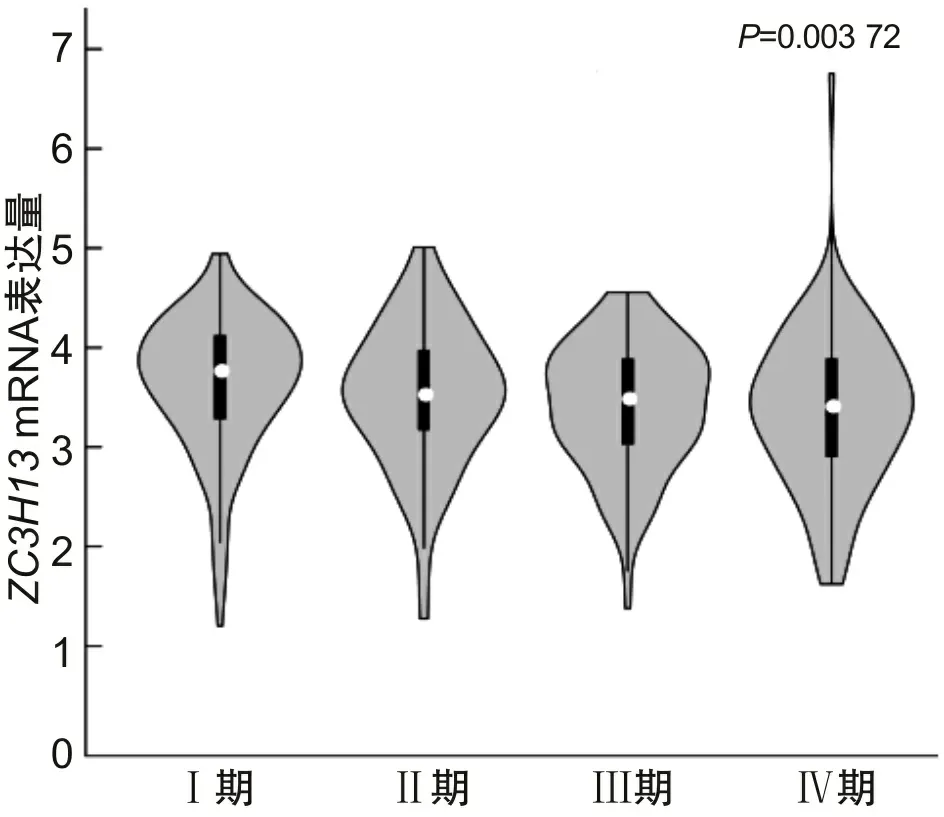
图4 GEPIA数据库中ZC3H13 mRNA在不同肿瘤分期的ccRCC中的表达

图5 Ualcan数据库中ccRCC患者ZC3H13 mRNA表达水平与生存期的关系
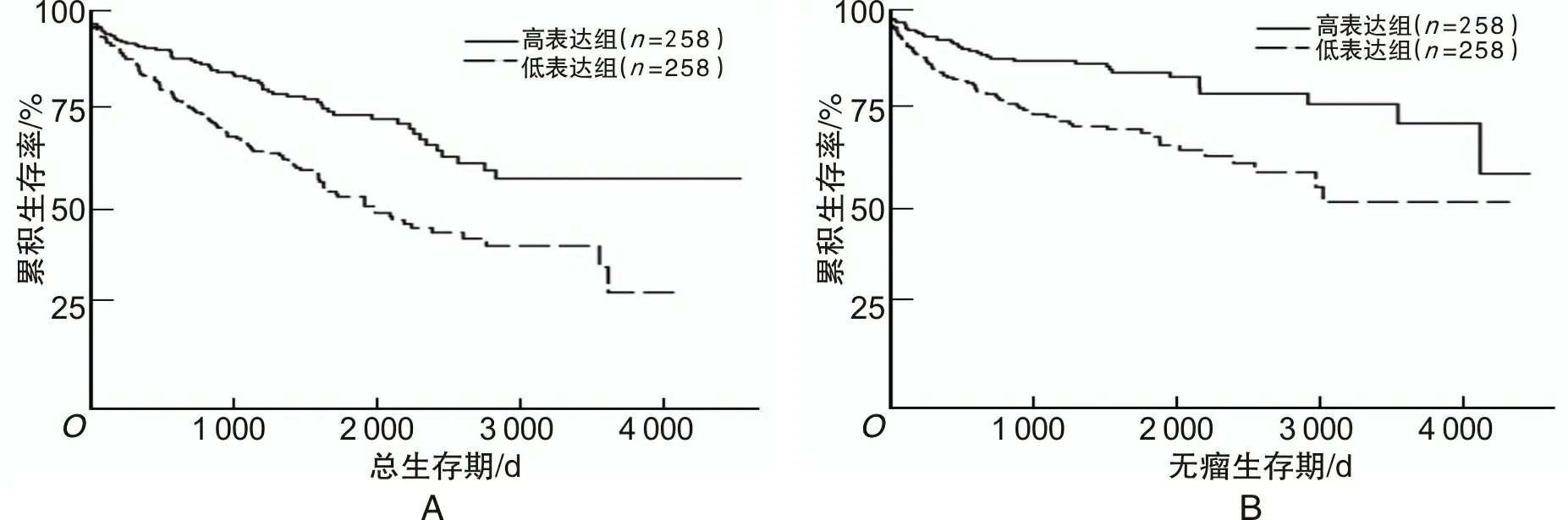
A为ZC3H13 mRNA表达水平与ccRCC患者总生存期的关系;B为ZC3H13 mRNA表达水平与ccRCC患者无瘤生存期的关系。
2.4 ZC3H13蛋白在ccRCC中的定位HPA数据库结果显示,在A-431肿瘤细胞系中,ZC3H13主要定位于核膜和肌动蛋白丝。利用免疫组化抗体(HPA047806)分析ZC3H13在肾细胞癌和正常肾脏组织中的表达,结果显示,ZC3H13蛋白主要表现为细胞核着色,部分胞质轻微着色。
2.5ZC3H13基因的共表达分析首先利用Ualcan数据库对ZC3H13进行共表达分析,共检索到6 394个共表达基因,其中包含VHL、PBRM1、mTOR、HIF-1α等在ccRCC发生过程中的关键基因。然后利用GEPIA数据库对Ualcan数据库中筛选出的共表达基因进行相关性验证,结果表明ZC3H13与VHL、PBRM1、mTOR、HIF-1α等ccRCC多种关键基因呈正相关(P<0.05),见图7。
2.6 STRING在线分析利用STRING在线分析ZC3H13与上下游蛋白的相互作用,得到以ZC3H13为中心的蛋白质互作网络图(图8)。蛋白质互作网络图主要包括WTAP、POLR2B、KIAA1429等11个基因,其中共涉及35个相互作用节点,P(PPI enrichmentP)=1.46×10-8。

A为ZC3H13与VHL的相关性分析;B为ZC3H13与PBRM1的相关性分析;C为ZC3H13与mTOR的相关性分析;D为ZC3H13与HIF-1α的相关性分析。
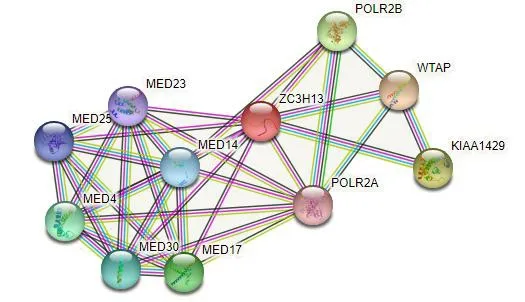
图8 STRING在线分析以ZC3H13为中心的PPI网络
3 讨论
基因组的表观遗传修饰,如组蛋白修饰、RNA修饰和DNA甲基化,在肿瘤的发生和发展中起着关键作用[10]。m6A作为一种可逆的mRNA甲基化修饰,受多种调控因子及相关复合物的影响,是真核生物中最常见的内部修饰方式,并在肝癌、肺癌、食管癌等多种肿瘤中发挥作用[11-12]。Chen等[13]研究发现,一些m6A甲基化调节剂在ccRCC中异常表达,并可作为ccRCC患者预后分层的潜在生物标志物。ZC3H13是一种参与m6A修饰甲基转移酶复合物形成的重要调控蛋白,定位于染色体13q14.13,与多种疾病和肿瘤相关。研究表明,ZC3H13通过C端与WTAP、Virilizer和Hakai的相互作用,参与m6A甲基化水平的调控,从而影响胚胎干细胞的自我更新过程[14]。ZC3H13在多种疾病中异常表达,如特发性血小板增多症、精神分裂症、胶质瘤、胃肠道肿瘤等[15-17]。在结肠癌中,ZC3H13作为肿瘤抑制因子,可能作为上游调控因子参与Ras-ERK信号通路的调控,抑制肿瘤细胞的侵袭和增殖。ZC3H13的表达下调与结肠癌患者的TNM分期和局灶淋巴结转移有关[18]。由此推断,ZC3H13可能在ccRCC中也存在差异性表达并可能影响患者预后。随着高通量测序的发展,各种数据库在医学研究中的使用也越来越多。本研究利用来自TCGA数据库的肿瘤基因芯片信息,通过Ualcan数据库的挖掘和GEPIA数据库的验证,初步发现ZC3H13mRNA在结直肠癌、肾癌、胶质瘤等多种肿瘤中差异表达。本研究结果显示,在ccRCC、PRCC、CRCC这3种亚型的肾细胞癌中,ZC3H13mRNA的表达水平低于正常肾脏组织。在ccRCC中,ZC3H13mRNA低表达组具有较短的总生存期和无瘤生存期,由此推测ZC3H13mRNA低表达与不良预后相关。此外,随着肿瘤分期和组织学分级的递增,ZC3H13mRNA表达水平呈下降趋势,这说明ZC3H13mRNA的低表达提示着肿瘤细胞更高的恶性程度和侵袭性。相关研究曾确定了ccA和ccB两者不同的ccRCC亚型[19]。既往文献报道,相对于ccA患者,ccB患者具有更低的总体生存率、癌症特异性生存率和无复发生存率[20]。在本研究进行数据库挖掘时发现,ccB亚型ZC3H13mRNA表达水平相对较低,这进一步提示ZC3H13mRNA低表达与不良预后有关。在蛋白质水平上,ZC3H13主要定位于细胞核膜和肌动蛋白丝,在ccRCC中以低表达为主,这与mRNA水平结果相一致。
从遗传学角度上来说,ccRCC来源于多个抑癌基因的相继缺失,VHL的失活和染色体3p的缺失是最先被发现的致癌事件[21]。VHL基因位于染色体3p25.3上,与散发性ccRCC相关,约90%的ccRCC存在VHL基因缺失,其突变通常伴随染色体3p的缺失[22-23]。VHL基因的缺失是ccRCC发生发展的早期事件,与肿瘤血管生成有关,是ccRCC发生、发展中的关键基因。在散发性ccRCC中,VHL基因的失活导致HIF-1α的异常表达,造成相关蛋白酶的降解,还会引起VEGF和PDGF表达水平上调而产生更多的新生血管[24]。在ccRCC患者中,HIF-1α的表达与肿瘤临床分期和病理分级有关,其阳性表达组具有较低生存率和不良预后[25]。HIF-1α与胰腺癌、乳腺癌、ccRCC等多种肿瘤的预后相关[26-27]。这为肾细胞癌的治疗提供了新的方向和靶点。PBRM1是与VHL位于同一条染色体臂上的基因,作为一个肿瘤双重抑制基因,在约45%的ccRCC中发生突变[28]。PRBM1在肿瘤中低表达,是影响ccRCC预后的不良因素。在肾细胞癌中存在mTOR活性和自噬水平不同程度的升高。mTOR是一种氨基酸蛋白激酶,参与细胞的生长、代谢等多种生物学过程,也是mTOR信号通路中重要的调控因子。mTOR参与的PI3K-AKT-mTOR信号通路调节细胞的衰老和能量代谢,并与ccRCC密切相关[29]。随着免疫及靶向治疗的兴起,mTOR成为治疗ccRCC的一个热门靶点[30]。mTOR抑制剂在ccRCC患者中已取得了一定的疗效,对改善患者预后具有重要意义[31]。本研究对ZC3H13基因进行共表达分析发现,VHL、PBRM1、mTOR、HIF-1α与ZC3H13共同表达于ccRCC中。利用GEPIA数据库进行了相关性分析,发现ZC3H13与VHL、PBRM1、mTOR、HIF-1α存在明确的相关性。VHL、PBRM1、mTOR、HIF-1α是影响ccRCC发生、发展和预后的关键基因。ZC3H13是m6A甲基化的重要基因,其低表达与ccRCC的肿瘤分期、组织学分级等相关并影响患者的生存期。因此,推测ZC3H13是影响ccRCC患者预后的潜在标志物,对其进一步研究有利于评估肾癌患者的预后。STRING在线分析结果显示,ZC3H13与多种互作蛋白共同参与RNA代谢、mRNA甲基化、雄激素受体信号通路等生物学途径,进一步提示ZC3H13可能通过影响RNA修饰及甲基化等过程在ccRCC中发挥作用。
总之,利用生物信息学的方法发现ZC3H13表达与ccRCC的临床病理特征及生存期相关。ZC3H13低表达提示肿瘤细胞有更高的侵袭性和不良预后。ZC3H13作为与VHL、PBRM1、mTOR、HIF-1α等多种ccRCC的经典基因相关的一个新基因,是未来评估ccRCC患者预后和靶向治疗的潜在分子标志物,这为患者的预后监测和治疗提供了新的方向。

